肾小管上皮细胞失去自身的细胞特性而获得肌成纤维细胞的特性,属于上皮-间质细胞转化(epithelial-mesenchymal transition,EMT)。EMT在肾脏纤维化的发生和发展中起重要作用,抑制或逆转EMT的发生和发展,已成为控制肾脏纤维化的重要途径之一[1]。转化生长因子β(TGF-β)通过结合上皮细胞表面的受体,经过Notch、β-catenin等信号途径活化EMT相关转录因子,导致EMT的发生[2,3]。研究发现多种miRNA参与EMT的调控,可能在EMT的发展进程中发挥重要作用[4]。证据表明miR-200家族通过下调ZEB基因调控EMT,随着对miRNA参与细胞表型转化中研究的不断深入,逐渐发现miR-200家族在EMT过程中起着关键性的作用[5,6]。研究报道TGF-β诱导人角质化细胞EMT过程中一些miRNA表达谱发生变化,提示TGF-β可能通过调控miRNA表达参与EMT[7]。但是目前关于TGF-β调节的miR-200家族表达机制研究鲜有报道。本研究通过在基因转录水平探讨TGF-β和miR-200家族的关系,为miR-200家族转录调控机制研究奠定初步理论基础。
1 材料和方法
1.1 材料及仪器
TRIzol(Invitrogen公司),miScript Reverse Transcription Kit(Qiagen公司),SYBR® Premix Ex TaqTM Ⅱ、 T4 DNA连接酶、高保真酶PRIME STAR、限制性内切酶XhoⅠ、NcoⅠ、NheⅠ和HindⅢ(TaKaRa公司),E.coli DH5α(本实验室保存),柱式DNA胶回收试剂盒、柱式小量质粒DNA纯化试剂盒(Axygen公司),基因组DNA提取试剂盒(Omega公司),pGL3-Basic载体、Dual-Luciferase Reporter1000 Assay System (Promega公司),脂质体Lipofectamine 2000(Invitrogen公司),人胚胎肾(human embryonic kidney,HEK)293细胞系、人肾小管上皮细胞(HK-2,本实验室保存),胎牛血清(FBS,杭州四季青生物工程材料有限公司),DMEM培养基、RPMI 1640培养基(Gibco公司),TGF-β(R&D公司)。Synergy 2 多功能酶标仪(Biotek公司)。 1.2 基因组DNA的提取 按照基因组DNA提取试剂盒说明书的具体步骤提取HK-2细胞基因组DNA。 1.3 引物设计和PCR扩增miR-200b-200a-429基因
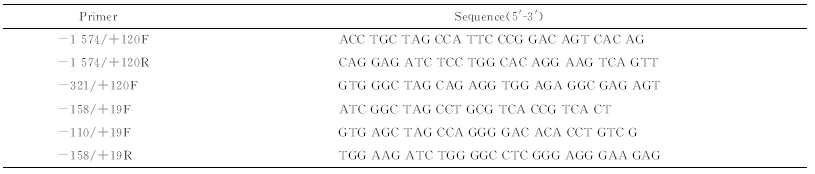
依据文献[16]报道设计miR-200b-200a-429启动子及截短体的引物,由上海生工生物工程技术服务有限公司合成,见表 1。
|
|
表 1 产生合成记录所用参数 Table 1 Parameters used to synthesize the seismic record |
扩增1 600 bp左右片段引物为:上游-1 574/+120F,下游-1 574/+120R;扩增片段400 bp:上游-321/+120F,下游-1 574/+120R;扩增片段300 bp:上游-321/+120F,下游-158/+19R;扩增片段200 bp:上游-158/+19F,下游-158/+19R;扩增片段100 bp:上游-110/+19F,下游-158/+19R。其酶切位点分别为NheⅠ、BglⅡ。以从HK-2细胞提取的基因组DNA为模板,PCR进行扩增miR-200b-200a-429启动子及其截短体。反应条件:95℃ 5 min;95℃ 30 s,58℃ 30 s,72℃ 90 s,共25个循环;72℃10 min。1%琼脂糖凝胶电泳检测并回收纯化PCR产物。 1.4 miR-200b-200a-429启动子报告基因载体的构建
将纯化后的PCR产物经NheⅠ、HindⅢ双酶切,回收酶切产物,利用T4 DNA连接酶将回收产物与双酶切后的pGL3-Basic载体连接,转化至E.coli DH5α扩增,提取质粒后双酶切鉴定,将鉴定正确的质粒送上海生工生物工程技术服务有限公司进行DNA测序。 1.5 检测报告基因荧光素酶表达活性
将HK-2和HEK293细胞分别接种到48孔板,培养24 h后待细胞生长至融合度大于80%时进行转染。将重组的荧光素酶报告基因载体pGL3-miR-200-promoter、pGL3-Basic、内参质粒pRL-TK共转染HK-2细胞,每种载体平行做3复孔,报告基因载体每孔100 ng,pRL-TK每孔5 ng,具体步骤见Lipofectamine 2000说明书。24 h后加入工作液浓度为5 ng/mL TGF-β的培养液刺激,以正常培养液培养的细胞作为对照。转染48 h后裂解细胞并收取细胞裂解液,利用 Dual-Luciferasev Reporter 1000 Assay System检测荧光素酶活性值。 1.6 TGF-β刺激HK-2细胞
将用RPMI 1640(10% FBS)培养液培养的HK-2细胞,传代到T25细胞培养瓶中,细胞融合率达到70%时,取指数生长期的细胞弃去培养液,加入工作液浓度为5 ng/mL TGF-β的培养液,以正常培养液培养的细胞作为对照,放入37℃、5% CO2 细胞培养箱中培养24 h后提取细胞总RNA。 1.7 实时定量PCR
按照Qiagen公司的试剂盒说明书步骤提取细胞总RNA并进行miRNA的反转录。配制PCR反应液后上荧光实时定量PCR仪(ABI 7500)进行反应。PCR条件:95℃10 s;95℃ 5 s,60℃ 34 s,45个循环。PCR反应体系:SYBRR Premix Ex TaqTMⅡ(2×)10 μL、miRNA Primer(10 μmol/L)0.4 μL、Universal adaptor PCR Primer 0.4 μL、DNA模板1 μL、ROX Reference Dye Ⅱ(50×)0.4 μL、dH2O(灭菌蒸馏水) 8.8 μL,共计20 μL。
实时定量PCR中所用的引物序列hsa-miR-200a primer引物5′-TAA CAC TGT CTG GTA ACG ATG T-3′;has-miR-200b primer引物5′-TAA TAC TGC CTG GTA ATG ATG A-3′;hsa-miR-429 primer引物5′-TAA TAC TGT CTG GTA AAA CCG T-3′;内参U6 forword 5′-CTC GCT TCG GCA GCA CA-3′,reverse 5′-AAC GCT TCA CGA ATT TGC GT-3′。 1.8 TFSEARCH软件分析miR-200b-200a-429启动子-110/19区域序列
登录http://www.cbrc.jp/research/db/TFSEARCH.html,在线输入miR-200b-200a-429启动子-110/19区域序列,分析启动子-110/19区域序列的转录因子结合位点。 1.9 统计学处理
使用SPSS 15.0统计学软件分析数据。采用t检验或方差分析进行组间比较,检验水准(α)为0.05。 2 结 果 2.1 TGF-β对HK-2细胞miR-200a、miR-200b和miR-429表达的影响
TGF-β(5 ng/mL)刺激HK-2细胞,24 h后收集细胞总RNA,用实时定量PCR检测miR-200a、miR-200b和miR-429表达。结果显示TGF-β作用细胞24 h后下调miR-200a、miR-200b和miR-429的表达,与对照组相比分别下调了51%、62%和42%。 2.2 miR-200b-200a-429启动子报告基因表达载体的构建和鉴定
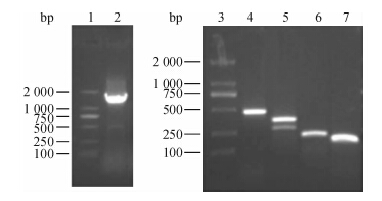
根据miR-200b-200a-429启动子序列设计截短体引物,利用PCR扩增出1 600、400、300、200、100 bp左右的目的片段(图1)。其中pGL3 -321/+19为2个条带,对2个条带分别测序鉴定,测序结果显示上面条带为目的片段,将测序正确的PCR产物克隆到质粒载体。 2.3 miR-200b-200a-429启动子报告基因荧光素酶活性的检测
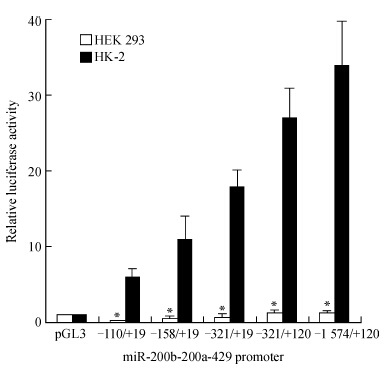
将构建好的pGL3-1 574/+120、截短报告基因载体、pGL3-basic(阴性对照)与内参质粒pRL-TK共转染至HEK293和HK-2细胞,48 h后利用双荧光素酶报告系统检测启动子活性,结果显示miR-200b-200a-429启动子载体在HK-2细胞中能够检测出荧光素酶活性,在HEK293细胞中几乎不能检测出荧光素酶活性,两者间差异有统计学意义(P<0.05)。pGL3-1 574/+120载体逐渐截短后,检测显示荧光素酶活性也依次递减(图 2)。
|
图 1 miR-200b-200a-429启动子及截短体PCR Figure 1 Agarose gel electrophoresis of miR-200b-200a-429 promoter and PCR products of truncated product 1,3: DL2000; 2: pGL3 -1 574/+120; 4: pGL3 -321/+120; 5: pGL3 -321/+19; 6: pGL3 -158/+19; 7: pGL3 -110/+19 |
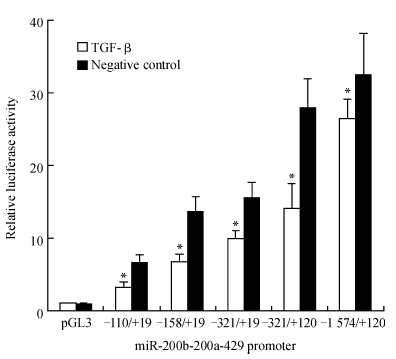
pGL3 -1 574/+120、截短报告基因载体、pGL3-basic(阴性对照)与内参质粒pRL-TK共转染至HK-2细胞,24 h后加入TGF-β(5 ng/mL),刺激24 h后检测启动子荧光素酶活性,结果显示TGF-β能够抑制启动子和各截短体的报告基因活性(P<0.05,图 3)。提示miR-200b-200a-429 启动子区域的-110/+19区间有可能存在被TGF-β调控的作用元件。
|
图 2 miR-200b-200a-429启动子报告基因及截短体在HK-2和HEK 293细胞中的活性 Figure 2 Luciferase activity of miR-200b-200a-429 promoter reporter gene and truncated product in HK-2 and HEK 293 cells *P<0.05 vs HK-2 cells. n=3,x±s |
|
图 3 TGF-β抑制HK-2细胞miR-200b-200a-429启动子报告基因及截短体的活性 Figure 3 TGF-β inhibited activity of miR-200b-200a-429 promoter reporter gene and truncated product in HK-2 cells *P<0.05 vs negative control. n=3,x±s |
TFSEARCH软件分析miR-200b-200a-429启动子-110/+19区域序列,发现该启动子区域存在Smad、c-Myc、c-Myb、Sp1等重要转录因子的结合位点。 3 讨 论
miRNA是内源性小分子非编码单链RNA,它通过与靶mRNA 3′末端非编码区 (3′untranslational region,3′-UTR)序列特异性的互补配对发挥抑制或降解靶mRNA的作用。研究表明miRNAs参与细胞的增殖和凋亡、胚胎发育、组织器官的形成和多种疾病的发生等生理病理活动重要过程[8]。同时研究发现miRNAs参与人类的疾病发生,探讨miRNAs与疾病之间的关系成为当前研究的热点[9]。miRNAs在EMT的进程中起到重要的作用,通过刺激诱导处于上皮向间充质转化的细胞和间充质细胞能够下调miR-200的表达,miR-200丢失与E-钙黏连蛋白下调相关[10]。miR-200a、miR-200b、miR-200c、miR-141和miR-429是miR-200家族成员,miR-200a、miR-200b和miR-429位于人类基因组1号染色体,miR-200c和miR-141位于人类基因组的12号染色体[11]。TGF-β在EMT过程中可以下调miR-200家族和miR-205的表达[12]。我们构建了miR-200b-200a-429的启动子报告基因载体和截短体。结果显示miR-200b-200a-429启动子报告基因载体及其截短体在HK-2细胞中活性明显的升高,说明这一片段具有启动子的活性。而在HEK293细胞中不能检测出miR-200b-200a-429启动子的活性,可能由于HK-2细胞为上皮细胞,miR-200家族在上皮细胞内高表达,而HEK293细胞属于间充质细胞,miR- 200家族在间充质细胞表达水平低[13]。我们推测在上皮细胞中miR-200启动子区域存在特异表达表达的调控元件。我们发现TGF-β能有抑制miR-200b-200a-429启动子和其截短体的活性,提示启动子-110/+19区间可能存在被TGF-β调控的作用元件。
Smad家族是TGF-β信号转导通路中关键的下游因子,在TGF-β诱导EMT过程中发挥了重要作用[6]。研究发现miR-200家族与Smad家族相互作用参与EMT的调控,Smad能够将 TGF-β的信号从胞膜受体转导入胞核内,通过调节核内靶基因转录发挥TGF-β的生物学效应[14]。研究发现通过TGF-β可以使Smad3与miR-200b-200a-429启动子区结合位点结合,活化Smad蛋白,参与调控miR-200家族,最后调控E-钙黏连蛋白的转录抑制因子Zeb1和Zeb2表达[15]。Smad7分子也参与miR-200家族的调节,其在NRK-52E细胞中过表达能够阻断TGF-β引起的miR-200家族的下调[6]。因此,TGF-β可能是依赖细胞内的Smad信号途径引起miR-200家族下调。
多种细胞和分子参与了肾脏纤维化过程,各种因素相互作用,机制十分复杂。肾小管上皮细胞EMT及其分子机制的研究为病理-临床联系提供了新的线索。本研究发现在肾小管上皮细胞中,TGF-β能够增强miR-200b-200a-429启动子活性,TGF-β可能通过调控miR-200b-200a-429启动子的活性而调节miR-200家族的表达。本研究为miR-200家族转录调控机制的研究奠定了基础。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Eddy A A.Molecular basis of renal fibrosis[J].Pediatr Nephrol, 2000,15:290-301. |
| [2] | Rhyu D Y,Yang Y,Ha H,Lee G T,Song J S,Uh S,et al.Role of reactive oxygen species in TGF-beta1-induced mitogen-activated protein kinase activation and epithelial-mesenchymal transition in renal tubular epithelial cells[J].J Am Soc Nephrol,2005,16:667-675. |
| [3] | Rastaldi M P.Epithelial-mesenchymal transition and its implications for the development of renal tubulointerstitial fibrosis[J].J Nephrol,2006,19:407-412. |
| [4] | Du R,Sun W,Xia L,Zhao A,Yu Y,Zhao L,et al.Hypoxia-induced down-regulation of microRNA-34a promotes EMT by targeting the notch signaling pathway in tubular epithelial cells[J].PLoS One,2012,7:e30771. |
| [5] | Tang O,Chen X M,Shen S,Hahn M,Pollock C A.MiRNA-200b represses transforming growth factor-beta1-induced emt and fibronectin expression in kidney proximal tubular cells[J].Am J Physiol Renal Physiol,2013,304:F1266-F1273. |
| [6] | Xiong M,Jiang L,Zhou Y,Qiu W,Fang L,Tan R,et al.The miR-200 family regulates TGF-beta1-induced renal tubular epithelial to mesenchymal transition through Smad pathway by targeting ZEB1 and ZEB2 expression[J].Am J Physiol Renal Physiol,2012,302:F369-F379. |
| [7] | Wang T,Zhang L,Shi C,Sun H,Wang J,Li R,et al.TGF-beta-induced miR-21 negatively regulates the antiproliferative activity but has no effect on EMT of TGF-beta in HaCaT cells[J].Int J Biochem Cell Biol,2012,44:366-376. |
| [8] | Bartel D P.Micrornas: genomics,biogenesis, mechanism,and function[J].Cell,2004,116:281-297. |
| [9] | Gregory R I,Chendrimada T P,Cooch N,Shiekhattar R. Human RISC couples microRNA biogenesis and posttranscriptional gene silencing[J].Cell,2005,123:631-640. |
| [10] | Tryndyak V P,Beland F A,Pogribny I P.E-cadherin transcriptional down-regulation by epigenetic and microRNA-200 family alterations is related to mesenchymal and drug-resistant phenotypes in human breast cancer cells[J].Int J Cancer,2010,126:2575-2583. |
| [11] | Bracken C P,Gregory P A,Kolesnikoff N,Bert A G,Wang J,Shannon M F,et al.A double-negative feedback loop between ZEB1-SIP1 and the microRNA-200 family regulates epithelial-mesenchymal transition[J].Cancer Res,2008,68:7846-7854. |
| [12] | Gibbons D L,Lin W,Creighton C J,Rizvi Z H,Gregory P A,Goodall G J,et al.Contextual extracellular cues promote tumor cell EMT and metastasis by regulating miR-200 family expression[J].Genes Dev,2009,23:2140-2151. |
| [13] | Sossey-Alaoui K,Bialkowska K,Plow E F.The miR200 family of microRNAs regulates WAVE3-dependent cancer cell invasion[J].J Biol Chem,2009,284:33019-33029. |
| [14] | Lan H Y.Diverse roles of TGF-beta/Smads in renal fibrosis and inflammation[J].Int J Biol Sci,2011,7:1056-1067. |
| [15] | Rosati J,Spallotta F,Nanni S,Grasselli A,Antonini A,Vincenti S,et al.Smad-interacting protein-1 and microRNA 200 family define a nitric oxide-dependent molecular circuitry involved in embryonic stem cell mesendoderm differentiation[J].Arterioscler Thromb Vasc Biol,2011,31:898-907. |
 2014, Vol. 35
2014, Vol. 35