2. 福建医科大学分子医学研究中心, 消化道恶性肿瘤教育部重点实验室, 福州 350004;
3. 福建医科大学附属协和医院省肝胆外科研究所, 福州 350001
2. Research Center of Molecular Medicine, Key Laboratory of Ministry of Education for Gastrointestinal Cancer, Fujian Medical University, Fuzhou 350004, Fujian, China;
3. Hepatobiliary Surgery Institute, Union Hospital, Fujian Medical University, Fuzhou 350001, Fujian, China
肿瘤基因治疗被认为是除了手术、放疗和化疗之外的第4种治疗手段[1]。肝细胞癌(hepatocellular carcinoma,HCC)是仅次于肺癌和结肠癌的第三大常见癌症[2],探讨HCC的基因治疗具有重要意义。蛇毒半胱氨酸蛋白酶抑制剂(snake venom cystatin,sv-cystatin)是从眼镜蛇(Naja naja atra)蛇毒中分离纯化的一种新型小分子蛋白质。我们前期通过基因工程合成sv-cystatin全基因,利用毕氏酵母系统表达生产sv-cystatin重组蛋白,证实了该蛋白可以抑制肿瘤细胞体内外侵袭转移[3],并通过基因转染技术证实sv-cystatin能够抑制多种肿瘤细胞侵袭转移,推测其具有基因治疗潜能[4]。为了进一步探讨sv-cystatin在基因治疗中的作用,本研究拟构建sv-cystatin重组腺病毒载体,探讨其对人肝癌细胞MHCC97H体内外侵袭转移的影响,为sv-cystatin在HCC基因治疗方面的开发应用提供实验依据。 1 材料和方法 1.1 材料及试剂
限制性内切酶SalⅠ、XhoⅠ、PmeⅠ和PacⅠ购自Biolab公司;脂质体Lipofectamine 2000购自Invitrogen公司。腺病毒纯化试剂盒AdEasyTM Virus Purification购自Stratagene公司。兔抗sv-cystatin由上海超世生物科技有限公司生产。纤维连接蛋白(fibronectin,FN)、基底膜基质胶(matrigel)、Transwell侵袭小室(Corning Costar 3422型,孔径8.0 μm) 均购自BD公司。
1.2 质粒、细胞系和动物腺病毒载体 pShuttle-IRES-hrGFP-1和QBI-293A细胞购自Stratagene公司,人肝癌细胞MHCC97H购自复旦大学肝癌研究所,用含10%胎牛血清的DMEM培养液进行培养。SPF级裸鼠24只,体质量(18±2) g,雄性,购自上海斯莱克实验动物有限公司,生产许可证号:[SCXK(沪)2007-0005]。
1.3 pAd-sv-cystatin重组腺病毒DNA的构建从本室保存的pUC18-cystatin质粒[5]中扩增sv-cystatin基因并克隆入pShuttle-IRES-hrGFP-1载体,正向引物CystatinAdF序列为:5′-ACG CGT CGA CGC ATG ATC CCA GGT GGT TTG TCT C-3′ (含SalⅠ酶切位点),反向引物CystatinAdR序列为:5′-CCG CTC GAG CCA AAC TTG GAA ACC ACA C-3′(含XhoⅠ酶切位点)。获得的重组载体以双酶切和测序鉴定,命名为pShuttle-IRES-hrGFP-sv-cystatin。以PmeⅠ酶切线性化重组载体,产物转化BJ5183-Ad-1感受态菌,提取质粒,将用PacⅠ酶切鉴定正确的重组子命名为pAd-sv-cystatin,转化入感受态菌XL-10Gold以获得质粒DNA。用相同方法以空载体pShuttle-IRES-hrGFP构建pAd-null。
1.4 重组腺病毒Ad/sv-cystatin包装、扩增及滴度测定按4×106个/10 cm直径培养皿接种QBI-293A细胞,24 h后,采用Lipofectamine 2000转染线性化pAd-sv-cystatin质粒(6 μg/培养皿)。荧光显微镜下观察绿色荧光(GFP),当50%细胞变圆漂浮时,回收所有细胞及培养液,并在37℃/-80℃反复冻融3次,离心后,收集上清获原代病毒,经扩增3代后获取第4代病毒备用。采用感染复数 [multiplicity of infection,MOI] 计算病毒滴度。用同样方法制备对照重组腺病毒Ad/null。获得的重组腺病毒按照AdEasyTM病毒纯化试剂盒说明书进行纯化浓缩。
1.5 Ad/sv-cystatin感染MHCC97H细胞MHCC97H 细胞以1×105个/孔接种于24孔培养板内,加入不同MOI值的重组病毒液。以培养3 d时所有细胞均表达GFP作为最适感染MOI值。以最适MOI分别加入Ad/sv-cystatin和Ad/null腺病毒,同时设置未感染对照组,用蛋白质印迹法验证蛋白表达。
1.6 Ad/sv-cystatin对MHCC97H细胞生长能力的影响MHCC97H细胞以2×103个/孔接种于96孔培养板中,待细胞融合后分别加入相应最适MOI的Ad/sv-cystatin和Ad/null腺病毒,设立未感染对照组。连续3 d每隔24 h每孔加10 μL 的CCK-8,30 min后于BioRad550型酶标仪测定,读取450 nm波长处光密度值。
1.7 Ad/sv-cystatin对MHCC97H细胞侵袭迁移能力的影响Transwell小室聚碳酸酯膜外侧包被10 μL的FN(0.5 g/L),内侧包被20 μg 的matrigel胶。小室内分别加入1×105个Ad/sv-cystatin及Ad/null感染后的MHCC97H细胞,设置未感染对照组,下室加800 μL含10% FBS的细胞培养液,24 h后用棉签擦尽上室膜面未穿膜的细胞及matrigel,未感染对照组行H-E染色后观察,Ad/sv-cystatin及Ad/null组于荧光显微镜下观察,分别计数5个视野的侵袭细胞数,取其平均值。观察迁移能力时,小室膜内侧不包被matrigel胶,余步骤同侵袭能力测定。侵袭(迁移)抑制率(%)=[1-实验组侵袭(迁移)细胞数/对照组侵袭(迁移)细胞数]×100%。
1.8 Ad/sv-cystatin对裸鼠肝癌肺转移的影响用生理盐水稀释MHCC97H细胞至5×107个/mL,在每只裸鼠右上肢腋下皮内注射0.2 mL(细胞数1×107)。10 d后随机分为3组,每组8只,分别在注射瘤细胞第10、13、16、19天向瘤体内注射0.9%NaCl(对照组,NS)、Ad/null空病毒(1×108 pfu)和Ad/sv-cystatin腺病毒(1×108 pfu),每只注射体积为100 μL。造模后6周处死裸鼠,取各组原位瘤组织称量;取各组肺组织经H-E染色后镜检,计数各组的肺转移灶,肿瘤转移抑制率(%)=(对照组平均转移数-治疗组平均转移数)/对照组平均转移数×100%。
1.9 统计学处理采用SPSS 13.0统计软件进行数据分析,计量数据以 ±s表示,多组间比较采用单因素方差分析,两两比较采用LSD检验。检验水准(α) 为0.05。
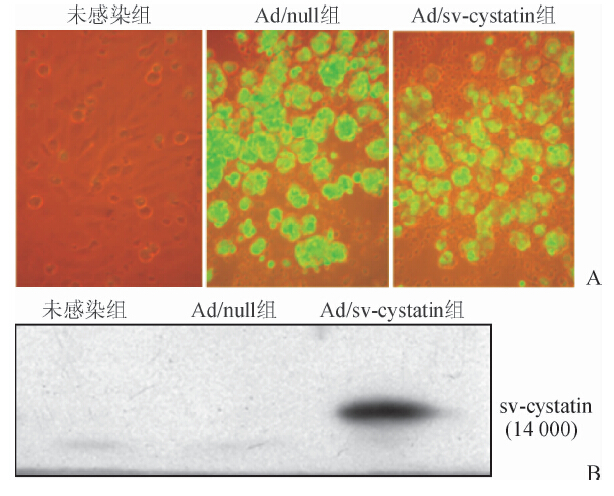
2 结 果 2.1 获得重组腺病毒获得的重组质粒pAd-sv-cystatin及pAd-null经PacⅠ酶切后电泳鉴定出现4.5 kb条带的为正确克隆,表明腺病毒质粒同源重组成功。Ad/null和Ad/sv-cystatin重组腺病毒感染MHCC97H细胞3 d时均表达GFP,MOI值分别为50、100;MHCC97H细胞对重组腺病毒敏感,100 MOI可实现100%感染。蛋白质印迹鉴定显示Ad/sv-cystatin感染MHCC97H细胞后能表达sv-cystatin蛋白。详见图 1。
|
图 1 重组腺病毒Ad/sv-cystatin感染MHCC97H细胞的绿色荧光(GFP)和sv-cystatin蛋白表达 A:Ad/sv-cystatin感染MHCC97H细胞GFP表达. Original magnification:×100; B:Ad/sv-cystatin感染MHCC97H细胞后sv-cystatin蛋白的表达 |
由图 2可见,与未感染组及Ad/null组相比,Ad/sv-cystatin在作用24、48、72 h时对MHCC97H细胞生长均具有明显的抑制作用(P<0.05)。

|
图 2 重组腺病毒Ad/sv-cystatin对MHCC97H细胞生长的抑制作用 *P<0.05与未感染组和Ad/null组比较. n=5,x±s |
细胞侵袭实验发现,Ad/sv-cystatin作用24 h后穿越matrigel的MHCC97H细胞数目明显低于未感染对照组和Ad/null感染组,抑制率分别是55%和52%。细胞迁移实验发现,Ad/sv-cystatin感染组穿过FN至小室滤膜下表面的细胞明显低于未感染对照组和Ad/null感染组,抑制率分别是24%和20%。
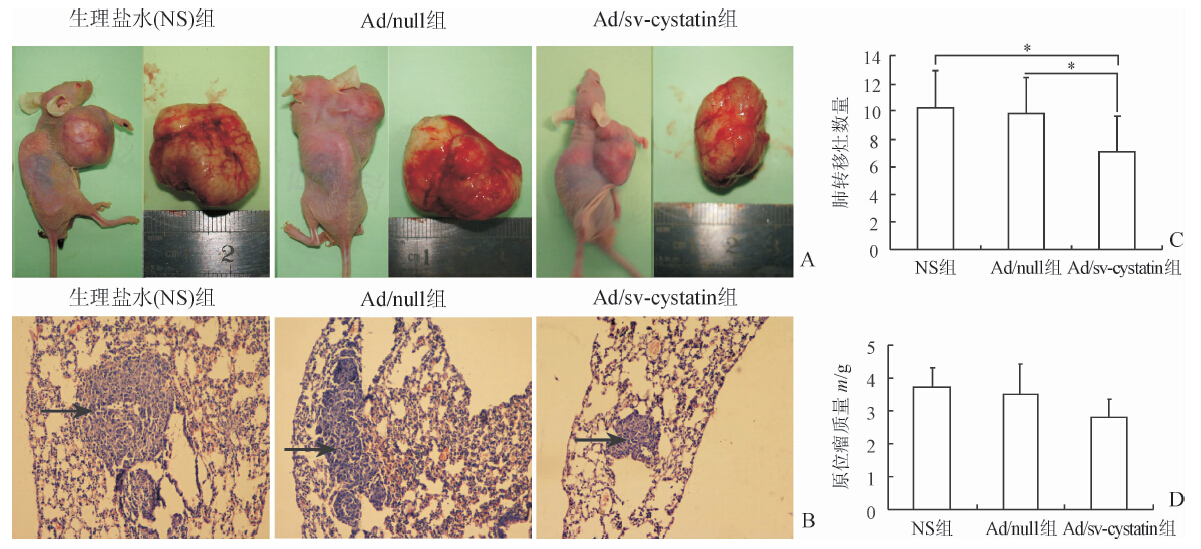
2.4 Ad/sv-cystatin对裸鼠移植瘤体内转移能力的抑制作用造模6周后,Ad/null和生理盐水(NS)组裸鼠肺部可见较多较大的肿瘤转移灶,Ad/sv-cystatin组肺转移灶数明显减少,与NS和Ad/Null组比较差异均具有统计学意义(P<0.05);与NS和Ad/null组比较,Ad/sv-cystatin组的转移抑制率分别为30%和28%。Ad/sv-cystatin治疗后的原位瘤组织质量虽有所下降,但与NS和Ad/null组相比差异无统计学意义(P>0.05)。详见图 3。
|
图 3 重组腺病毒Ad/sv-cystatin治疗对荷瘤裸鼠的影响 A: 造模结束后的裸鼠和原位肿瘤组织; B: 裸鼠肺转移灶(箭头所示) (H-E染色,Original magnification:×200); C: 各组间肺转移灶数量的比较; D: 各组间原位瘤质量的比较. *P<0.05. n=8,x±s |
Sv-cystatin是一种新型的Ⅱ型cystatin,其氨基酸序列的保守区与Ⅱ型cystatin(如cystatin C)十分相似,即具有N端的Gly序列和中部Gln-Xaa-Val-Xaa-Gly的cystatin基序[6],且都具有对半胱氨酸蛋白酶活性的调控作用,实验证实sv-cystatin具有与cystatin C等相似的抗肿瘤作用[4, 7]。Kopitz等[8]采用携带cystatin C的腺病毒治疗人纤维肉瘤细胞所致的肺转移,与空腺病毒相比大大降低了裸鼠的肺转移。本实验成功构建了携带sv-cystatin基因的重组载体,获得重组腺病毒Ad/sv-cystatin,并证实Ad/sv-cystatin具有抗肿瘤作用。
本研究将Ad/sv-cystatin直接感染处理MHCC97H细胞后,细胞的生长、迁移和侵袭等生物学特性即能受到明显抑制。采用瘤内注射腺病毒来观察对裸鼠的实验性治疗效果,发现肝癌细胞的肺转移得到有效抑制,进一步证明了Ad/sv-cystatin对MHCC97H细胞侵袭转移的抑制作用。我们的前期研究曾探讨过sv-cystatin抑瘤作用机制的多样性,可能与抑制肿瘤细胞黏附、血管生成、 信号转导、 细胞免疫和细胞凋亡等紧密相关[4, 7, 9]。瘤内注射若能抑制肿瘤生长可能与基因作用于肿瘤细胞致使其出现变性坏死或细胞凋亡等机制有关,本实验中Ad/sv-cystatin对瘤内肝癌细胞生长的抑制作用不明显可能与其作用机制较复杂等因素相关,也可能存在腺病毒表达目的蛋白时效较短等方面的原因。
我们后续研究将着手对现有的腺病毒载体进行改造,如插入分泌信号肽,利用腺病毒的嗜肝细胞特性引导sv-cystatin蛋白从感染的肝细胞分泌;或是改变重组Ad/sv-cystatin腺病毒载体的启动子为AFP组织特异启动子,使sv-cystatin蛋白只能靶向于分泌AFP的肝癌细胞,以期达到更为贴近临床试验的目的;同时也将尝试增加瘤内给药的次数、或是采用瘤内和静脉同时注射的方式来进一步提高治疗效果;当然,还将对Ad/sv-cystatin抑瘤作用机制进行深入探讨以期寻找sv-cystatin抗肿瘤作用的新靶点,为开发应用提供更丰富的实验依据。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Yan F,Zheng Y,Huang L.Adenovirus-mediated combined anti-angiogenic and pro-apoptotic gene therapy enhances antitumor efficacy in hepatocellular carcinoma[J].Oncol Lett,2013,5:348-354. |
| [2] | Wei Z,Doria C,Liu Y.Targeted therapies in the treatment of Advanced hepatocellular carcinoma[J].Clin Med Insights Oncol, 2013,20:87-102. |
| [3] | Xie Q,Tang N,Wan R,Qi Y,Lin X,Lin J.Recombinant snake venom cystatin inhibits the growth,invasion and metastasis of B16F10 cells and MHCC97H cells in vitro and in vivo[J].Toxicon,2011,57:704-711. |
| [4] | Tang N,Xie Q,Wang X,Li X,Chen Y,Lin X,et al.Inhibition of invasion and metastasis of MHCC97H cells by expression of snake venom cystatin through reduction of proteinases activity and epithelial-mesenchymal transition[J].Arch Pharm Res,2011,34:781-789. |
| [5] | 宋 军,万 榕,翁绳美,林 旭,林建银.蛇毒cystatin基因合成及其在大肠杆菌的表达[J].福建医科大学学报,2004, 38:241-245. |
| [6] | Brillard-Bourdet M,Nguyên V,Ferrer-di Martino M,Gauthier F,Moreau T.Purification and characterization of a new cystatin inhibitor from Taiwan cobra (Naja naja atra) venom[J].Biochem J,1998,331:239-244. |
| [7] | Xie Q,Tang N,Wan R,Qi Y,Lin X,Lin J.Recombinant snake venom cystatin inhibits tumor angiogenesis in vitro and in vivo associated with downregulation of VEGF-A165,Flt-1 and bFGF[J].Anticancer Agents Med Chem,2013,13: 663-671. |
| [8] | Kopitz C,Anton M,Gansbacher B,Krüger A.Reduction of experimental human fibrosarcoma lung metastasis in mice by adenovirus-mediated cystatin C expression in the host[J].Cancer Res,2005,65: 8608-8612. |
| [9] | 谢 群,万 榕,林 旭,林建银.蛇毒半胱氨酸蛋白酶抑制剂基因转染对小鼠黑色素瘤B16F1细胞基因表达谱的影响[J].癌症,2008,27:716-22. |
 2014, Vol. 35
2014, Vol. 35


