心血管功能分析对以主动脉夹层为代表的一大类血管疾病诊疗可以提供重要依据[1, 2]。新近出现了能够采集带有时间分辨率的3D相位对比MRI(phase-contrast MRI,PC-MRI),能够在3D方向上测定流速,即所谓的4D流速敏感编码(空间三维+时间一维),或称为“4D Flow”技术[3]。该技术能够较大范围覆盖感兴趣区,并能实现分析复杂的二次流特性,如涡流及螺旋流等,获取定量参数信息,但临床应用中存在诸多挑战,如无法排除呼吸、心跳的干扰等,为此急需发展更高效的后图像处理工具[4]。
鉴于目前对于无并发症的Stanford B型主动脉夹层的治疗方案选择尚无定论[5],如果能够对假腔的动脉瘤样扩张在早期作出准确诊断[6],将有利于血管腔内治疗的患者选择。假腔内血流的流型、容积及流速等在假腔的扩张破裂、血栓及动脉瘤形成中有重要价值[7]。而目前常用的成像方法在血流动力学方面所能提供的信息非常有限,4D Flow技术则具备明显优势。 因此,本研究探索应用新的后处理工具对4D PC-MRI显示Stanford B型主动脉夹层的血流动力学特性进行定量测定的可行性。 1 对象和方法 1.1 研究对象
选取2012年5月至2012年12月,海口市人民医院血管外科收治的慢性(发病后14 d以上)Stanford B型主动脉夹层患者作为研究对象(n=8),其诊断由血管外科、放射科医师共同组成的团队确认,主要依据为胸腹(包括盆腔动脉)主动脉CT平扫+增强确诊,并经对比增强的T1 3D MRI验证符合主动脉夹层诊断标准,排除Marfan综合征、Ehlers-Danlos等遗传性结缔组织病、外伤导致的夹层、梅毒性主动脉炎等。Stanford B型的分型依据为明确诊断撕裂口于左锁骨下动脉以远的主动脉夹层[8]。8例接受保守治疗的慢性B型主动脉夹层患者均成功完成全部MR检查,其中男7例,女1例,年龄32.5~75.9岁,中位年龄65岁。夹层发生时间平均14个月,伴发基础病变主要为高血压(7例)和下肢深静脉血栓形成(2例)。本研究之前在对19例健康志愿者的检查中,将全部扫描序列作好参数优化。健康志愿者年龄25~61岁,中位年龄34岁,无心血管病史,心电图表现正常,主动脉MR检查正常。全部受试者在检查前签署知情同意书。
1.2 4D PC-MRI检查及数据采集4D PC-MRI采集范围为胸主动脉全程,测定参数值包括显示每个体素空间编码方向上的流速(Vx、Vy、Vz)随时间变化、最大值、最小值及平均流速等。全部图像在Skyra 3 T 扫描仪上完成 (Siemens Healthcare,Germany) 48通道系统,32通道体部接收线圈。3D MRI 解剖数据采集:注射对比剂 Gd-DTPA之后1 min,采用单次屏气 T1 3D Flash 获取各向同性的主动脉解剖图像,前期实验证明对比剂能够填满假腔。采集参数:分段填充 k-空间的带反转恢复准备稳态自由进动序列;FOV=400 mm×253 mm×156 mm,采集体素1.5 mm3,反转角 20°,反转恢复时间 350 ms,重复时间(repetition time,TR) 4.0 ms,回波时间(echo time,TE)1.3 ms。对比增强的 T1 3D 所获解剖图像用作 4D PC-MRI定位,并进一步用作判定血栓范围。
4D PC-MRI采集:在 3D 解剖图像上设斜矢状面,采用呼吸导航及心电门控(ECG),于呼气末采集数据(25个心动周期/帧),采集序列为平衡稳态自由进动(balanced-SSFP)序列,带有流速编码梯度。参数:FOV=300 mm×300 mm×85 mm,采集体素1.9 mm×1.9 mm×2.5 mm,反转角 6°,3个梯度方向上的流速编码范围均设定为150~250 cm/s,TR 4.9 ms,TE 2.8 ms,时间分辨率 34 ms。
1.3 图像分析动态 3D 血管建模法对 4D PC-MRI 后处理:在专用工作站已装有 4D Flow 后处理模块基础上进一步开发完成,详细数据处理的工作流程见图 1。按照改进后的 4D Flow 图像处理流程,全部数据测量由2名高年资的 MRI 诊断医师独立测定,二人对患者姓名、临床病史及其他检查结果均不知情,同时评估图像,所获结果和结论在二人达成一致的基础上得出。
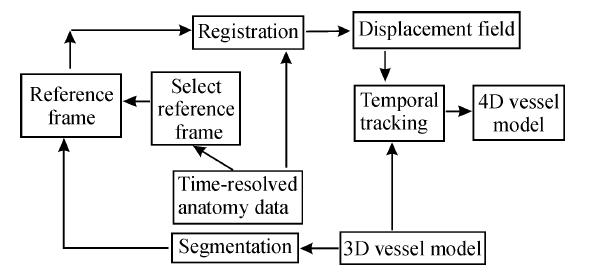
|
图 1 动态 3D 血管建模法对 4D PC-MRI数据的后处理流程 Fig 1 Processing workflow of 4D PC-MRI data by dynamic 3D vascular modeling methods |
主动脉重建及假腔血栓显示:鉴于Stanford B型主动脉夹层发生的解剖学特点,选取连续8个截面,具体选择参考图 2,同时测定真假腔的最大径,并计算主动脉总的直径,假腔内血栓形成的面积通过对增强后的 3D T1 Flash MRI手动描绘,具体层面选择参考相关文献[9]。
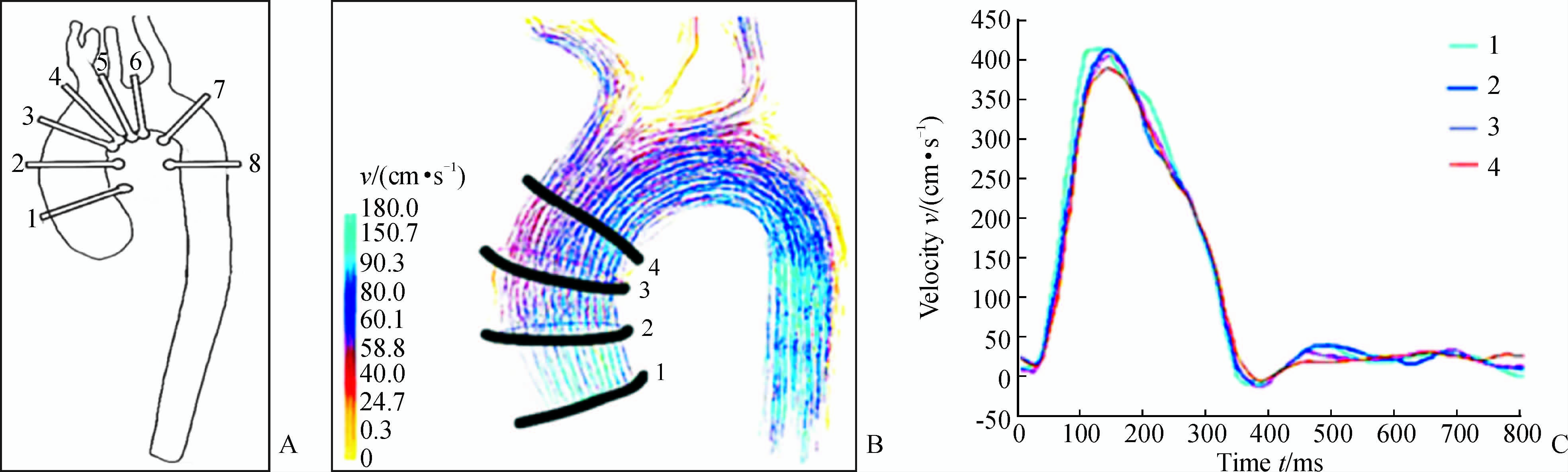
|
图 2 主动脉重建层面选择参考图 Fig 2 Reference chart for selecting aortic reconstruction level A: Schematic diagram of eight consecutive segment levels of the thoracic aorta: the ascending aorta (1-3 layers),aortic arch (4- 6 layer),and descending aorta (7,8 layer); B: Typical 4D PC-MRI flow diagram of the ascending aorta of a healthy volunteer (systolic peak flow pattern); C: Velocity variation within a cardiac cycle (1,2,3,and 4 were the average flow velocity of 4 consecutive sections with equal interval along the ascending aorta) |
定量射血容积、流速、前向及逆向血流:连续8层(图 2),在4D PC-MRI上划定真假腔轮廓、射血容积、流速及前向和逆向血流参数。采用Vel-Wall法计算壁面切应力(WSS),该方法是通过图像识别来估计管壁位置并结合PC-MRI流速数据计算WSS[10]。其基本原理如下:由PC-MRI原始数据获取流速向量场,对于血管表面任意一点,通过3D插值处理分别获得位于该处的血管壁表面、向腔内方向一个距离单位(如像素距离)及两个距离单位(如两个像素)的流速信息,进而估算每个流速向量在血管横截面方向及沿管壁表面切线方向上的对应流速。壁面切应力的估计采用公式:WSS=μ ∂v /∂n ,其中μ是牛顿流体的黏滞系数,此处取值为4.0 mPa·s(厘泊),1 mPa·s= 1,v是3D 流速向量(m/s),其值是通过对3个方向速度的最小二乘法估算出来的,n是沿着壁面方向的标准化向量(m)。
夹层撕裂口及螺旋流的可视化:在幅值图上3D显示主动脉,通过设置种子点将血流可视化。采用路线分析(pathline analysis)法显示通过该种子点的流型及路径,3D 动态显示真、假腔通过种子点的血流信息,而假腔入口显示为真腔-假腔的过渡区域。详细记录撕裂口的数目及位置,螺旋流的面积及位置。其中,螺旋流的定量包括评估旋转的度与R波之后两个连续时间点的关系,计算公式为:旋转角度(°)/[结束点(ms)-起始点(ms)]。
1.4 统计学处理采用SPSS 16.0软件进行数据分析,变量全部采用中位数(M)及四分位间距(IQR)表示,样本均值比较采用Mann-Whitney U检验。检验水准(α)为0.05。 2 结 果 2.1 动态3D血管建模法测量健康志愿者的血流动力学参数
测量结果表明,射血容积在升主动脉保持稳定(图 2的1~4层面),随着血流进入主动脉弓上血管,在降主动脉层面(图 2的7、8层面)后血流改变较小,峰值流速到达时间沿着主动脉逐渐增加。平均壁面切应力的幅值表现为轻度增加,与平均流速的变化趋势一致,为沿升主动脉-弓上血管大部分的层流,小部分形成生理性螺旋流,但是无涡流(图 2)。具体数据见表 1。
|
|
表 1 在体定量测定19名健康志愿者主动脉血流参数 Tab 1 Aortic blood flow parameters of 19 healthy volunteers M(IQR) |
血栓的形成与否及几何大小由 T1 3D MRI解剖图像来确定;4D Flow定量测定射血量、流速、前向血流及逆向血流(图 3)。(1)射血量比较:真腔(M = 54.3 mL, IQR =43.2~64.8 mL)较假腔(M = 31.6 mL,IQR=19.8~47.6 mL)高(P<0.01);(2)腔内的血流方向以前向为主(M = 91.4%,IQR= 90.0%~94.2%),假腔内逆向血流所占比例较高(M = 40.3%,IQR=23.2%~53.3%);(3)假腔内的平均流速 (M = 7.1 cm/s,IQR=4.9~9.8 cm/s) 低于真腔(M = 18.0 cm/s,IQR=13.9~20.6 cm/s;P<0.01);(4)假腔内的峰值流速于 R 波后 166.0 ms (IQR = 132.8~210.0 ms)到达,明显早于真腔215.0 ms(IQR=196.3~249.0 ms;P<0.01)。在体定量测定8例主动脉夹层患者升主动脉真腔内连续8层的血容积(mL/搏)平均值M及IQR分别为:1st(M = 80,IQR = 24);2nd(M = 80,IQR = 26);3rd (M = 72,IQR = 28);4th (M = 76,IQR = 19);5th (M = 68,IQR = 41);7th (M = 46,IQR = 21);8th(M = 45,IQR =29)。
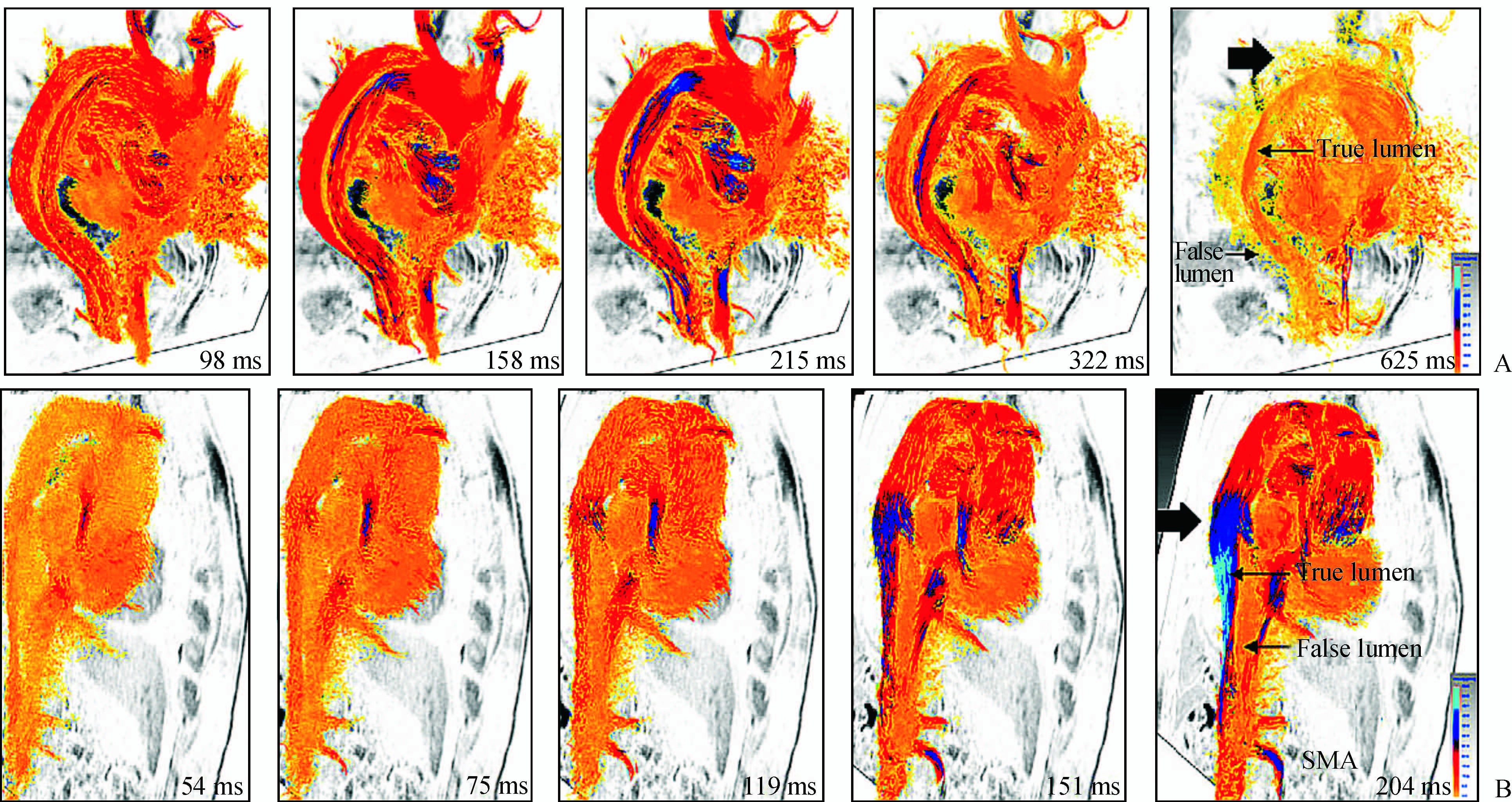
|
图 3 典型主动脉夹层患者血流重建 Fig 3 4D flow reconstruction of typical patient with Stanford type B aortic dissection A 52 years old male patient with Stanford type B aortic dissection. Entrance path analysis clearly displayed the communication between the true and false lumen. The five consecutive time points in the cardiac cycle flow diagram. A: Dissection begins with left subclavian artery false lumen entrance,while the systolic blood flows to the true and false lumen were nearly similar (158-215 ms after the R wave); B: Blood flow from the true lumen to the false lumen at proximal thoracic aorta,where the local distal tear site was visible. The blood was flowing at a high speed,along the extension of false lumens,with significant stenosis of true lumen.SMA: Superior mesenteric artery |
全部病例均可见假腔入口(8/10),其中降主动脉近端入口8个,螺旋流仅出现在假腔内,出现频率为6/8,螺旋流通常出现在收缩早期,与心率无密切关系,平均出现时间为R波后的158 ms (IQR=145~249 ms),持续 306 ms (IQR=217~537 ms),最大旋转角度为820°/搏(图 4)。

|
图 4 螺旋流显示与测量 Fig 4 Helical flow and measurement A: Helical flow within the whole length of the aortic; B: Local magnification of the helical flow in A; C: Measuring methods of the rotation angle; D,E: Different views of the helical flow changes along dissection of the aortic |
本研究与以往的研究[8, 9, 11]均提示,假腔内血流动力学改变与主动脉夹层的假腔内血栓形成与扩张相关,如低速血流伴随大量血栓形成;高速血流伴随管腔的扩张。本研究采用T1 对比增强高分辨率容积成像的方法,测定了主动脉的直径、假腔大小等,有效显示了假腔血栓。本研究对健康志愿者的壁面切应力的研究显示4D Flow技术能够相对准确可靠地获得沿主动脉走行的血流动力学参数。正常血流容积在升主动脉保持相对稳定,沿着主动脉弓平缓下降,平均壁面切应力的幅值与平均流速的变化趋势较一致,均未出现显著的异常改变。本研究结果显示正常的流型为沿升主动脉及主动脉弓上血管走行的层流,而仅小部分形成旋动流,但无涡流,这与Amano等[12]的研究结果一致。进一步应用4D Flow 技术分析 Stanford B型主动脉夹层血流动力学特征,发现对于血栓与该区域的低流速及复杂流如“螺旋流”的出现有密切联系(图 4)。这一结果与文献有关螺旋流能够促进血栓形成,导致血流相对黏滞、内皮破坏,而进一步促进血栓生长及管壁结构破坏的研究结果[13]一致。
以往通过数值模拟方法已经推测出近假腔的撕裂口局部伴随湍流及高壁面切应力的出现,而这些区域易于形成动脉瘤[7, 11]。本研究发现,在撕裂口局部往往伴有扩张的假腔,伴有“螺旋流”的出现,而且该流型的血流方向有较大比例是逆向血流。本组病例中6/8患者的螺旋流出现在假腔,出现时相为在收缩早期持续到舒张早期,而且螺旋角度较大的病例其管腔扩张程度也较大。这一结果提示进一步通过纵向研究来确定“螺旋流”旋转角度与假腔的瘤样扩张进展之间的关系,可能对B型夹层动脉瘤的诊疗具有重要意义。我们的初步研究结果提示,通过4D Flow 技术无创发现螺旋流并定量测定其旋转角度,结合壁面切应力分布及血栓形态及位置的综合评估,能够用于测定Stanford B型夹层患者的血流动力学改变,因此可能作为监控该类病变的发展及疗效的有效检查手段之一。
但 4D PC-MRI用于B型主动脉夹层的诊断仍存在诸多挑战,首先是流速测量的准确性,因病例之间差异巨大,涉及夹层的范围差别很大,如何能够在大范围内快速、准确获取相关信息是关键;其次,心跳和呼吸运动产生伪影,虽然采用呼气及心电门控技术能够在一定程度上弥补心跳和呼吸带来的伪影,但采集时间长,为4D Flow MRI图像采集与分析均带来困难;再次,如何在图像后处理过程中选择更加稳健、快速、可重复性高的处理方法也是关键问题之一。为此,本研究首次采用动态3D血管建模法,成功分析了B型主动脉夹层动脉瘤的4D PC-MRI,并初步实现了快速、准确定量评估血流参数的目的。本研究通过沿主动脉走行连续采集8层同时获取各个层面的各种血流动力学参数信息,改进了 4D PC-MRI图像后处理的流程,并在相当大的程度避免了层面选择上的低效和人为因素影响,为本研究结果的重复性提供保证。
由于受到本组病例选择例数的限制,而且Stanford B型主动脉夹层病例的真腔及假腔在不同病例之间射血容积及流速差异较大,真假腔所占比例在患者之间存在很大不同,对包括螺旋流、射血容积、流速及壁面切应力分布等的相关血流动力学参数的临床诊断意义需进一步在较大病例范围内开展,期望能找出影响预后的一系列血流动力学因素,从而帮助针对Stanford B型 主动脉夹层临床诊疗。此外,本研究未针对Stanford B型主动脉夹层患者进行动态观察,在进一步的深入研究中将通过对不同病程阶段4D PC-MRI的检查来进一步明确随着真腔的缩小及假腔的扩大对夹层血流动力学特点的影响。
4D PC-MRI作为一项检查技术能够提供丰富的血流动力学信息,可以为主动脉夹层诊疗提供更多依据,而采用动态3D血管建模法分析Stanford B型主动脉夹层的 4D PC-MRI,能够提供相对快速、准确、全面地获得相关血流动力学定量数据,有利于对该病治疗策略的选择。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Coady M A,Ikonomidis J S,Cheung A T,Matsumoto A H,Dake M D,Chaikof E L,et al.Surgical management of descending thoracic aortic disease:open and endovascular approaches: a scientific statement from the American Heart Association[J].Circulation,2010,121:2780-2804. |
| [2] | Gülsün M A,Tek H. Robust vessel tree modeling[J].Med Image Comput Comput Assist Interv,2008,11(Pt 1):602-611. |
| [3] | Wheaton A J,Miyazaki M.Non-contrast enhanced MR angiography: physical principles[J].J Magn Reson Imaging,2012,36:286-304. |
| [4] | Krishnan H,Garth C,Gühring J,Gülsün M A,Greiser A,Joy K.Analysis of time-dependent flow-sensitive PC-MRI data[J].IEEE Trans Vis Comput Graph,2012,18:966-977. |
| [5] | Trimarchi S,Eagle K A, Nienaber C A,Pyeritz R E,Jonker F H,Suzuki T,et al.Importance of refractory pain and hypertension in acute type B aortic dissection: insights from the International Registry of Acute Aortic Dissection(IRAD)[J].Circulation,2010,122:1283-1289. |
| [6] | Tsai T T,Evangelista A,Nienaber C A,Myrmel T, Meinhardt G,Cooper J V,et al.Partial thrombosis of the false lumen in patients with acute type B aortic dissection[J].N Engl J Med,2007,357:349-359. |
| [7] | Tse K M,Chiu P,Lee H P,Ho P.Investigation of hemodynamics in the development of dissecting aneurysm within patient-specific dissecting aneurismal aortas using computational fluid dynamics (CFD) simulations[J].J Biomech,2011,44:827-836. |
| [8] | 李 宇,范占明,张兆琪.MRI对急性Stanford B型主动脉夹层的形态及血液动力学的定量研究[J].中华放射学杂志,2008,42:363-367. |
| [9] | Kilner P J,Yang G Z,Mohiaddin R H,Firmin D N,Longmore D B.Helical and retrograde secondary flow patterns in the aortic arch studied by three-directional magnetic resonance velocity mapping[J].Circulation,1993,88:2235-2247. |
| [10] | Boussel L,Rayz V,Martin A,Acevedo-Bolton G,Lawton M T,Higashida R,et al.Phase contrast magnetic resonance imaging measurements in intracranial aneurysms in vivo of flow patterns,velocity fields,and wall shear stress: comparison with computational fluid dynamics[J].Magn Reson Med,2009,61: 409-417. |
| [11] | 刘 崎,陆建平,王 飞.三维增强MR血管造影在主动脉夹层诊断中的价值[J].中华放射学杂志,2005,39:1260-1264. |
| [12] | Amano Y,Sekine T,Suzuki Y,Tanaka K,Takagi R,Kumita S.Time resolved three-dimensional magnetic resonance velocity mapping of chronic thoracic aortic dissection: a preliminary investigation[J].Magn Reson Med Sci,2011,10:93-99. |
| [13] | Cunningham K S,Gotlieb A I.The role of shear stress in the pathogenesis of atherosclerosis[J].Lab Invest,2005,85:9-23. |
 2014, Vol. 35
2014, Vol. 35


