广泛参与免疫应答调控的免疫细胞,主要包括初始T细胞(naive T cells, Tnaive)、中心记忆T细胞(central memory T cells, Tcm)和效应记忆T细胞(effector memory T cells, Tem)三个亚群[1],其中Tnaive细胞在受到树突状细胞提呈的抗原刺激后分化为Tcm,后者被认为与干细胞拥有一些相似的性质,具有一定的自我更新的能力,能长期记忆抗原,在受到相同或类似抗原刺激后大量增殖并分化为Tem,通过分泌各种因子等途径发挥其免疫调节作用[2]。既往的研究大多集中于肿瘤和感染性疾病[3, 4, 5],近年来研究发现记忆T细胞也参与了动脉粥样硬化(atherosclerosis, AS)的病理过程[6],其主要表现为循环中Tnaive含量的降低和Tem比例的升高[6, 7]。
小鼠是AS最常用的实验动物,通过监测小鼠体内记忆T细胞的动态变化来评估机体的免疫状态能够极大地满足各种药物和干预研究的需要,但小鼠个体小,传统的采血方法(心脏穿刺或眼眶采血)不能满足单只小鼠重复采血的动态观察研究。小鼠隐静脉采血法的出现解决了连续序贯采血[8]及后续的流式细胞分析这一关键问题。微流式的概念最早由美国学者McFarlin提出[9],是集合微量采血和微量标本分析于一体的流式细胞学分析方法,并在Millipore公司推出的微流控流式细胞仪Guava中得到应用。目前国内实验室大多仍以传统流式细胞分析仪为主,微流式细胞分析方法能否在此类平台上开展国内外鲜有研究涉及。本研究拟进行相关的尝试和技术要点的优化,着重解决如何收集和孵育微量血样、优化抗体的使用量等实际问题, 提供确实且可操作的技术方案,以实现序贯连续采血及小鼠体内记忆T细胞亚群的动态观察,最后对C57和AS易发的载脂蛋白E基因敲除(apoE-/-)小鼠,在切换高脂饮食后体内Tem的动态演变情况进行分析。 1 材料和方法1.1 动物及材料
雄性C57小鼠(n=30),SPF级,6~8周龄,体质量(18±2) g;雄性apoE-/-小鼠(n=10),SPF级,6~8周龄,体质量(18±2)g,均由中国科学院上海药物所实验动物中心提供,生产许可证号:SCXK(沪)2008-0017 ,使用许可证号: SCXK(沪)2008-0049;流式细胞缓冲液(美国BD公司),红细胞裂解液(Sigma公司),枸橼酸钠(国药集团),PCR管(AXYGEN公司);OneComp eBeads荧光补偿微球(美国eBioscience公司),Alexa Flour488标记的抗小鼠CD3单克隆抗体(CD3-AF488),藻红蛋白(phycoerythrin, PE)标记的抗小鼠CD62L(CD62L-PE)、Alexa Flour647标记的抗小鼠CD44单克隆抗体(CD44-AF64)、PerCP/Cy5.5标记的抗小鼠CD4单克隆抗体(CD4-PECP,美国BioLegend公司);高脂饲料(美国Research Diet公司);Calibur流式细胞仪(美国Becton Dickinson公司);微量动物采血针, 针头(4 mm,美国Goldenrod公司);微量移液器(Biohit公司)。
1.2 隐静脉采血小鼠自鼠笼中取出后置入50 mL离心管(顶端留取通气孔),保留待采血的下肢在管外,采血部位预先使用脱毛膏脱毛备用,乙醇棉球消毒采血位置,按压隐静脉回流端充盈血管,刺入微量采血针,留取全血至枸橼酸钠抗凝的PCR管中,上下混合后置于冰板上备用。隐静脉采集小鼠外周血进行记忆T细胞亚群的分析(n=10),每只采集血量为10 μL,随后处死小鼠经心脏穿刺采血,进行常规标记,作为对照。
1.3 流式细胞仪的质量控制和荧光补偿矩阵的建立每天采用FacsCompCalibrate质控校正微球配合BD FACSComp软件对流式细胞仪进行质量控制,保证仪器的稳定;荧光补偿矩阵则采用以下方法:取4根流式管,加入含OneComp eBeads荧光补偿微球的流式缓冲液,震荡混匀后避光孵育30 min,洗涤1次,300 μL流式细胞缓冲液重悬上机,使用Cell Quest软件收集荧光信号,调整各通道电压和荧光补偿矩阵,保存设置备用。
1.4 记忆T细胞亚群的流式细胞分析从以下4个方面进行优化评估。 1.4.1 采血量
通过隐静脉采血法和心脏穿刺采血法,分别采集血量为微量血样(10 μL)和常规血样(50 μL)进行后续分析。50 μL常规血样加入1 μL的流式细胞抗体在室温下进行避光孵育标记,30 min后加入2 mL红细胞裂解液进行裂解,流式细胞缓冲液洗涤1次后上机检测。对同一批小鼠在每天的同一时间点采血进行流式细胞分析,计算日间变异系数(CV),以反映其重复性。
1.4.2 微量血样离心与否抗体孵育的效果与血样体积密切相关,若直接使用全血进行抗体孵育,不仅会导致血浆或血清标本的丢失,影响相关血液指标的检测,而且会增加标记抗体的用量,故我们观察分析微量血样离心与否对抗体标记有无影响。根据是否离心,可分为离心后标记组和直接标记组,离心后标记组经5000×rpm离心8 min后吸弃上清再标记抗体,直接标记组则在PCR管中直接加入抗体进行标记。 1.4.3 微量血样抗体孵育浓度
10 μL微量血样因孵育体积的减少,能缩小抗体用量,同时可避免过高背景荧光影响结果。为方便操作,抗体孵育前可事先预混,每种抗体分别取0.5、0.25、0.125、0.062 5 μL做倍比稀释,每种抗体所对应的浓度梯度为:(1)CD3-AF488:125、62.5、31.25、15.625 g/L;(2)CD4-PECP:50、25、12.5、6.25 g/L;(3)CD44-AF647:125、62.5、31.25、15.625 g/L;(4)CD62L-PE:50、25、12.5、6.25 g/L。4种抗体预混后总体积为2 μL, 体积不足者用流式细胞缓冲液补足。将抗体预混液加入微量血样中,震荡混匀后室温避光标记30 min,转入流式管中,加入1 mL的红细胞裂解液裂解3 min。
1.4.4 微量血样红细胞裂解后是否洗涤在红细胞裂解后进行洗涤可以降低非特异性染色,但洗涤这一步骤本身会导致分析细胞的潜在丢失,因此我们评估红细胞裂解后是否洗涤标本对结果的影响。红细胞裂解后分为洗涤组和非洗涤组,洗涤组加入2 mL流式缓冲液洗涤,离心弃上清后用300 μL流式缓冲液重悬上机,非洗涤组则直接上机检测。调用之前经荧光补偿微球建立的荧光补偿矩阵,采用Cell Quest软件采集数据,CD44和CD62L设门采用荧光扣除(fluorescence minus one, FMO)对照,数据离线使用Flowjo软件进行分析。
1.5 C57和apoE-/-小鼠切换高脂饮食后体内Tem的动态演变情况随机选取C57小鼠和apoE-/-小鼠各10只,给予常规饮食,再切换高脂饮食喂养4周,采用优化方法,每周定时通过隐静脉采血对小鼠体内Tem比例的变化进行动态检测。
1.6 统计学处理采用SPSS 11.5软件进行统计学分析,数据以x±s表示,组间差异采用两独立样本t检验进行比较。检验水准(α)为0.05。
2 结 果 2.1 微量血量对抗体标记的影响通过隐静脉采血和心脏穿刺采血,发现CD4+Tnaive、CD4+Tcm、CD4+Tem亚群比例分别为:(78.5±6.5)% vs (18.3±6.8%)、(3.3±2.0)% vs (3.9±1.5)%、(12.4±3.6)% vs (13.1±3.4)%,差异无统计学意义(P>0.05),见图 1。且微量采血重复性好(日间CV<3.2%),提示10 μL血量即能满足流式细胞分析的需要。
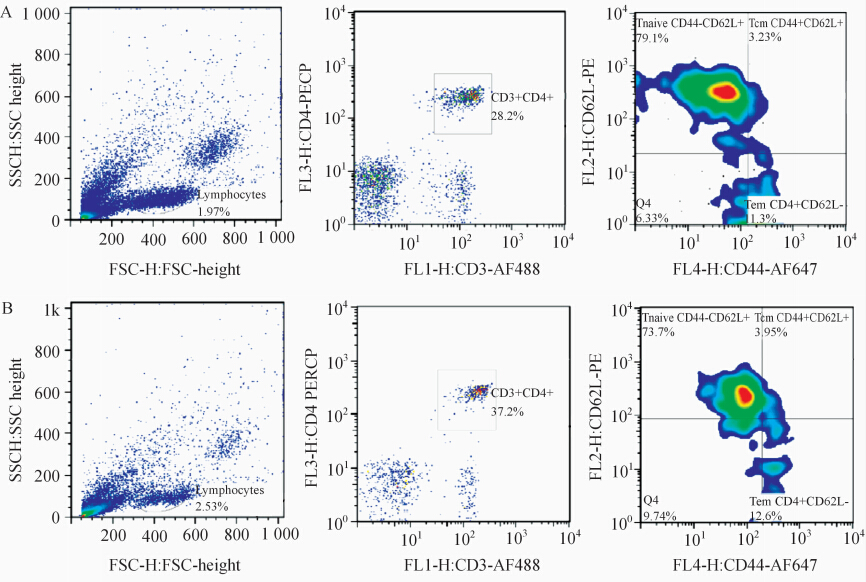 | 图1 常规血样与微量血样标记抗体分析C57小鼠记忆T细胞亚群Fig 1 Analysis of memory T cell subsets in C57 mouse using routine blood samples and minimal volume blood samples A: Routine blood samples; B: Minimal volume blood samples. From the left to right, the following flow cytometry analysis strategies were used: firstly lymphocytes were selected by FSC/SSC gating, then the double positive T cell subsets were chosen from the CD3/CD4 plot, within which T memory subset cells were analyzed with CD622L/CD44 plot. Data are representative of six separate experiments. |
实验发现随着抗体使用的减少,记忆T细胞亚群的分界更为明显,每种抗体量为0.125 μL(图 2中第3图)时最为清楚,当抗体量降低至0.062 5 μL(图 2中第4图)时,分界反而不清楚,故后续实验使用每种抗体0.125 μL进行孵育标记,即CD3-AF488浓度为31.25 g/L、CD4-PECP浓度为12.5 g/L、CD44-AF647浓度为31.25 g/L、CD62L-PE浓度为12.5 g/L。
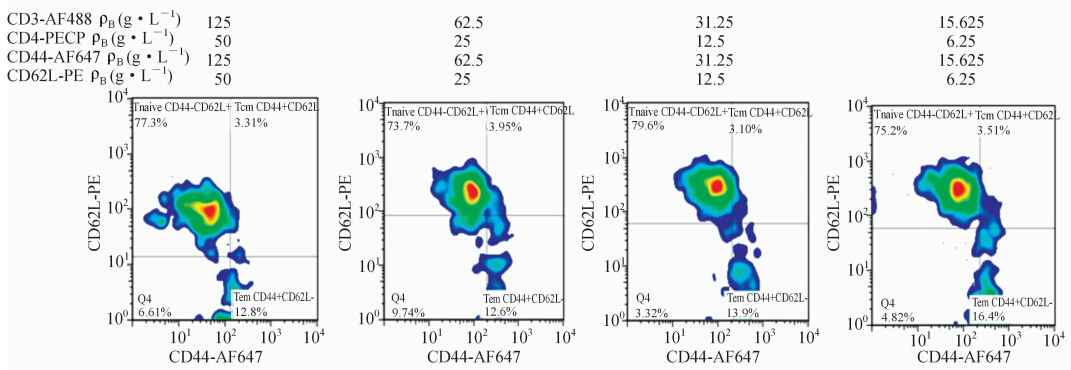 | 图 2 不同抗体浓度对标记C57小鼠CD4+记忆T细胞比例的影响Fig 2 Influence of different concentrations of antibodies on detecting CD4 positive memory T cell subsets |
结果提示离心与否对于抗体标记区分记忆T细胞亚群影响无统计学意义(P>0.05)。
2.4 红细胞裂解后是否洗涤对标记的影响发现洗涤可降低背景荧光,改善4种亚群的分界,但洗涤与否对标 记的各亚群比例影响无统计学意义(P>0.05,图 3)。
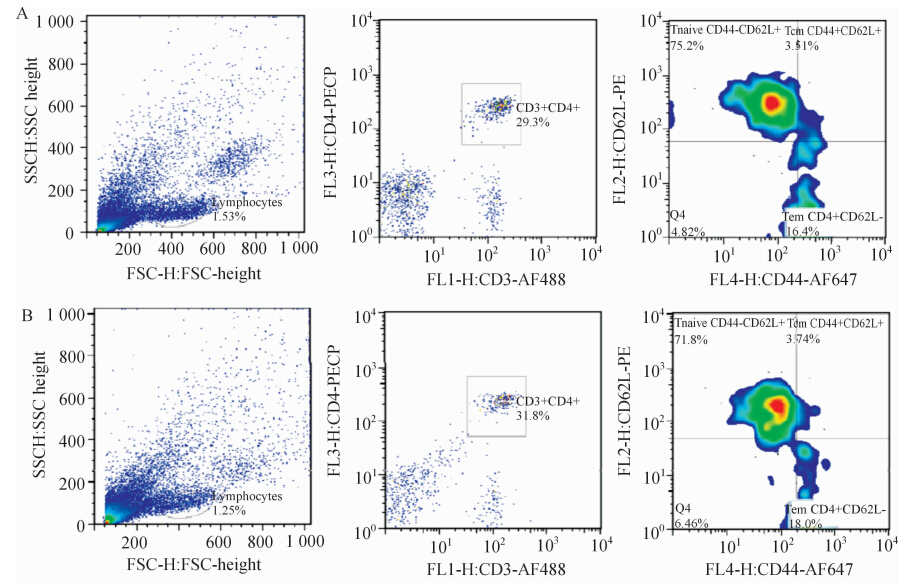 | 图3 微量血样红细胞裂解后洗涤与否对C57小鼠记忆T细胞亚群分析的影响Fig 3 Influence of washing after lysis of erythrocytes in minimal volume blood samples on detecting results of memory T cell subsets of C57 mice A: No washing after lysis of erythrocytes; B: Washing after lysis of erythrocytes. |
采用10 μL全血加入0.125 μL抗体孵育、红细胞裂解后不洗涤的优化方法,对切换高脂饮食的C57小鼠和apoE-/-小鼠的Tem的比例进行动态观察,结果如图4所示。结果发现:(1)在常规饮食阶段,因为基因背景的不同,apoE-/-小鼠的Tem比例高于C57小鼠,差异有统计学意义(P>0.05);(2) 从常规饮食切换至高脂饮食,C57小鼠和apoE-/-小鼠Tem的比例均出现不同程度的增高,其中apoE-/-小鼠在高脂饮食3周后基本达到平台,而C57小鼠在高脂饮食2周即达到平台;(3) apoE-/-小鼠高脂饮食1周后Tem水平高于常规饮食基线水平,差异具有统计学意义(P<0.05)。结果提示,apoE-/-小鼠在AS斑块进展早期即出现免疫调节紊乱。
 | 图4 C57和apoE-/-小鼠在切换高脂饮食后体内Tem比例的动态演变Fig 4 Dynamic change of Tem proportions in C57 and apoE-/- mice after switching to high fat diet from chow diet*P<0.05 vs C57 mice;△P<0.05 vs chow diet .n=10, x±sTem: Effector memory T cells |
微流式序贯采血能够实现单一个体动物体内免疫功能的动态监测,符合动物实验伦理的3R[替代(replacement)、减少(reduction)和优化(refinement)]原则[10, 11]。该整体方案的应用一方面可节省实验动物的用量,节约人力和流式细胞抗体的消耗,另一方面也能提供既往单一动物和单一时间点分析模式所无法获得的数据,如在不同给药组apoE-/-小鼠记忆T细胞的动态观察,血样离心后获得的血清还能进行细胞因子检测(luminex和CBA微球分析方法),提供机体的免疫、炎症等诸多信息。
本研究对隐静脉采血和相关后续流式分析流程进行了优化,经过大量实验动物的验证基本能达到常规采血分析的敏感度,在稳定性方面,除了仪器的质控,还对同一批小鼠血样抗体标记,4%多聚甲醛固定后在不同时间点上机检测及同一批小鼠每天的同一时间点采血标记检测,对上述数据的分析比对证实上述方法的结果重复性好且稳定可靠。结论如下:(1)经隐静脉采血可根据需要留取10~50 μL的血量(极量为100 μL),该采血法可无需对实验动物进行腹腔或者气体吸入麻醉,能够满足多次重复采血及后续分析的需要。研究人员在熟悉相关操作要点后可在5 min内完成小鼠的采血操作,同时该采血方法可在小鼠的左右下肢轮流进行,最多可满足间隔24 h的连续采血,由于使用的是特制采血针,能在满足采血量的同时最大程度减少对实验动物的损伤,且小鼠的凝血系统极为发达,采血部位短时间按压即可止血。此外,这种采血方法原则上也可被用于其他小型动物及新生儿采血等相关的基础或临床研究。(2)采血后高速离心分离血细胞可缩小抗体孵育体积,进一步节省抗体的用量,同时离心可降低荧光背景,有利于亚群界限的划分,但离心会导致操作时间的延长,因此是否离心操作可根据实验的实际需要进行。(3)优化抗体浓度能在保证检测结果准确且重复性好的前提下,进一步降低抗体用量以及背景荧光的干扰。(4)红细胞裂解后洗涤血样标本可降低背景荧光,但可能会导致分析细胞的丢失。考虑到红细胞裂解后如不洗涤样本,细胞长时间在红细胞裂解液中会带来细胞活力降低和非特异性荧光染色增加等潜在风险,影响结果的准确性,是否洗涤需要根据实际样本的数量和上机等待时间确定,样本数量少、等待时间短则无需洗涤,反之则需要洗涤后低温保存待测。(5)C57小鼠和apoE-/-小鼠由于基因背景的不同,其体内Tem比例的基线水平也不相同。常规饮食切换高脂饮食后,C57小鼠和apoE-/-小鼠的Tem比例均出现不同程度的增高,而apoE-/-小鼠在AS病变早期即出现免疫调节紊乱,通过对不同时间点的Tem等免疫系统的动态检测,可加快筛选有效干预药物的进程。
在研究中需要注意和考虑以下问题:(1)本研究所使用的10 μL全血仅对记忆T细胞这类比例较高的细胞适用,对于低比例的细胞分析则需要增加血量,而如果分析内皮祖细胞、干细胞等稀有细胞则需要经心脏穿刺法采集的血量才能满足流式细胞学分析的需要;(2)PCR管具有低吸附特性,可使操作更加便利并节省抗体用量,为此本研究采用PCR管进行标本抗体的孵育。直接使用流式管进行小体积标本的孵育,微量血样会黏附于管壁上,从而导致样本的干涸丢失及抗体孵育不充分,最终影响结果的准确性;(3)对于所采用的抗体可根据实际需要和实验目的的不同进行更换,比如加入考察细胞活力的染料或者改用其他抗体以满足诸如B细胞、NK细胞和单核细胞亚群分析的需要,扩展微量采血和流式细胞学分析的应用领域。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Medzhitov R,Shevach E M,Trinchieri G,Mellor A L,Munn D H,Gordon S,et al.Highlights of 10 years of immunology in Nature Reviews Immunology [J].Nat Rev Immunol,2011,11:693-702. |
| [2] | Farber D L,Yudanin N A,Restifo N P.Human memory T cells:generation,compartmentalization and homeostasis[J].Nat Rev Immunol,2014,14:24-35. |
| [3] | Karthikeyan S,Geschwind J F,Ganapathy-Kanniappan S.Tumor cells and memory T cells converge at glycolysis:therapeutic implications[J].Cancer Biol Ther,2014, 15.[Epub ahead of print] |
| [4] | Tabler C O,Lucera M B,Haqqani A A,McDonald D J,Migueles S A,Connors M,et al.CD4+ memory stem cells are infected by HIV-1 in a manner regulated in part by SAMHD1 expression[J].J Virol,2014,88:4976-4986. |
| [5] | Jiang W,Younes S A,Funderburg N T,Mudd J,Espinosa E,Davenport M P,et al.Cycling memory CD4+ T cells in HIV disease have a diverse TCR repertoire and a phenotype consistent with bystander activation[J].J Virol,2014, 12.[Epub ahead of print] |
| [6] | Olson N C,Doyle M F,Jenny N S,Huber S A,Psaty B M,Kronmal R A,et al.Decreased naive and increased memory CD4+ T cells are associated with subclinical atherosclerosis:the multi-ethnic study of atherosclerosis[J].PLoS One,2013,8:e71498. |
| [7] | Ammirati E,Cianflone D,Vecchio V,Banfi M,Vermi A C,De Metrio M,et al.Effector memory T cells are associated with atherosclerosis in humans and animal models[J].J Am Heart Assoc,2012,1:27-41. |
| [8] | Peakman M,Tredger J M,Davies E T,Davenport M,Dunne J B,Williams R,et al.Analysis of peripheral blood mononuclear cells in rodents by three-colour flow cytometry using a small-volume lysed whole blood technique[J].J Immunol Methods,1993,158:87-94. |
| [9] | Breslin W L,Strohacker K,Carpenter K C,Haviland D L,McFarlin B K.Mouse blood monocytes:standardizing their identification and analysis using CD115[J].J Immunol Methods,2013,390(1-2):1-8. |
| [10] | Schiffelers M J,Blaauboer B J,Hendriksen C F,Bakker W E.Regulatory acceptance and use of 3R models:a multilevel perspective[J].ALTEX,2012,29:287-300. |
| [11] | Hooijmans C R,de Vries R,Leenaars M,Curfs J, Ritskes-Hoitinga M.Improving planning,design,reporting and scientific quality of animal experiments by using the Gold Standard Publication Checklist,in addition to the ARRIVE guidelines[J].Br J Pharmacol,2011,162:1259-1260. |
 2014, Vol. 35
2014, Vol. 35


