炎症小体(inflammasome)是一类存在于细胞质中的多蛋白复合物,2002年Martinon等[1]首次对其进行描述。作为固有免疫系统的感受器,炎症小体能被多种类型的病原体或危险信号所激活,通过多个信号通路诱导细胞因子及炎症介质的释放,引发炎症反应[2]。炎症小体也在多种疾病如肿瘤、糖尿病、老年痴呆等[2,3]的形成过程中起重要作用。目前研究最多的NLRP3炎症小体是由Nod样受体家族蛋白3(Nod-like receptor family,pyrin domain-containing 3,NLRP3)和凋亡凝集样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)及caspase-1前体(pro-caspase-1)组成的蛋白复合物[4]。炎症小体活化后可使pro-caspase-1转化为有活性的caspase-1,后者裂解白介素1β前体(pro-IL-1β)及白介素18前体(pro-IL-18),形成并分泌有活性的IL-1β和IL-18[5],IL-1β和IL-18在适应性免疫应答方面发挥重要作用[6,7]。
尽管目前国内部分单位也开展了炎症小体的相关研究,但并未见在NLRP3基因敲除小鼠动物模型上的实验研究报道。本课题组为了开展NLRP3炎症小体相关的药理学与毒理学研究,于2013年10月引进了NLRP3基因敲除杂合子小鼠。现将从NLRP3基因敲除杂合子小鼠获得NLRP3基因敲除纯合子小鼠的繁殖及鉴定过程作一报告。 1 材料和方法 1.1 实验动物
NLRP3基因敲除杂合子(NLRP3+/-)小鼠从北京唯德生物科技有限公司引进,利用TALEN(transcription activator-like effector nucleases)技术获得,品系为C57BL/6,SPF级,共3只(2雄1雌)。野生型(wide type,WT)C57BL/6小鼠由上海西普尔-必凯实验动物有限公司提供,生产许可证号:SCXK(沪) 2008-0016,合格证号:2008001631246,使用许可证号:SYKX(沪) 2012-0003,SPF级条件饲养。 1.2 主要试剂及仪器
鼠尾裂解液(北京康为世纪生物科技有限公司);EDTA、异丙醇均为分析纯(上海医药集团上海化学试剂公司);蛋白酶K(protease K)、2× Taq PCR Master Mix、AL2000 DNA Marker、5×TBE、1 mol/L Tris-HCl、10%SDS(北京艾德莱生物科技有限公司);T7核酸内切酶1(T7 endonuclease 1,T7E1,北京唯德生物科技有限公司);琼脂糖(美国Amresco公司);6×Loading buffer(日本TaKaRa BIO株式会社)、溴化乙啶(EB)溶液(上海莱枫生物科技有限公司)。DK-8D型三孔电热恒温水槽(上海一恒科技有限公司);UNO-Ⅱ型PCR仪(美国Biometra公司);Eppendorf 5804R低温离心机(德国Eppendorf AG);FR-250电泳仪、FR-980A生物电泳图像分析系统(上海复日科技有限公司)。
1.3 基因敲除小鼠的饲养和繁殖 NLRP3基因敲除杂合子小鼠引进后,置于第二军医大学药物安全性评价中心SPF级动物房内饲养和繁殖。饲养温度18~22℃,相对湿度40%~70%,明暗循环12h/d,自由饮食和饮水。小鼠笼盒、玉米芯垫料及饲料、饮用水均经过高温高压消毒灭菌处理。饲养过程中,每天进入SPF动物房观察和记录小鼠的生长情况。每周更换3次小鼠垫料,每天补充饲料和饮用水。繁殖初期1只雄鼠与1只雌鼠进行合笼,小鼠的性成熟期为8周左右,母鼠妊娠期为21 d左右,繁殖出F2代子鼠后,1只雄鼠与2只雌鼠进行合笼。配种小鼠定期给予灭菌葵花籽以补充营养。
1.4 小鼠的基因型鉴定 由于引进的NLRP3基因敲除小鼠均为杂合子,其子代可能出现野生型(NLRP3+/+)、杂合子(NLRP3+/-)和纯合子(NLRP3-/-)3种表型,故需对子代进行基因型鉴定。
剪取绿豆大小的小鼠耳朵放入1.5 mL EP管中,加入500 μL裂解液,55℃水浴过夜。隔天 12 000×g离心5 min, 转移上清至另一新的1.5 mL EP管中,加入同等体积异丙醇,轻轻混匀,室温静置10 min,12 000×g离心10 min。弃上清,将沉淀溶解于适量TE缓冲液中,即得DNA。 1.4.2 PCR扩增反应及琼脂糖凝胶电泳进行基因型鉴定
引物由北京唯德生物科技有限公司设计,NLRP3基因引物分别是正向: 5′-GTT TTC ATT CCT GCA CTG CCA GTG-3′;反向: 5′-CAA AAA CCC TTC TGT TTA CTC ACT C-3′。PCR扩增:根据2× Taq PCR Master Mix使用说明,按25 μL反应体系进行扩增。分别加入如下反应物:DNA模板 3 μL、前段引物(20 μmol/L)1 μL、后段引物(20 μmol/L)1 μL、2× Taq PCR Master Mix(0.1 U/μL)12.5 μL,加ddH2O补足至25 μL。其中,DNA模板中有一组为对照组,即野生型小鼠DNA,其余为实验组,即F1代杂合子交配繁殖的F2代子鼠DNA。PCR反应循环设置如下:94℃预变性3 min;94℃变性30 s、55℃退火30 s、72℃延伸1~2 kb/min,循环40次;72℃ 5 min终止反应。 将上步反应得到的实验组和对照组PCR扩增产物按照如下反应体系进行退火处理。1号管加实验组PCR产物5 μL;2号管加实验组PCR产物2.5 μL,对照组PCR产物2.5 μL;3号管加对照组PCR产物5 μL;4号管加对照组PCR产物5 μL;再分别向1、2、3、4号管中各加入1.1 μL T7E1 1×buffer、4.4 μL ddH2O。放入95℃水浴锅5 min,自然冷却至室温;再向1、2、3管中分别加入0.5 μL T7E1酶,37℃反应30 min。取T7E1酶切后各管产物8 μL进行1.5%琼脂糖凝胶电泳。根据以下3种情况判断小鼠为野生型、杂合子亦或是纯合子:(1)纯合子小鼠:样品小鼠的PCR产物自我杂交,经T7E1酶切,只有一种带型(和野生型带差不多);而样品小鼠的PCR产物与野生型鼠的PCR产物杂交,出现两种带型(突变体带和野生型带)。(2)杂合子小鼠:样品小鼠自我杂交,经T7E1酶切,出现两种带型(突变体带和野生型带);而样品小鼠的PCR产物与野生型鼠的PCR产物杂交,也出现两种带型(突变体带和野生型带)。(3)野生型小鼠:样品小鼠自我杂交,经T7E1酶切,只有一条带;而样品小鼠的PCR产物与野生型鼠PCR产物杂交也出现一条带。 2 结 果 2.1 小鼠的繁殖和生长情况
杂合子母鼠共生育8只F2代小鼠, 生长发育见图1,与野生型C57BL/6 小鼠相比未见明显异常。
 | 图1 F2代1周龄小鼠(A)和5周龄小鼠(B) |
F2代8只小鼠中1、3、4、6、7、8号为雄鼠,2、5号为雌鼠。其各自基因型鉴定结果见图2。
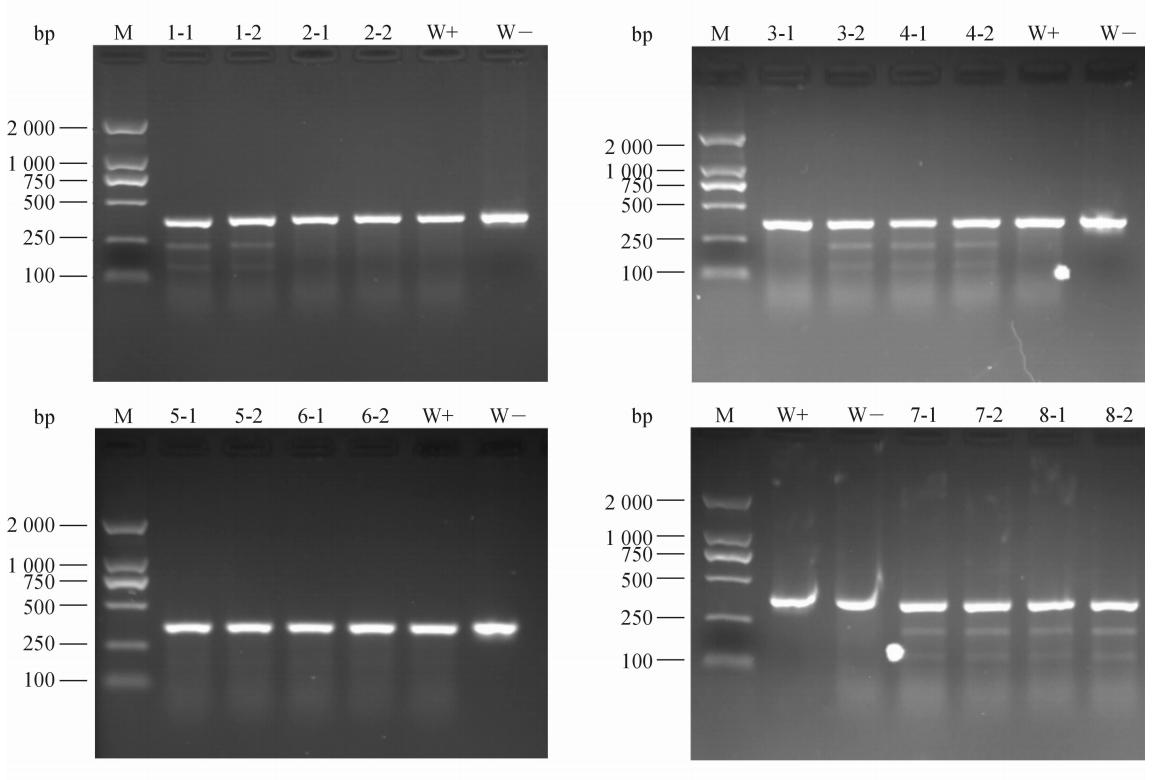 | 图2 F2代小鼠基因型鉴定结果 M:AL-2000 DNA标记物; 1-1, 2-1, 3-1, 4-1, 5-1, 6-1, 7-1, 8-1:F2代N号小鼠DNA自我杂交组(N:动物编号); 1-2, 2-2, 3-2, 4-2, 5-2, 6-2, 7-2, 8-2:F2代N号小鼠和野生型小鼠DNA杂交组(N:动物编号); W+:野生型小鼠DNA自我杂交组(加T7E1酶); W-:野生型小鼠DNA自我杂交组(不加T7E1酶) |
根据NLRP3 PCR引物和发生突变的位置,经T7E1酶切后会出现不同的DNA带型:野生型条带为366 bp,突变体条带为2条,分别为226 bp和140 bp。经T7E1酶切后,根据前文所述基因型判断方法可知:3号小鼠自我DNA杂交后出现一条带,与野生型小鼠DNA杂交后出现两条带,故为纯合子小鼠;1、4、7、8号小鼠无论是自我DNA杂交组还是与野生型小鼠DNA杂交组,都出现两条带,故为杂合子小鼠;2、5、6号小鼠无论自我DNA杂交组还是与野生型小鼠DNA杂交组,都出现一条带,故为野生型小鼠。 3 讨 论
天然免疫是机体防御病原体的第一道防线,主要通过模式识别受体(pattern recognition receptors, PRRs)来识别病原相关分子模式 (pathogen associated molecular patterns, PAMPs),第一时间产生免疫应答、快速清除病原体[8]。其中Nod样受体(Nod-like receptors, NLRs)是模式识别受体中非常重要的一类[9]。迄今为止已发现人体内含有23种NLR家族蛋白分子,而小鼠体内则已发现35种[10]。目前已经发现多种内源性刺激因素如病毒、真菌和细菌等多种病原体及其PAMPs均能刺激NLRP3炎性小体的组装、活化,细菌成孔毒素也能诱导NLRP3炎性小体的组装;而胞外危险信号如ATP、单钠尿酸、β-淀粉样蛋白和多种环境损伤同样能引起NLRP3的活化。有研究发现激活的NLRP3炎症小体能够通过引起肝细胞炎症而发挥保护作用,从而促进肝脏恢复稳态;而慢性肝炎时炎症小体长期激活,能够诱导肝脏细胞死亡,代偿性地引起肝细胞增殖和肝脏再生[11]。在肠炎模型中也发现NLRP3炎症小体的激活对于肠炎具有保护作用;同时发现NLRP3炎症小体还能抑制肠炎相关性肿瘤的发生[12]。因此,NLRP3炎症小体是机体的保护屏障之一,具有重要的研究意义。
2009年科学家揭示了植物病原菌-黄单胞杆菌(Xanthomonas spp.)中TALE蛋白的氨基酸序列与靶位点DNA序列间逐一对应且能特异性识别并结合的重大发现[13],并在此基础上开发了TALENs技术。作为一种崭新的分子生物学技术手段,TALENs技术克服了早前许多基因修饰技术如锌指蛋白(zinc finger protein,ZFP)等不能靶向所有序列、脱靶切割、设计繁复等缺点,能特异性实现对任意靶目标DNA的敲除、敲入或点突变[14]。其主要原理是利用TALE和ForkⅠ限制性核酸内切酶的催化区域融合为TALEN,保留TALE的DNA靶序列特异识别功能及ForkⅠ的DNA酶活性[15],目前已成功在斑马鱼、线虫、大鼠小鼠、果蝇和细胞等物种实现了基因组定点突变[16]。本教研室引进的NLRP3基因敲除小鼠,系通过TALEN技术剪切目标基因外显子DNA,使DNA发生修复后形成移码突变,从而使控制NLRP3蛋白表达的基因失活,达到实现NLRP3基因敲除的目的。该基因敲除动物模型的构建在国内尚属首次。同时为了更全面地研究NLRP3炎症小体激活对相关疾病病理生理的影响,我们还引进了NLRP3炎症小体相关的其他基因敲除小鼠(ASC-/-小鼠、Caspase-1-/-小鼠),用同样的方法进行饲养、繁殖和基因型鉴定,为科研工作提供了有力保障。
引进的基因敲除小鼠严格遵循SPF级动物标准管理,饲养和繁殖方法参照文献 [17]进行。由于本次引进的NLRP3基因敲除小鼠均是杂合子,所以其子代可能出现NLRP3+/+、NLRP3+/-、NLRP3-/- 3种表型,我们采用PCR扩增小鼠基因组DNA、再用T7E1酶切的方法成功进行了基因型鉴定。为了确保T7E1酶质量安全可靠,每块琼脂糖凝胶电泳时,相应增加了一孔不含T7E1酶的对照组,即只加入野生型小鼠DNA扩增产物5 μL,95℃ 5 min冷却到室温后,不加T7E1酶切,直接37℃ 反应30 min。从上述鉴定结果来看,对照组野生型小鼠DNA加入和不加入T7E1酶均为一条带,即366 bp。说明T7E1酶作用显著有效,可以用来鉴定小鼠基因型。杂合子小鼠交配后,可得到部分纯合子(NLRP3-/-)的子代,用于科研工作,而杂合子(NLRP3+/-)子代可以保种用。实验过程中,为不影响小鼠正常生长、保证存活率,我们选择出生3周左右即离乳后小鼠,剪取耳部组织进行基因鉴定。目前通过一段时间的饲养、繁殖和鉴定,我们已经获得了较多的NLRP3-/-小鼠,同时也获得了部分ASC-/-小鼠、Caspase-1-/-小鼠。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Martinon F,Burns K,Tschopp J.The inflammasome:a molecular platform triggering activation of inflammatory caspases and processing of pro-IL-beta [J].Mol Cell,2002,10:417-426. |
| [2] | Menu P,Vince J E.The NLRP3 inflammasome in health and disease:the good,the bad and the ugly [J].Clin Exp Immunol,2011,166:1-15. |
| [3] | De Nardo D,Latz E.NLRP3 inflammasomes link inflammation and metabolic disease[J].Trends Immunol,2011,32:373-379. |
| [4] | Lamkanfi M,Dixit V M.Inflammasomes and their roles in health and disease[J].Annu Rev Cell Dev Biol,2012,28:137-161. |
| [5] | Carneiro L A,Magalhaes J G,Tattoli I,Philpott D J,Travassos L H.Nod-like proteins in inflammation and disease[J].J Pathol,2008,214:136-148. |
| [6] | Ghiringhelli F,Apetoh L,Tesniere A,Aymeric L,Ma Y T,Ortiz C,et al.Activation of the NLRP3 inflammasome in dendritic cells induces IL-1beta-dependent adaptive immunity against tumors [J].Nat Med,2009,15:1170-1178. |
| [7] | Wen H,Miao E A,Ting J P.Mechanisms of NOD-like receptor-associated inflammasome activation [J].Immunity,2013,39:432-441. |
| [8] | Fukata M,Vamadevant A S,Abreu M T.Toll-like receptors (TLRs) and Nod-like receptors (NLRs) in inflammatory disorders [J].Semin Immunol,2009,21:242-253. |
| [9] | Takeuchi O,Akira S.Pattern recognition receptors and inflammation.[J].Cell,2010,140:805-820. |
| [10] | Schroder K,Tschopp J.The inflammasomes [J].Cell,2010,140:821-832. |
| [11] | Wei Q,Mu K,Li T,Zhang Y,Yang Z,Jia X.Deregulation of the NLRP3 inflammasome in hepatic parenchymal cells during liver cancer progression [J] .Lab Invest,2014,94:52-62. |
| [12] | Zaki M H,Boyd K L,Vogel P,Kastan M B,Lamkanfi M,Kanneganti T D.The NLRP3 inflammasome protects against loss of epithelial integrity and mortality during experimental colitis [M].Immunity,2010,32:379-391. |
| [13] | Boch J,Scholze H,Schornack S,Landgraf A,Hahn S,Kay S,et al.Breaking the code of DNA binding specificity of TAL-type Ⅲ effectos [J].Science,2009,326:1509-1512. |
| [14] | Li T,Huang S,Jiang W Z,Wright D,Spalding M H,Weeks D P,et al.TAL nucleases (TALNs):hybrid proteins composed of TAL effectors and FokⅠ DNA-cleavage domain [J].Nucleic Acids Res,2011,39:359-372. |
| [15] | Moscou M J,Bogdanove A J.A simple cipher governs DNA recognition by TAL effectors [J].Science,2009,326:1501-1503. |
| [16] | 沈延,肖安,黄鹏,王唯晔,朱作言,张博.类转录激活因子效应物核酸酶 (TALEN) 介导的基因组定点修饰技术[J].遗传,2013,35:395-409. |
| [17] | 施新猷.现代医学实验动物学[M].北京:人民军医出版社,2000:71-82. |
 2014, Vol. 35
2014, Vol. 35


