肝脏损伤会造成大量失血以及炎症因子的大量释放,使机体产生严重的低血压性休克和炎症反应,可能危及伤者的生命。当肝脏损伤发生后,迅速转运以及争分夺秒的抢救就成为重中之重。
低温诱导作为提高创伤患者生存率的治疗方法,已在心血管及神经外科等领域应用[1,2 ,3 ,4]。在肝胆外科领域,由于低温可以降低细胞代谢和氧消耗量,降低缺血再灌注损伤,已成为肝移植手术器官转运的标准保护措施[5],但其对肝脏创伤的效用还没有明确。Gundersen等[6]用失血性休克大鼠模型证明,低温对于包括肝脏在内的器官都具有保护作用。本研究通过建立肝脏外伤出血性休克动物模型,评估胆道灌注低温保护液对肝脏降温的效果,探寻对临床肝脏创伤有保护作用的低温治疗方法。 1 材料和方法 1.1 动物及分组
14只雄性巴马小型猪购自上海甲干动物基地,年龄1~2岁,体质量23~33 kg,随机分为对照组和低温组,每组7只。所有动物购进后,均首先于第二军医大学实验动物中心动物饲养房圈养14 d并检疫,以保证实验动物健康。 1.2 麻醉准备
所有动物均肌注0.1 mL/kg速眠新进行麻醉。麻醉后,将动物仰卧位固定于手术台上。气管插管接21%~25%氧气,并伴以1.5%~2.5%异氟烷持续吸入以维持麻醉状态。潮气量设定在10 mL/kg,使呼气末二氧化碳分压维持在36~42 mmHg(1 mmHg=0.133 kPa)。同时将新生儿血压袖带固定于动物尾巴的根部用以持续监测平均动脉压,将脉搏探头置于动物舌部以检测脉率。由耳缘静脉建立输液通路,以备补液。动物准备完善时的状态记为基础值,即t0。 1.3 制创
行肋缘下斜切口,进腹后首先探查各脏器有无异常,然后将数块先前称量过的无菌纱布置于结肠旁沟和肝左缘,用以将制创流出的血液阻挡于该实验区域内,以便于失血量的计量。将两片手术刀片重合,在肝脏右前叶压出一个横竖均为10 cm的十字形切口,深度约1.5 cm。之后用已称量的无菌纱布持续蘸取创口流出的血液,以记录出血量。将酒精温度计置于肛门持续测量体温,而肝温则用便携性智能电子温度计每隔半小时测量1次。血压、心率则由多功能监护仪持续测量。设定15 min的非控制性出血时间用来模拟现场反应时间(t1),而后开始对动物进行标准的初期紧急救治:用无菌纱布填塞按压创口,同时从耳缘静脉全速输注常温的乳酸林格液来维持血容量。压迫止血1 h(t2), 模拟运送至医院的所需时间。后移除纱布并称量,以测量总的失血量。同时迅速对破损肝脏进行缝扎止血。 1.4 低温灌注
低温组将肝脏创口缝扎止血后,先分离出胆总管,用静脉留置针顺入肝方向穿刺入胆总管作为入肝通路,另一端亦用静脉留置针由胆囊刺入,尾端连输液器接引流袋作为低温液体出肝通路,两端均用无菌缝线固定。此后以4℃乳酸林格液以500 mL/h的速度由入肝通路注入, 为预防严重低温扰乱正常代谢,当测得体温下降到32℃以下时,则停止灌注。耳缘静脉的补液则以维持平均动脉压大于40 mmHg为标准调节滴注速度,防止输注过多,加重心脏负担。对照组仅仅对肝进行标准的缝扎止血手术。两组肝脏缝扎止血后均用5层无菌纱布覆盖,以降低暴露降温的影响。1 h(t3)后记录相关指标。2 h后(t4),低温组拔除灌注装置,并修补穿刺口,防止胆漏,再行关腹;对照组去除覆盖纱布后直接关腹。 1.5 标本获取及检测
分别于t0、t1、t4各时间点由猪前腔静脉采血,检测肝功能;实验结束后,切取各组实验动物右前叶肝组织,置入10%中性甲醛溶液,石蜡包埋后常规H-E染色,光镜观察病理形态。 1.6 统计学处理
采用IBM SPSS Statistics 21.0软件进行统计学分析,计量数据用 x±s表示,组间一般情况和降温差值的比较用两独立样本比较的t检验,血流动力学的比较用单因素方差分析(ANOVA)。检验水准(α)为0.05。 2 结 果 2.1 一般情况
低温组1只动物因麻醉意外死亡(此时未实施任何外科操作)被排除,最后入选实验动物13只,其中对照组7只,低温组6只。两组动物体质量[(29.6±3.0) vs (28.3±3.8) kg]和初期出血量[(456.3±84.9) vs (494.2±111.3) g]差异无统计学意义。 2.2 血流动力学的变化
两组实验动物的心率在制创后均表现为先上升后下降,并趋于稳定;平均动脉压在制创后明显下降。采取不同干预方式后,两组各时间点的心率、平均动脉压差异无统计学意义(表1)。
|
|
表1 两组实验动物血流动力学变化 Table 1 Changes of the hemodynamics of the two groups |
低温组肝温下降值高对照组(P<0.05),而两组体温下降值差异无统计学意义(表2)。
|
|
表2 两组实验动物的体温和肝温变化 Table 2 Changes of body temperature and liver temperature of the two groups |
由于转氨酶指标是呈偏态分布的,所以我们取相应的对数值来对其变化进行统计学处理,两组实验动物的丙氨酸转氨酶(ALT)于术中略微升高,而天冬氨酸转氨酶(AST)则在创伤后急剧升高,对照组和低温组灌注2 h后的log(AST)差异有统计学意义(表3)。
|
|
表3 两组实验动物的肝功能变化 Table 3 Changes of liver function of the two groups |
两组肝脏组织均可见细胞水肿、大量炎性细胞浸润,但低温组细胞水肿及炎性细胞浸润程度明显比对照组低(图1)。
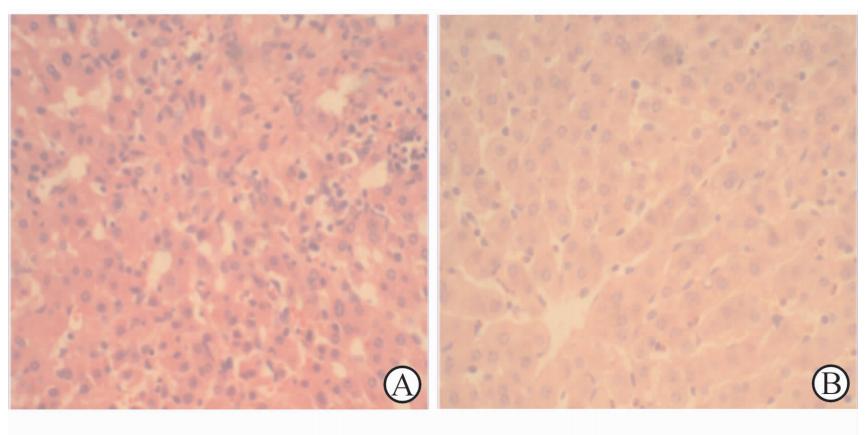 | 图1 低温灌注对创伤肝脏组织学形态的影响 Fig.1 Effects of hypothermia infusion on liver histology A: Control group; B: Hypothermia group. H-E staining. Original magnification: ×400 |
本实验目的是评估胆道灌注4℃的乳酸林格液对于腹部肝创伤失血性休克的救治效果,如果这个方法是可行的,则将对以后的腹部外伤救治大有裨益。我们使用的模型是非常成熟的肝损伤导致失血性休克的模型[7]。Virkkunen 等[8]曾试从肘前静脉以100 mL/min的速度、30 mL/kg的总量向患者灌注低温乳酸林格液,使机体核心温度降低了大约1.8℃。Larsson等[9]则通过外周静脉灌注以及冰袋降温方法使患者降温,将体温控制在32~34℃。
作为腹部创伤最易损伤的器官之一,肝脏内的Kupffer细胞是人体巨噬细胞系统的重要组成部分,肝脏损伤时能引起大量炎性因子的释放,引发局部和全身的炎症反应[7]。所以相对于以往的通过静脉灌注使机体整体降温,我们着眼于损伤肝脏的独立降温,避免对整个机体产生过多副作用。
在我们的实验中,两组动物的体质量、失血量、血流动力学、肝温、体温等方面在干预前均无差异。在低温灌注2 h后低温组肝脏温度与灌注前的肝脏温度差为(2.72±1.01)℃,同一时段对照组肝脏温度差为(1.36±0.80)℃,两组间差异有统计学意义(P<0.05),即由胆道灌注4℃乳酸林格液的方法对肝脏的降温效果是有统计学意义的。灌注后低温组的体温比干预前下降了(0.97±0.97)℃,同一时段对照组体温温度差为(0.89±0.76)℃(P>0.05),说明该方法准确地降低了我们想要诱导低温的器官,局部降温效果显著大于整体。低温组在实验结束时的最终体温为(33.10±2.82)℃,与以往实验的降温情况[8,9]相似。并且两组的平均动脉压、脉率在各个时间点均无明显差异,说明该方法不会对机体产生明显的副作用,安全有效。而且我们还发现,胆道低温灌注疗法使得低温组动物相对对照组肝功能恢复更为迅速,且肝组织炎性细胞浸润程度明显减轻,说明低温对于肝脏有一定的保护作用。
我们曾考虑从门静脉系统灌注低温乳酸林格液,但顾及到门静脉穿刺置管风险大,实际转运中容易发生脱落,可以导致伤病员再次急性失血,乃至死亡。其次,向门静脉内持续输注的低温液体将直接进入体循环,增加了体内液体的负荷,也不利于常规药物的使用。因此,我们从易行性和安全性角度出发,选择了胆道灌注。实验结果表明,胆道灌注可以令肝脏局部温度明显降低,从而为肝功能恢复抑制肝脏炎症因子释放及降低机体整体炎症反应创造了可能。
综上所述,由胆道灌注4℃乳酸林格液的方法,对于肝脏降温是有效的,并且能够促进肝功能恢复,抑制炎症反应,从而对创伤肝脏具有保护作用。这种新的治疗方法具有较好的安全性和易行性,为今后肝创伤的降温治疗提供了一种崭新的思路。但由于胆道灌注方面的文献报道及实验少之又少,这种诱导低温的方法仍可能存在一定的争议。下一步的研究,我们将更深入地探索最佳的灌注速度,监测肝脏降温治疗后各项生化指标及炎性因子表达的变化,并阐明其具体机制。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Arrich J.European Resuscitation Council Hypothermia After Cardiac Arrest Registry Study Group.Clinical application of mild therapeutic hypothermia after cardiac arrest [J].Crit Care Med,2007,35:1041-1047. |
| [2] | Crepeau A Z,Fugate J E,Mandrekar J,White R D,Wijdicks E F,Rabinstein A A,et al.Value analysis of continuous EEG in patients during therapeutic hypothermia after cardiac arrest [J].Resuscitation,2014 Feb 21.[Epub ahead of print] |
| [3] | Drury P P,Bennet L,Gunn A J.Mechanisms of hypothermic neuroprotection [J].Semin Fetal Neonatal Med,2010,15:287-292. |
| [4] | Lee J H,Suh G J,Kwon W Y,Kim K S,Rhee J E,Kim M A,et al.Protective effects of therapeutic hypothermia in post-resuscitation myocardium [J].Resuscitation,2012,83:633-639. |
| [5] | Gurusamy K S,Gonzalez H D,Davidson B R.Current protective strategies in liver surgery [J].World J Gastroenterol,2010,16:6098-6103. |
| [6] | Gundersen Y,Vaagenes P,Pharo A,Valφ E T,Opstad P K.Moderate hypothermia blunts the inflammatory response and reduces organ injury after acute haemorrhage [J].Acta Anaesthesiol Scand,2001,45:994-1001. |
| [7] | Riha G M,Kunio N R,Van P Y,Hamilton G J,Anderson R,Differding J A,et al.Hextend and 7.5% hypertonic saline with Dextran are equivalent to Lactated Ringer's in a swine model of initial resuscitation of uncontrolled hemorrhagic shock[J].J Trauma,2011,71:1755-1760. |
| [8] | Virkkunen I,Yli-Hankala A,Silfvast T.Induction of therapeutic hypothermia after cardiac arrest in prehospital patients using ice-cold Ringer's solution:a pilot study [J].Resuscitation,2004,62:299-302. |
| [9] | Larsson I M,Wallin E,Rubertsson S.Cold saline infusion and ice packs alone are effective in inducing and maintaining therapeutic hypothermia after cardiac arrest [J].Resuscitation,2010,81:15-19. |
 2014, Vol. 35
2014, Vol. 35


