自2000年Gronthos等[1]证实成人的牙髓组织中存在干细胞之后,牙髓干细胞(dental pulp stem cells,DPSCs)就成为了口腔医学研究领域的新热点。Gronthos等[2]还发现DPSCs在体外能形成高密度散在的矿化结节,植入免疫缺陷小鼠皮下能形成与天然牙结构近似的牙髓-牙本质复合体,其中包括牙本质样结构、沿牙本质小管样结构排列的成牙本质样细胞以及血管、神经和结缔组织,从而证实DPSCs具有自我更新的能力。研究者还借鉴骨髓基质细胞(bone marrow stromal cells,BMSCs)的研究方法,对DPSCs和BMSCs体外增殖情况进行对比,发现DPSCs平均约有72% 5-溴脱氧尿嘧啶核苷(BrdU)阳性细胞,而BMSCs约有46% BrdU阳性细胞,表明在体外培养中DPSCs的增殖率比BMSCs高,研究还发现DPSCs在以后的传代中依然保持着较高的增殖能力[3]。DPSCs具有横向分化的潜能,在不同的微环境作用下可分化为多种细胞,如成牙本质细胞、肌细胞、脂肪细胞和骨细胞等。
肾上腺髓质素(adrenomedullin,ADM )是一种多能性肽,最初从人脑细胞中分离获得[4],具有扩张血管、促细胞生长、调节激素分泌、排钠利尿、抗菌等功能[5]。ADM被认为在哺乳动物的发育中发挥了重要的作用[6]。有研究发现,在牙齿组织发育过程的关键发育时间点呈现ADM的高表达[7]。ADM的作用被认为是调节胚胎发育,控制细胞增殖、分化和迁移,并推测可能在成体中起到调节内环境平衡的作用[8]。尤其引起我们重视的是,ADM对成骨现象存在明显的调控作用[9],虽然骨发生和牙本质发生各自由成骨细胞与成牙本质细胞通过不同的分子机制调控,但两者的基因表达模式却具有一定的相似性,具有共同的标记物,如: 骨唾液酸蛋白(bone sialoprotein,BSP)、骨钙素(osteocalcin,OCN)、碱性磷酸酶(alkaline phosphatase,ALP)。
ADM的这些特性似乎适用于牙髓损伤的治疗,然而 ADM对DPSCs的生物学效应尚未明确。本研究通过滴注不同浓度ADM,观察ADM对DPSCs的增殖、凋亡、分化的影响,评估ADM在牙髓再生中可能发挥的生物学效应,以期为ADM在体内牙髓再生研究及其临床应用提供实验依据。 1 材料和方法 1.1 主要材料
人原代牙周膜细胞由第三军医大学新桥医院口腔科谭颖徽教授惠赠; ADM、牛血清白蛋白(BSA)购自Sigma公司; DMEM细胞培养基及胎牛血清(FBS)购自Gibco公司; TRIzol购自Invitrogen公司; RNA反转录及定量PCR试剂盒购自TaKaRa公司; 细胞周期检测试剂盒(PI/RNaseA)购自Roche公司; ALP引物序列由上海生工生物工程技术服务有限公司设计合成,ALP正义链: 5′-CAG TTC TGG AGG ATG GC-3′,反义链: 5′-TCT CAC AGC CTT GCG TGT TC-3′; 细胞凋亡检测试剂盒 (Annexin Ⅴ-FITC/PI)、细胞总蛋白抽提裂解液及BCA蛋白浓度测定试剂盒购自江苏碧云天生物技术研究所。小鼠抗人ALP及抗人β-actin单克隆抗体、HRP标记山羊抗小鼠二抗购自Santa Cruz公司。 1.2 DPSCs培养及分组
人原代DPSCs,在DMEM(含20% FBS)、5% CO2、37℃条件下培养。传代培养至第3代,分别在培养液中添加ADM至终浓度分别为10-6、10-7及10-8 mol/L(ADM干预组),培养24 h后收集细胞。另设未经处理的DPSCs作为空白对照组。 1.3 流式细胞术检测DPSCs细胞周期
将各组DPSCs细胞重悬于500 μL Buffer A (100 mmol/L 磷酸缓冲液,0.5% BSA)。Buffer A洗涤2次, 加入PI (25 μg/mL)+RNaseA (50 μg/mL) 300 μL,吹匀重悬,4℃避光处理30 min,上流式细胞仪检测细胞周期。 1.4 流式细胞术检测DPSCs细胞凋亡
将各组DPSCs细胞用100 μL的标记溶液(含1 μg/L Annexin Ⅴ-FITC和1 μg/L PI)重悬细胞,室温下避光孵育10~15 min。500×g离心5 min,沉淀细胞,孵育缓冲液洗1次,上流式细胞仪检测各组细胞凋亡情况。Annexin Ⅴ+/PI-判定为凋亡细胞。 1.5 实时定量PCR法检测ALP mRNA表达
TRIzol裂解细胞抽提总RNA。取500 ng 总RNA以反转录试剂盒行反转录。SYBR法定量检测DPSCs细胞内ALP mRNA的表达水平。定量PCR反应体系: SYBR Premix 10 μL,10 μmol/L正反向引物各0.4 μL,反转录产物1 μL,补充去离子水至反应体系20 μL。反应条件: 95℃变性60 s; 95℃ 5 s,60℃ 20 s,共40循环。以18S rRNA表达水平作为内参,通过ΔΔCt法比较经不同浓度ADM处理的细胞间ALP mRNA的相对表达水平。 1.6 蛋白印迹分析检测ALP 蛋白表达
收集各组DPSCs,加入细胞总蛋白抽提裂解液提取细胞总蛋白,采用BCA法检测总蛋白浓度。各取20 μg总蛋白进行12% SDS聚丙烯酰胺凝胶垂直电泳。运用半干法将凝胶中蛋白转印至PVDF膜上。再以5%的脱脂牛奶常温封闭2 h,加入TBST稀释小鼠抗人ALP(或β-actin)单克隆抗体,4℃过夜。取出后TBST洗膜3次。再加入HRP标记山羊抗小鼠二抗,室温孵育2 h,TBST洗膜3次,增强型化学发光显影。采用LabWork 4.0图像分析软件进行条带光密度扫描分析ALP的表达丰度。 1.7 统计学处理
应用SPSS 15.0软件分析,数据用x±s表示,不同处理样本均数比较采用方差分析(ANOVA)。检验水准(α)为0.05。 2 结 果 2.1 ADM对DPSCs增殖的影响
经不同浓度ADM处理24 h后,DPSCs细胞周期检测结果显示10-6、10-7及10-8mol/L ADM干预组处理G2/S/M期的细胞比例分别为(39.20±2.75)%、(35.04±1.77)%、(36.08±1.03)%,均高于空白对照组 [(30.28±0.84)%],差异有统计学意义(P<0.05),但不同浓度ADM干预组间G2/S/M期的细胞比例差异无统计学意义(图1)。
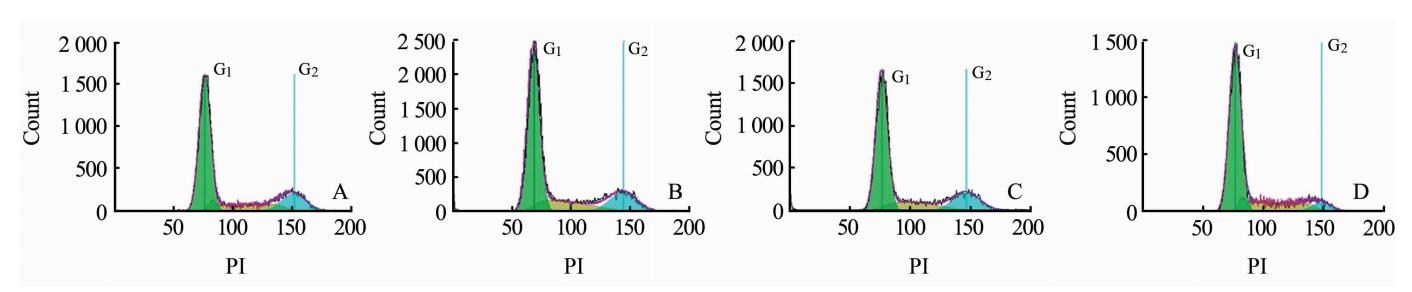 | 图1 ADM干预后DPSCs细胞周期检测结果Fig.1 Cell cycle distribution of dental pulp stem cells (DPSCs) after adrenomedullin (ADM) intervention A: 10-6mol/L ADM intervention group; B: 10-7mol/L ADM intervention group; C: 10-8mol/L ADM intervention group; D: Control group |
DPSCs经不同浓度ADM处理24 h后,细胞凋亡检测结果显示10-6、10-7及10-8mol/L ADM干预组Annexin Ⅴ+/PI-细胞比例分别为(9.29±0.72)%、(10.27±0.74)%及(10.48±0.61)%,均低于空白对照组[(14.58±0.77)%],差异有统计学意义(P<0.05),但不同浓度ADM干预组间Annexin Ⅴ+/PI-细胞比例差异无统计学意义(图2)。
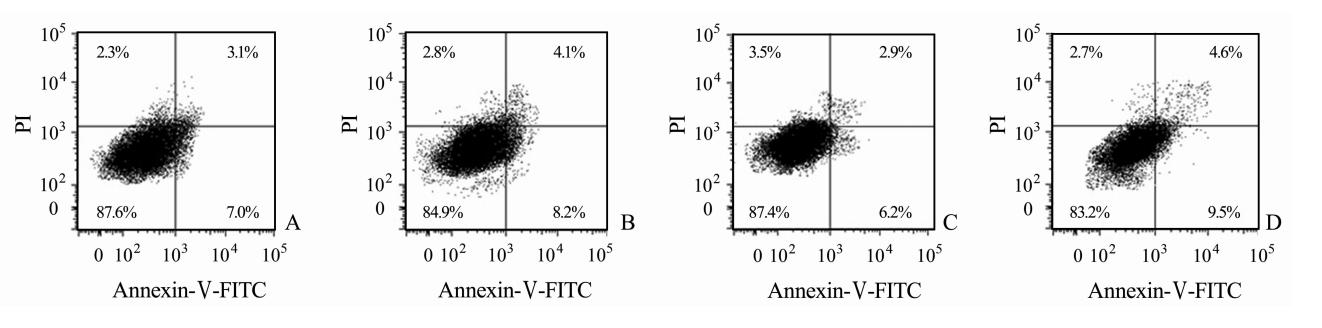 | 图2 ADM干预后DPSCs细胞凋亡检测结果 Fig.2 Apoptosis of dental pulp stem cells (DPSCs) after adrenomedullin (ADM) intervention A: 10-6mol/L ADM intervention group; B: 10-7mol/L ADM intervention group; C: 10-8mol/L ADM intervention group; D: Control group |
DPSCs经不同浓度ADM处理24 h后,通过实时定量PCR检测各组ALP mRNA相对18S rRNA的表达水平。结果显示,经10-6、10-7、10-8mol/L ADM干预后ALP mRNA相对表达水平分别为 3.27±0.31、3.04±0.27、2.93±0.20,均高于空白对照组(0.96±0.07),差异有统计学意义(P<0.01,图3)。蛋白质印迹分析检测各组ADM蛋白相对β-actin的表达水平,结果显示10-6、10-7、10-8mol/L ADM干预后ALP蛋白相对表达水平分别为 2.46±3.78、2.25±2.75、2.38±2.98,均高于空白对照组(1.05±0.13),差异有统计学意义(P<0.01,图4)。但不同浓度ADM干预组间ALP mRNA及蛋白表达水平差异均无统计学意义。
 | 图3 ADM干预后DPSCs中ALP mRNA表达 Fig.3 Expression of alkaline phosphatase (ALP) mRNA in dental pulp stem cells (DPSCs) after adrenomedullin (ADM) intervention |
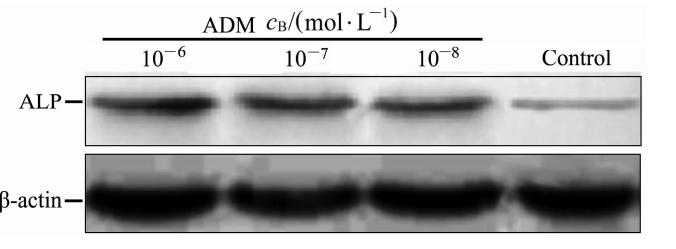 | 图4 ADM干预后DPSCs中ALP蛋白的表达 Fig.4 Expression of alkaline phosphatase (ALP) protein in dental pulp stem cells (DPSCs) after adrenomedullin (ADM) intervention |
最初,ADM被认为是一个重要的肿瘤生长因子[10]。而现有研究表明,ADM可以促进多个细胞的增殖,如成纤维细胞、角质形成细胞、内皮细胞、成骨细胞及肿瘤来源的细胞等,其机制研究发现,ADM量的增加与cAMP信号成正相关[11],ADM也可以刺激人角质形成细胞的DNA和cAMP的合成[12]。推测ADM对于细胞的促进增殖作用可能是通过cAMP介导的。然而,在对某些特定细胞(如血管平滑肌细胞、肾小球系膜细胞、神经胶质细胞和神经胶质肿瘤细胞)的观察中发现,ADM对这些细胞的增殖和生长有抑制作用[13]。因此,我们推测ADM作为一种生长因子,其对生长的调节作用可能和细胞的种类相关。本研究通过在DPSCs培养液中滴注不同浓度的ADM作为干预与空白对照组相比较,细胞流式术检测DPSCs细胞周期,结果证实ADM对DPSCs具有明显的促增殖作用,而ADM的浓度对促增殖效应的影响不明显。
ADM还被认为是一个对胚胎发育和分化的重要因子,也是一个细胞凋亡存活因子[7, 14]。研究表明,ADM可以增加早期内皮祖细胞增殖,并抑制其凋亡[15]。骨髓间充质干细胞(MSCs)能够分泌大量的血管生成因子和抗凋亡因子,其中就包括有ADM[16]。有研究发现ADM可促进 MSCs存活,有利于心脏修复[17]。本实验通过流式AnnexinⅤ/PI法检测凋亡细胞率,发现ADM干预后细胞的凋亡率低于空白对照细胞,而不同浓度ADM干预组间的细胞凋亡率差异无统计学意义,证实ADM对DPSCs 的凋亡具有抑制作用。
ADM对不同的干细胞具有不同的影响作用。ADM被认为与多种类型干细胞/祖细胞存在联系。ADM及其受体的协调增加表达量可以通过提高透明小球干细胞的增殖来改善自分泌/旁分泌的方式,促进肾上腺皮质再生[18]。神经干细胞(neural stem cell,NSCs)位于嗅球,被称为嗅球干细胞(OBSCs),保留干细胞的性质,缺乏ADM可以严重改变OBSCs后代细胞的增殖和分化[19]。研究表明,ADM对成人NSCs或成体神经祖细胞的分化和增殖具有促进作用[20]。本实验通过观察经ADM处理DPSCs干预组相比空白对照组的ALP mRNA和蛋白表达水平,证实了ADM对DPSCs的成牙本质分化同样具有促进作用。
研究推测ADM可以通过调控干细胞分化来重建神经,并预测ADM运用于再生医学领域内可能具有良好的前景[20]。更有学者认为,ADM作为一种不同来源的干细胞生长因子,具有被添加到任何干细胞治疗中应用的潜力; 不仅如此,ADM还可以决定一些祖细胞的未来分化结果 [21]。ADM可以作用于特定干细胞使其分化成为特定的后代细胞,但是在这过程中同样存在很多的小分子物质,它们可以抵消或增加ADM的活性[22,23]。本实验初步证实了ADM对DPSC 的促增殖、抗凋亡、促成牙本质/成骨分化的能力,但是其具体作用机制尚未明确,还需进一步研究。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Gronthos S,Mankani M,Brahim J,Robey P G,Shi S.Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo[J].Proc Natl Acad Sci USA,2000,97:13625-13630. |
| [2] | Gronthos S,Brahim J,Li W,Fisher L W,Cherman N,Boyde A,et al.Stem cell properties of human dental pulp stem cells[J].J Dent Res,2002,81:531-535. |
| [3] | Karamzadeh R,Eslaminejad M B,Aflatoonian R.Isolation,characterization and comparative differentiation of human dental pulp stem cells derived from permanent teeth by using two different methods[J].J Vis Exp,2012(69).pii: 4372.doi: 10.3791/4372. |
| [4] | Kitamura K,Kangawa K,Kawamoto M,Ichiki Y,Nakamura S,Matsuo H,et al.Adrenomedullin: a novel hypotensive peptide isolated from human pheochromocytoma [J].Biochem Biophys Res Commun,1993,192:553-560. |
| [5] | López J,Martínez A.Cell and molecular biology of the multifunctional peptide,adrenomedullin[J].Int Rev Cytol,2002,221:1-92. |
| [6] | Garayoa M,Martínez A,Lee S,Pío R,An W G,Neckers L,et al.Hypoxia-inducible factor-1 (HIF-1) up-regulates adren omedullin expression in human tumor cell lines during oxygen deprivation: a possible promotion mechanism of carcinogenesis[J].Mol Endocrinol,2000,14:848-862. |
| [7] | Montuenga L M,Martínez A,Miller M J,Unsworth E J,Cuttitta F.Expression of adrenomedullin and its receptor during embryogenesis suggests autocrine or paracrine modes of action[J].Endocrinology,1997,138:440-451. |
| [8] | 夏蕾,沈朋.四物合剂对人红白血病细胞株K562/ADM多药耐药性的逆转作用研究[J].中国中药杂志,2004,29:792-795. |
| [9] | Kim S H,Kim Y S,Lee S Y,Kim K H,Lee Y M,Kim W K,et al.Gene expression profile in mesenchymal stem cells derived from dental tissues and bone marrow[J].J Periodontal Implant Sci,2011,41:192-200. |
| [10] | Miller M J,Martínez A,Unsworth E J,Thiele C J,Moody T W,Elsasser T,et al.Adrenomedullin expression in human tumor cell lines.Its potential role as an autocrine growth factor[J].J Biol Chem,1996,271:23345-23351. |
| [11] | Withers D J,Coppock H A,Seufferlein T,Smith D M,Bloom S R,Rozengurt E.Adrenomedullin stimulates DNA synthesis and cell proliferation via elevation of cAMP in Swiss 3T3 cells[J].FEBS Lett,1996,378:83-87. |
| [12] | Kapas S,Brown D W,Farthing P M,Hagi-Pavli E.Adrenomedullin has mitogenic effects on human oral keratinocytes: involvement of cyclic AMP[J].FEBS Lett,1997,418:287-290. |
| [13] | Hinson J P,Kapas S,Smith D M.Adrenomedullin,a multifunctional regulatory peptide[J].Endocr Rev,2000,21:138-167. |
| [14] | Demir H,Onur O E,Denizbasi A,Akoglu H,Eroglu S E,Ozpolat C,et al.The effects of adrenomedullin in traumatic brain injury[J].Peptides,2013,43:27-31. |
| [15] | Iwase T,Nagaya N,Fujii T,Itoh T,Ishibashi-Ueda H,Yamagishi M,et al.Adrenomedullin enhances angiogenic potency of bone marrow transplantation in a rat model of hindlimb ischemia[J].Circulation,2005,111:356-362. |
| [16] | Nagaya N,Mori H,Murakami S,Kangawa K,Kitamura S.Adrenomedullin: angiogenesis and gene therapy[J].Am J Physiol Regul Integr Comp Physiol,2005,288:R1432-R1437. |
| [17] | Fujii T,Nagaya N,Iwase T,Murakami S,Miyahara Y,Nishigami K,et al.Adrenomedullin enhances therapeutic potency of bone marrow transplantation for myocardial infarction in rats[J].Am J Physiol Heart Circ Physiol,2005,288:H1444-H1450. |
| [18] | Rebuffat P,Macchi C,Malendowicz L K,Nussdorfer G G.Up-regulation of adrenomedullin receptor gene expression in activated local stem cells during rat adrenal regeneration[J].Int J Mol Med,2007,20:855-858. |
| [19] | Vergaño-Vera E,Fernndez A P,Hurtado-Chong A,Vicario-Abejón C,Martínez A.Lack of adrenomedullin affects growth and differentiation of adult neural stem/progenitor cells[J].Cell Tissue Res,2010,340:1-11. |
| [20] | Wang L,Zheng L,Li C,Dong S,Lan A,Zhou Y.Adrenomedullin delivery in microsphere-scaffold composite for remodeling of the alveolar bone following tooth extraction: an experimental study in the rat[J].Biomed Eng Online,2013,12:99. |
| [21] | Martínez A,Julin M,Bregonzio C,Notari L,Moody T W,Cuttitta F.Identification of vasoactive nonpeptidic positive and negative modulators of adrenomedullin using a neutralizing antibody-based screening strategy[J].Endocrinology,2004,145:3858-3865. |
| [22] | Martínez A,Oh H R,Unsworth E J,Bregonzio C,Saavedra J M,Stetler-Stevenson W G,et al.Matrix metalloproteinase-2 cleavage of adrenomedullin produces a vasoconstrictor out of a vasodilator[J].Biochem J,2004,383(Pt 3):413-418. |
| [23] | Martínez A,Zudaire E,Portal-Núñez S,Guédez L,Libutti S K,Stetler-Stevenson W G,et al.Proadrenomedullin NH2-terminal 20 peptide is a potent angiogenic factor,and its inhibition results in reduction of tumor growth[J].Cancer Res,2004,64:6489-6494. |
 2014, Vol. 35
2014, Vol. 35


