缺氧是糖尿病视网膜病变(diabetic retinopathy, DR)病理改变的重要环节之一[1],由于视网膜神经元正常代谢需消耗大量的氧,缺氧将导致神经元损伤甚至死亡。视锥细胞作为视觉传导通路的一级神经元,负责昼光觉和色觉,受损后将严重影响视功能,故探索视锥细胞的“保护伞”对应用于保存
DR患者的视功能具有重要意义。DR的发生发展始终伴随着血管内皮生长因子(vascular endothelial growth factor, VEGF)的高表达[2]。VEGF的生物学作用除刺激新生血管形成、参与肿瘤发生及转移外,还可以保护运动神经元[3],但其在视网膜光感受器类感觉神经元中的作用鲜有报道。VEGF必须通过与VEGF受体(vascular endothelial growth factor receptor,VEGFR)结合才能发挥效应。VEGFR主要包括VEGFR1和VEGFR2,研究发现抑制VEGFR2可阻断VEGF信号通路,而抑制VEGFR1则影响甚微[4]。基于以上背景,本研究选择VEGFR2作为研究靶点,利用经典氯化钴(CoCl2)玻璃体腔注射法建立缺氧模型,观察并比较视锥细胞特异性敲除VEGFR2(cone-specific VEGFR2 knockout)小鼠和野生型小鼠视锥细胞结构及功能的变化,探讨VEGFR2在缺氧条件下对视锥细胞的作用。
1 材料和方法1.1 主要试剂及仪器
CoCl2购自美国Sigma公司,花生凝集素(peanut agglutinin,PNA)、羊抗兔荧光二抗、4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)购自美国Vector公司,兔抗小鼠VEGFR2一抗购自美国R/D公司,PBS缓冲液、山羊血清等购自北京天根生化科技有限公司。微量注射器购自美国Hamilton公司,Espion视网膜电图(electroretinogram, ERG)仪购自美国Diagnosys公司,倒置荧光显微镜购自日本Olympus公司,玻璃酸钠凝胶购自山东博士伦福瑞达公司。
1.2 实验动物分组选用清洁级的8周龄、体质量20~30 g的健康无眼疾近交系视细胞特异性敲除VEGFR2小鼠,简称KO小鼠(美国俄克拉荷马大学健康科学中心乐韵政教授惠赠)和野生型小鼠,简称WT小鼠(南昌大学动物科学部提供)各6只。 在经南昌大学第二附属医院医学研究伦理审查委员会批准后进行动物实验,WT小鼠均采取右眼注射8 mmol/L CoCl2视为野生型缺氧组(CoCl2-WT);左眼注射磷酸盐缓冲液(PBS)视为野生型自身对照组(PBS-WT),KO小鼠均采取右眼注射8 mmol/L CoCl2视为基因敲除缺氧组(CoCl2-KO),左眼注射PBS视为基因敲除自身对照组(PBS-WT)。
1.3 缺氧模型的建立小鼠予以腹腔麻醉后,眼部周围用碘伏消毒,然后在显微镜下使用Hamilton 微量注射器于角膜缘外1 mm 向视神经方向进针,于瞳孔区见针尖后缓慢推药。右眼玻璃体腔内注入8 mmol/L CoCl2 1 μL,左眼玻璃体腔内注入PBS 1 μL。
1.4 ERG检测光感受器细胞功能
使用复方托比卡胺滴眼液(日本参天制药公司)将小鼠散瞳后放于暗室过夜,第2天予以腹腔麻醉。再将小鼠置于加热温板上,参比电极和接地电极插入腭部和尾巴,铂制角膜电极置于双眼角膜上并予以玻璃酸钠凝胶润滑,以上操作均在暗室弱红光灯照明下完成。ERG仪设置0.000 4、 0.04、 4、 400及2 000 (cd·s)/m2光照强度以记录暗适应ERG以反映视杆细胞功能,然后开灯明适应10 min后在2 000 (cd·s)/m2光照强度下记录明适应ERG以反映视锥细胞功能。
1.5 免疫荧光共定位法观察VEGFR2表达及视锥细胞形态由于视锥细胞在小鼠视网膜光感受器中仅约占3%,采用蛋白质印迹法无法得到准确结果,故本研究以PNA为视锥细胞标记物,采用同时标记视锥细胞和VEGFR2以检测视锥细胞中VEGFR2的表达,同时标记视锥细胞和DAPI染色标记细胞核以观察视锥细胞形态。步骤如下:将完成ERG的小鼠处死后取出眼球,放入4%多聚甲醛固定1 h,剪除角膜和晶体,再放入4%多聚甲醛中固定15 min,PBS清洗后乙醇梯度脱水,放入二甲苯Ⅰ及二甲苯Ⅱ中透明,浸蜡后包埋,切片(5 μm)后烤干。 石蜡切片置入二甲苯Ⅰ及二甲苯Ⅱ中脱蜡,无水乙醇漂洗后置入梯度乙醇,在98℃ 0.01 mol/L柠檬酸盐缓冲液中抗原热修复处理20 min,自然冷却后漂洗3次。滴加山羊血清后湿盒温育1 h, 4℃过夜孵育一抗,阴性对照组使用PBS代替一抗,次日洗涤3次后室温孵育二抗1 h,加入含抗淬灭剂的DAPI封片,使用荧光显微镜观察并计数视锥细胞内节阳性细胞数量。
1.6 统计学处理采用SPSS 17.0统计学软件进行统计学分析,结果以x±s表示,组间多重比较采用Dunnett t检验。检验水准(α)为0.05。
2 结 果 2.1 正常条件下VEGFR2在KO小鼠和WT小鼠视网膜中的表达VEGFR2大量表达于WT小鼠视锥细胞的内节(图 1A),而KO小鼠视锥细胞内节仅见少量VEGFR2表达(图 1B);KO小鼠视锥细胞表达VEGFR2约为WT小鼠的15.3%,差异有统计学意义(P=0.002 1,图 1C)。
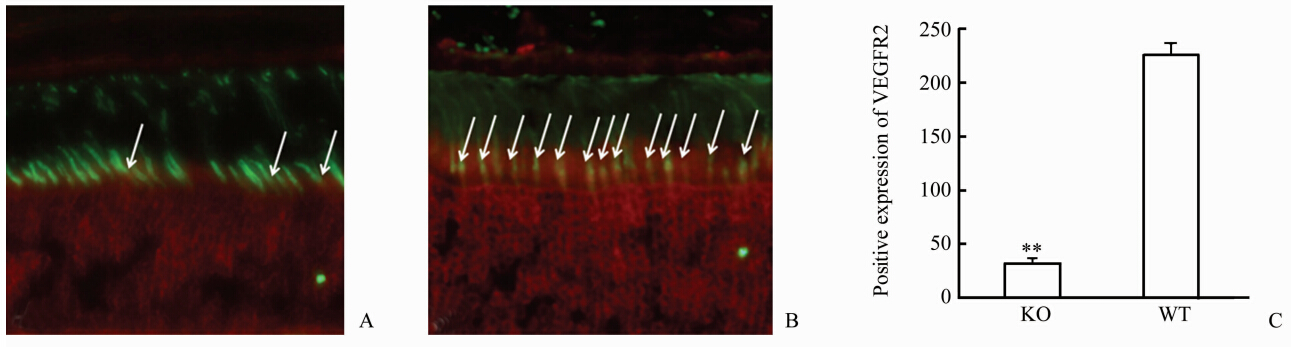 | 图 1 正常条件下VEGFR2在KO小鼠和WT小鼠视网膜中的表达 Fig 1 Retinal VEGFR2 expression in KO and WT mice under normal condition A,B: Immmuno-colocalization image of cone-specific VEGFR2 knockout (KO) mice and wildtype (WT) mice. The white arrows signified the expression of VEGFR2 in cone inner segment. Green: Peanut agglutinin (PNA); Red: Vascular endothelial growth factor receptor 2 (VEGFR2). Original magnification: ×400. C: VEGFR 2 expression. **P<0.01 vs WT. n=6, ±s |
KO小鼠和WT小鼠缺氧侧眼的的暗适应ERG的a波及b波振幅与各自的PBS对照侧眼球相比均明显下降(P<0.01),但KO小鼠和WT小鼠之间比较差异无统计学意义(P>0.05,图2);KO小鼠和WT小鼠缺氧侧眼的明适应ERG a波及b波振幅均较PBS对照侧眼球明显下降P<0.01),且KO小鼠与WT小鼠相比下降更明显,差异有统计学意义(P<0.05, P<0.01,图 3)。
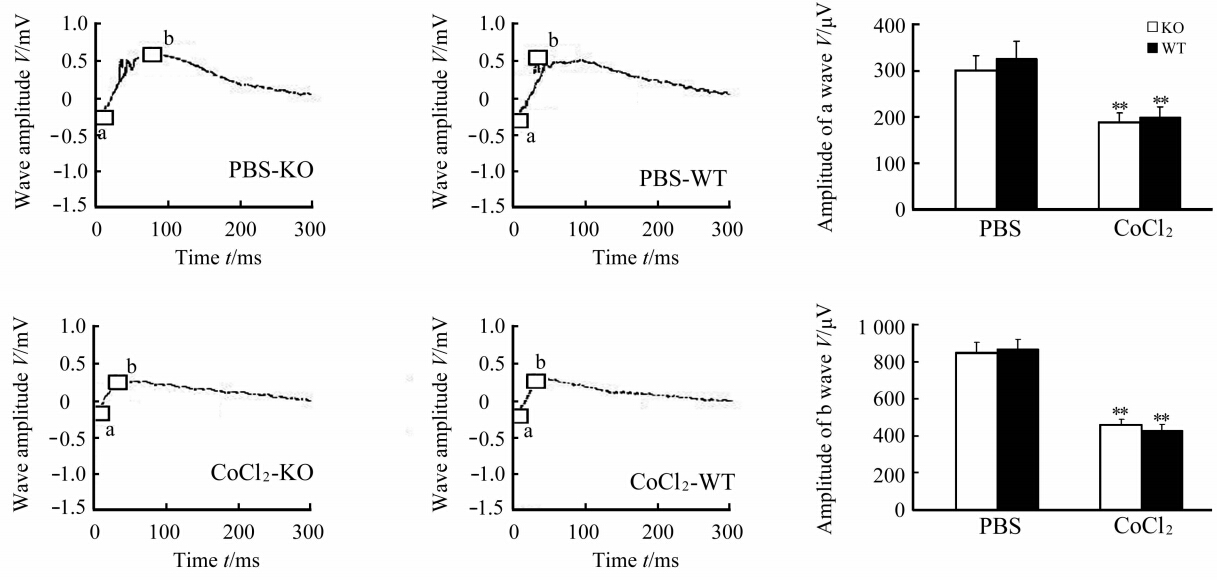 | 图2 KO小鼠和WT小鼠在正常及缺氧条件下暗适应视网膜电图 Fig 2 Scotopic electroretinogram findings of cone-specific VEGFR2 knockout (KO) mice and wildtype (WT) mice under normal and hypoxia conditions**P<0.01 vs PBS. n=6, ±s |
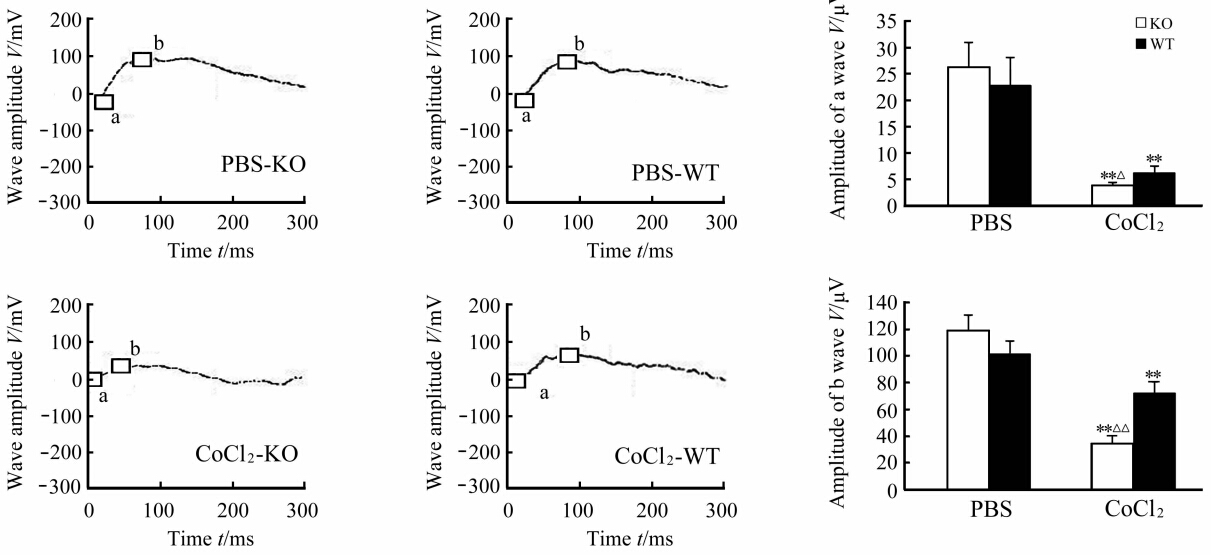 | 图3 KO小鼠和WT小鼠在正常及缺氧条件下明适应视网膜电图Fig 3 Photopic electroretinogram findings of cone-specific VEGFR2 knockout (KO) mice and wildtype (WT) mice under normal and hypoxia conditions **P<0.01 vs PBS; △P<0.05, △△P<0.01 vs WT. n=6, ±s |
KO小鼠和WT小鼠缺氧侧眼的的视锥细胞均发生了变化,与其各自的PBS对照侧相比其视锥细胞外节密度下降,形态也较为短小,排列疏松、紊乱,且KO小鼠的这种改变较WT小鼠更为显著(图4)。
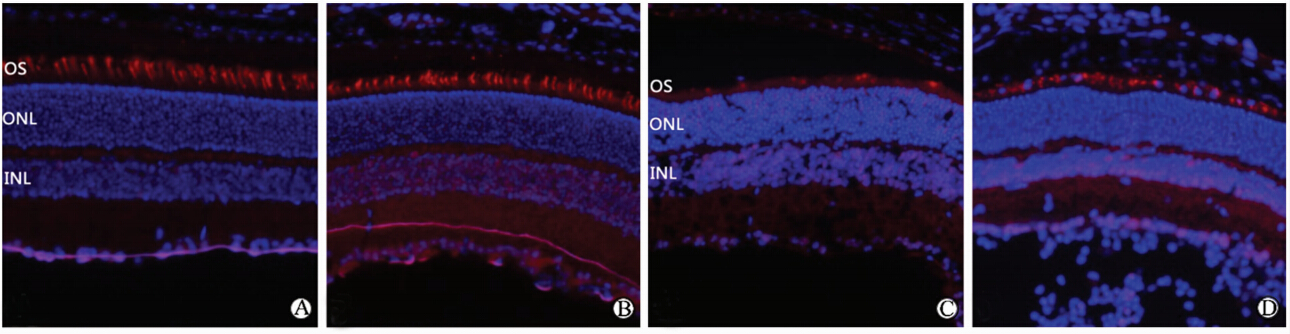 | 图4 KO小鼠和WT小鼠在正常及缺氧条件下视锥细胞的形态学改变 Fig 4 Cone photoreceptor morphology changes in cone-specific VEGFR2 knockout (KO) mice and wildtype (WT) mice under normal and hypoxia conditions A: PBS-KO; B: PBS-WT; C: CoCl2-KO; D: CoCl2-WT. OS: Outer segment; ONL: Outer nuclear layer; INL: Inner nuclear layer. Red: Peanut agglutinin (PNA); Blue: 4’,6-diamidino-2-phenylindole (DAPI). Immmuno-colocalization. Original magnification: ×400 |
DR是主要的致盲性眼病之一,研究发现DR患者血液循环阻力增高、血流速度下降、灌注不良导致视网膜组织缺血缺氧,进而造成视网膜神经元等的损伤[5]。因此探讨缺氧条件下视网膜组织的病理改变有助于研究DR的发病机制。最常用于模拟低氧环境的化学药物是CoCl2,其原理在于阻止细胞内的呼吸链传递,造成细胞的化学缺氧[6, 7]。玻璃体腔内注射CoCl2是其衍生而来新兴的模拟视网膜组织缺氧的体内试验研究方法,较链脲佐菌素腹腔注射建立糖尿病模型周期短,操作更便捷。国外学者曾在大鼠玻璃体腔中使用注射不同浓度的CoCl2去探讨其诱导缺氧的最佳浓度,结果发现3 mmol/L效果最好[7],而本研究发现在小鼠中8 mmol/L浓度诱导急性缺氧环境效果最佳,由于我们实验目的在于观察视锥细胞在缺氧条件下的损伤,且CoCl2模拟的视网膜缺氧环境最早发生结构破坏的即为光感受器层,故采取隔日实验的方法。
VEGF在糖尿病微血管病变中起着重要作用[8],抑制VEGF活性如玻璃体腔注射VEGF抗体在临床中也取得了一定的疗效[9]。但近年来DR病程中神经退行性变逐渐得到重视,DR的治疗不应仅针对微血管病变,神经保护治疗同样重要[10]。由于VEGF还具有神经保护作用,因此VECFR可能会降低这种保护作用而损伤神经视网膜,深入研究VEGF的神经保护作用可能为将来开发新的DR药物提供实验依据。如前所述,由于VEGF需与VEGFR结合才激活,VEGFR可成为研究的靶点之一。VEGFR2是VEGF受体家族的重要一员,López-Aguilera等[11]发现在高浓度氮气模拟缺氧环境下新生的大鼠中,VEGFR2可通过与血管紧张素受体2相互作用而对新生脑细胞产生保护效应。然而目前国内外对VEGFR2在视网膜光感受器中的作用方面报道较少,本实验运用KO小鼠,观察在缺氧条件下VEGFR2对视网膜光感受器的视锥细胞是否同样具有保护作用。
ERG是一种记录视网膜受到闪光刺激后产生的电位的技术,由于该电位可以从角膜表面被无创记录下,故常用于研究视网膜功能[12],ERG包括暗适应弱光刺激时的反应(来源于视杆细胞)和明适应白色标准闪光刺激时的反应(来源于视锥细胞),我们观察到正常条件下KO小鼠的ERG并无明显改变,说明敲除VEGFR2在正常条件下并未对视锥细胞功能产生影响。但在注射CoCl2后与WT小鼠相比,暗适应ERG波幅下降幅度无明显差异,但明适应ERG较WT小鼠下降明显,表明其视锥细胞功能明显降低。在完成功能评估后,我们采用视锥细胞标记物—PNA行免疫荧光共定位观察其结构的改变,结果发现CoCl2注射后的缺氧环境下视网膜视锥细胞均发生了显著的变化,其外节密度下降,形态也较为短小,排列疏松、紊乱,且KO小鼠的改变更为明显。
综上所述,我们的研究结果表明在CoCl2诱导的急性缺氧环境下,KO小鼠其视锥细胞损伤较WT小鼠更为严重,而VEGFR2的缺失正是造成视锥细胞功能及解剖结构均下降的原因。该结果提示在缺氧应激条件下VEGFR2对视锥细胞中起着保护作用,但其背后的机制有待进一步研究。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | 李筱荣,黎晓新,惠延年.糖尿病眼病[M].北京:人民卫生出版社,2010:131-212. |
| [2] | Gupta N,Mansoor S,Sharma A,Sapkal A,Sheth J,Falatoonzadeh P,et al.Diabetic retinopathy and VEGF[J].Open Ophthalmol J,2013,7:4-10. |
| [3] | Li X.VEGF-B:a thing of beauty[J].Cell Res,2010,20:741-744. |
| [4] | Ferrara N,Gerber H P,LeCouter J.The biology of VEGF and its receptors[J].Nat Med,2003,9:669-676. |
| [5] | Arden G B,Sivaprasad S.Hypoxia and oxidative stress in the causation of diabetic retinopathy[J].Curr Diabetes Rev,2011,7:291-304. |
| [6] | 王国红,毕凌云,李超堃,侯软玲,尹雅玲,李东亮.氯化钴诱导化学缺氧对N9小胶质细胞的损伤作用及机制[J].中国药理学通报,2013,29:557-562. |
| [7] | Hara A,Niwa M,Aoki H,Kumada M,Kunisada T,Oyama T,et al.A new model of retinal photoreceptor cell degeneration induced by a chemical hypoxia-mimicking agent,cobalt chloride[J].Brain Res,2006,1109:192-200. |
| [8] | Giuliari G P.Diabetic retinopathy:current and new treatment options[J].Curr Diabetes Rev,2012,8:32-41. |
| [9] | Ip M S,Domalpally A,Hopkins J J,Wong P,Ehrlich J S.Long-term effects of ranibizumab on diabetic retinopathy severity and progression[J].Arch Ophthalmol,2012,130:1145-1152. |
| [10] | Villarroel M,Ciudin A,Hernández C,Simó R.Neurodegeneration:An early event of diabetic retinopathy[J].World J Diabetes,2010,1:57-64. |
| [11] | López-Aguilera F,Plateo-Pignatari M G,Biaggio V,Ayala C,Seltzer A M.Hypoxic preconditioning induces an AT2-R/VEGFR-2 (Flk-1) interaction in the neonatal brain microvasculature for neuroprotection [J].Neuroscience,2012,216:1-9. |
| [12] | Stophen J.Ryan.视网膜[M].4版.黎晓新,赵家良主译.天津:天津科技翻译出版公司,2011:105-137. |
 2014, Vol. 35
2014, Vol. 35

