2. 第二军医大学长海医院病理科, 上海 200433;
3. 第二军医大学基础部医学实验教学中心, 上海 200433
2. Department of Pathology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China;
3. Center of Medical Experiment Teaching, College of Basic Medical Sciences, Second Military Medical University, Shanghai 200433, China
子宫内膜异位症(endometriosis,EMS)是妇科常见良性疾病之一,以进行性加重的痛经、盆腔疼痛、月经失调及不孕等为主要特征,在女性人群中的发病率为10%左右,在疼痛和(或)不孕妇女中发生率达 35%~50%[ 1,2 ]。EMS虽然是一种良性疾病,但却有增生、侵袭、复发等类似肿瘤的恶性行为,且EMS患者较一般人群有更高的卵巢癌、乳腺癌等肿瘤发病风险[ 2,3 ],严重影响女性的生存质量。EMS发病机制尚未完全明确,经典的Sampson学说(经血逆流种植)仍占主导,而免疫系统功能尤其如免疫细胞(T、B淋巴细胞)、自然杀伤细胞以及转录因子NF-κB等所起的作用近年来也日益受到关注[ 4,5,6,7 ]。
P2X7受体是配体门控的离子通道受体,属于嘌呤类受体的一种亚型,即细胞外腺苷酸激活的P2受体,其生物学功能包括参与细胞信号转导、细胞因子的分泌,介导细胞的存活与生长等[ 8,9 ]。近年来研究表明P2X7受体参与乳腺癌、肠上皮细胞癌、子宫内膜癌等疾病中细胞的增殖及凋亡,与疾病的发生、发展有密切关系[ 10,11,12,13 ]。
本研究收集2011年10月至2012年10月在本院手术治疗的EMS患者异位内膜及子宫肌瘤全子宫切除术患者正常子宫内膜组织的石蜡标本,采用免疫组化技术测定54例EMS患者异位内膜组织及40例子宫肌瘤患者正常子宫内膜组织中P2X7受体的表达情况,以初步探讨P2X7受体在EMS发病中可能的作用。
1 材料和方法 1.1 一般资料选取长海医院2011年10月至2012年10月期间收治的经腹腔镜或剖腹探查术后病理确认的54例EMS患者(均为卵巢异位)作为研究对象,同期入院的子宫肌瘤全子宫切除、子宫内膜病理学诊断正常的40例患者为对照。所有患者均为育龄期女性。入选病例均符合:(1)手术时间均为月经干净3~7 d,子宫内膜呈增生期改变。(2)手术前3个月内未使用过激素类药物; (3)无自身免疫性疾病、代谢性疾病或恶性肿瘤;(4)排除生殖器官发育不良、急性炎症患者。
1.2 EMS分期术中根据1985年修订的美国生育协会(rAFS)评分法对EMS进行分期,按病变累及部位、数目、大小、深度及粘连程度评分,分为4期: Ⅰ期(微小) 1~5分,Ⅱ期(轻度) 6~15分,Ⅲ期(中度) 16~40分,Ⅳ期(重度)>40分。
1.3 主要试剂P2X7抗体(SC-25689)购自美国Santa Cruz公司,使用稀释比例1 200。二抗GTVisionⅢ抗鼠/兔通用型免疫组化试剂盒及DBA显色剂(K5007)购自丹麦Dako公司。
1.4 免疫组织化学检测将石蜡切片置于烘箱中62℃烤1~2 h; 常规脱蜡、水化; 并且用pH 6.0的0.01 mol/L柠檬酸钠抗原修复液修复; 加3%H2O2抑制内源性过氧化物酶,室温孵育; 血清封闭后孵育一抗、二抗,DAB显色3~5 min; 苏木精复染45 s,流水冲洗5 min; 盐酸乙醇分化1 s,流水冲洗15 min; 梯度乙醇脱水,二甲苯透明,树脂封片; 镜下观察,细胞核呈蓝色,阳性产物呈棕黄色或黄色。
1.5 结果判定阳性显色为棕黄色颗粒。根据切片中阳性细胞百分比和着色强度进行半定量分级评分。评分标准参见文献[ 14 ]并稍作修改: 阳性细胞的百分比≤10%为0分,11%~25%为1分,26%~50%为2分,51%~75%为3分,≥76%为4分。着色强度: 0分为不着色; 1分浅黄色; 2分黄色; 3分棕褐色。取上述两项分值的乘积作为总积分: 0分为阴性(-),1~4分为弱阳性(+),5~8分为阳性( ),9~12分为强阳性(
),9~12分为强阳性( )。
)。
采用SPSS 16.0统计软件分析,两组间计量资料的比较采用t检验,P2X7受体阳性表达率和表达强度的比较分别采用χ2检验和Mann-Whitney U检验。检验水准(α)为0.05。
2 结 果 2.1 入组患者一般资料分析所有患者均为育龄期女性,EMS组患者54例,平均年龄(34.1±1.4)岁,子宫肌瘤对照组患者40例,平均年龄(34.9±2.4)岁,两组年龄差异无统计学意义(P>0.05)。EMS组平均足月产次数(0.639±0.099)低于对照组(1.375±0.155)次,差异有统计学意义(P<0.01),但两组流产次数 [(0.556±0.171) vs (0.875±0.239)]差异无统计学意义(P>0.05)。
2.2 P2X7受体在异位子宫内膜组织和正常子宫内膜组织中的表达54例EMS异位内膜组织中P2X7受体阳性表达者共41例,阳性表达率为75.9%,其中弱阳性22例(40.7%),阳性14例(25.9%),强阳性5例(9.3%);
40例子宫肌瘤患者正常子宫内膜组织中P2X7阳性表达者3例(均为弱阳性),阳性表达率为7.5%。两组阳性率差异有统计学意义(χ2=43.21,P<0.05)。EMS组P2X7表达阳性强度多在(+)~( ),高于对照组,两组阳性强度比较差异有统计学意义(Z=-7.318,P<0.05,表 1)。 阳性细胞着色淡黄色至棕褐色不等,呈弥漫性或灶性分布(图 1A),而对照组着色细胞少且颜色多为淡黄色,或为阴性表达(图 1B)。
),高于对照组,两组阳性强度比较差异有统计学意义(Z=-7.318,P<0.05,表 1)。 阳性细胞着色淡黄色至棕褐色不等,呈弥漫性或灶性分布(图 1A),而对照组着色细胞少且颜色多为淡黄色,或为阴性表达(图 1B)。
| 表 1 P2X7受体在EMS异位内膜和正常子宫内膜组织中的表达Tab 1 Expression of P2X7 receptor in EMS ectopic endometrial and normal endometrial tissues |
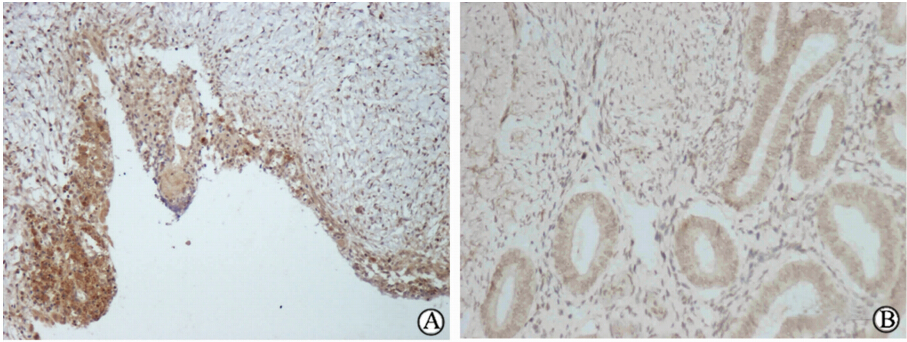 | 图 1 免疫组化染色检测嘌呤受体P2X7在EMS异位内膜(A)及正常子宫内膜(B)中的表达Fig 1 Expression of purinergic P2X7 receptor in EMS ectopic (A) and normal (B) endometrial tissues as detected by immunohistochemical stainingEMS: Endometriosis. Original magnification: ×100 |
以术前血清CA125≥50 U/mL为界将EMS患者分为两组,血清CA125<50 U/mL组(18例)与血清CA125≥50 U/mL组(36例)比较,P2X7受体表达强度差异有统计学意义(Z=-3.815,P<0.001,表 2 )。
| 表 2 子宫内膜异位症中P2X7在不同临床因素下的表达差异Tab 2 Expression of P2X7 receptor in endometriosis tissues with different clinical factors |
EMS患者rAFS分期Ⅰ~Ⅱ期者17例,Ⅲ~Ⅳ期者37例。Ⅰ~Ⅱ期组与Ⅲ~Ⅳ期组比较,EMS异位内膜中P2X7的表达强度差异有统计学意义(Z=-2.642,P<0.05,表 2 )。
3 讨 论哺乳动物P2X受体包括P2X1~P2X7,其中P2X7受体具有独特的双功能性,其生物学功能包括参与细胞信号转导、细胞因子的分泌、介导细胞的存活与生长等[ 15 ]。人P2X7受体由595个氨基酸组成,在细胞膜上可以形成3个或更多同源亚基组成的多聚体,是两次跨膜的蛋白,N端及C端均在胞内[ 16 ]。P2X7受体被ATP激活后可形成非选择性阳离子通道,允许钾离子、钠离子、钙离子等阳离子跨膜流动; 且对二价阳离子表现出相对强的选择性,在低价阳离子环境及ATP持续刺激下,激活的P2X7受体能形成大的膜水孔,允许大分子物质通过[ 17 ]。 研究表明,P2X7受体在多种炎性病理状态下表达上调,细胞外ATP激活巨噬细胞等炎性细胞P2X7受体后促进IL-1、IL-18、TNF-α等炎性因子的表达与释放,参与炎性反应和免疫反应[ 18,19 ]。
EMS的发病机制中经典的"经血逆流种植"学说占主导,但近年研究表明免疫因素、炎症因素在EMS的发病机制中发挥重要作用,EMS患者细胞免疫功能减弱同时腹腔巨噬细胞活性增强,所分泌的炎性因子可促进异位内膜细胞的种植、生长[ 4,5 ]。Berbic等[ 5 ]的研究表明,EMS患者异位病灶白细胞富集,分泌细胞因子、血管生成因子等活性物质,进而促进腹腔异位内膜病灶的形成。核因子NF-κB在EMS的形成和发展中可能起关键作用,它可以通过调控基因转录来促进异位内膜细胞增殖、黏附并抑制细胞凋亡[ 7 ]。有研究显示P2X7受体参与转录因子NF-κB的活化机制,NF-κB活化后使IκB被蛋白水解酶降解,NF-κB释放进入细胞核后与DNA结合位点结合,调节未成熟炎症细胞因子和黏附分子等表达[ 20 ]。P2X7受体是否通过炎症反应参与EMS的形成尚未见报道。
本研究发现P2X7受体在异位子宫内膜组织中阳性表达率为75.9%,表达强度多为弱阳性和阳性,而对照组正常子宫内膜阳性率仅7.5%,且阳性强度表现为弱阳性,两组阳性表达率和表达强度差异均有统计学意义(P<0.01),提示P2X7受体与子宫内膜异位症的发生发展有关。
CA125是一种糖蛋白,普遍存在于体腔上皮化生组织的细胞膜表面,鉴于血清CA125水平与EMS临床分期存在正相关关系[ 21 ],对EMS的诊断与疗效观察有重要参考价值,且我国EMS患者血清CA125水平平均为50~80 kU/L [ 22 ],本研究以血清CA125值≥50 U/mL为界将EMS患者分为两组,发现CA125≥50 U/mL组 P2X7受体阳性表达高于血清CA125<50 U/mL组。同时还发现,P2X7在中、重型EMS(Ⅲ~Ⅳ期)患者中阳性表达强度较微、轻型(Ⅰ~Ⅱ期)更加明显。结果进一步提示P2X7受体与EMS的发生发展可能有密切联系。
需要指出的是,EMS患者多因“进行性加重的痛经”或“不孕”就诊,以25~45岁处于生育年龄的妇女多见。由于正常子宫内膜标本获取的受限,本研究选取子宫肌瘤患者正常子宫内膜作为对照,其一般资料与EMS组在足月产次数上存在差异,EMS组足月产次数少于对照组,这由EMS疾病特点所决定。
目前P2X7受体与EMS的关联性研究较少,我们前期研究证实乳腺癌组织P2X7受体与雌激素受体表达有正相关性[ 23 ]。而EMS被称为“激素依赖性疾病”,目前除根治性手术外,临床上无论是药物治疗或保守性手术均有较高的复发率。EMS异位内膜组织中P2X7受体与雌激素受体表达是否有相关性,尚需进一步研究证实。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Holoch K J,Lessey B A.Endometriosis and infertility[J].Clin Obstet Gynecol,2010,53:429-438. |
| [2] | Giudice L C,Kao L C.Endometriosis[J].Lancet,2004,364:1789-1799. |
| [3] | Mandai M,Yamaguchi K,Matsumura N,Baba T,Konishi I.Ovarian cancer in endometriosis:molecular biology,pathology,and clinical management[J].Int J Clin Oncol,2009,14:383-391. |
| [4] | Osuga Y,Koga K,Hirota Y,Hirata T,Yoshino O,Taketani Y.Lymphocytes in endometriosis[J].Am J Reprod Immunol,2011,65:1-10. |
| [5] | Berbic M,Fraser I S.Regulatory T cells and other leukocytes in the pathogenesis of endometriosis[J].J Reprod Immunol,2011,88:149-155. |
| [6] | Sikora J,Mielczarek-Palacz A,Kondera-Anasz Z.Role of natural killer cell activity in the pathogenesis of endometriosis[J].Curr Med Chem,2011,18:200-208. |
| [7] | Gonzlez-Ramos R,Van Langendonckt A,Defrère S,Lousse J C,Colette S,Devoto L,et al.Involvement of the nuclear factor-κB pathway in the pathogenesis of endometriosis[J].Fertil Steril,2010,94:1985-1994. |
| [8] | Jarvis M F,Khakh B S.ATP-gated P2X cation-channels[J].Neuropharmacology,2009,56:208-215. |
| [9] | Pankratov Y,Lalo U,Krishtal O A,Verkhratsky A.P2X receptors and synaptic plasticity[J].Neuroscience,2009,158:137-148. |
| [10] | Jubb A M,MillerK D,Rugo H S,Harris A L,Chen D,Reimann J D.Impact of exploratory biomarkers on the treatment effect of bevacizumab in metastatic breast cancer[J].Clin Cancer Res,2011,17:372-381. |
| [11] | Coutinho-Silva R,Stahl L,Cheung K K,de Campos N E,de Oliveira Souza C,Ojcius D M,et al.P2X and P2Y purinergic receptors on human intestinal epithelial carcinoma cells:effects of extracellular nucleotides on apoptosis and cell proliferation[J].Am J Physiol Gastrointest Liver Physiol,2005,288:G1024-G1035. |
| [12] | Wang Q,Wang L,Feng Y H,Li X,Zeng R,Gorodeski G I.P2X7 receptor-mediated apoptosis of human cervical epithelial cells[J].Am J Physiol Cell Physiol,2004,287:C1349-C1358. |
| [13] | Li X,Zhou L,Feng Y H,Abdul-Karim F W,Gorodeski G I.The P2X7 receptor:a novel biomarker of uterine epithelial cancers[J].Cancer Epidemiol Biomarkers Prev,2006,15:1906-1913. |
| [14] | Birner P,Schindl M,Obermair A,Plank C,Breitenecker G,Oberhuber G.Overexpression of hypoxia-:inducible factor 1α is a marker for an unfavorable prognosis in early-:stage invasive cervical cancer[J]. Cancer Res,2000,60:4693-4696. |
| [15] | Khakh B S,North R A.P2X receptors as cell-surface ATP sensors in health and disease[J].Nature,2006,442:527-532. |
| [16] | Smart M L,Gu B,Panchal R G,Wiley J,Cromer B,Williams D A,et al.P2X7 receptor cell surface expression and cytolytic pore formation are regulated by a distal C-terminal region[J].J Biol Chem,2003,278:8853-8860. |
| [17] | Wang L,Feng Y H,Gorodeski G I.Epidermal growth factor facilitates epinephrine inhibition of P2X7-receptor-mediated pore formation and apoptosis:a novel signaling network[J].Endocrinology,2005,146:164-174. |
| [18] | Lenertz L Y,Wang Z,Guadarrama A G,Hill LM,Gavala M L,Bertics P J. Mutation of putative N-:linked glycosylation sites on the human nucleotide receptor P2X(7) reveals a key residue important for receptor function[J]. Biochemistry,2010,49:4611-4619. |
| [19] | Ferrari D,Pizzirani C,Adinolfi E,Lemoli R M,Curti A,Idzko M,et al. The P2X7 receptor:a key player in IL-:1 processing and release[J]. J Immunol,2006,176:3877-3883. |
| [20] | Grol M W,Panupinthu N,Korcok J,Sims S M,Dixon S J. Expression,signaling,and function of P2X7 receptors in bone[J]. Purinergic signalling,2009,5:205-:221. |
| [21] | Kras 'nicki D.[Serum and peritoneal fluid CA-125 concentration in women with endometriosis][J].Ginekol Pol,2001,72(12A):1365. |
| [22] | 郎景和.子宫内膜异位症的研究与设想[J].中华妇产科杂志,2003,38:478-480. |
| [23] | Li H,Wang L,Qu H,Yu L H,Burnstock G,Ni X,et al.P2Y2 receptor-mediated modulation of estrogen-induced proliferation of breast cancer cells[J].Mol Cell Endocrinol,2011,338:28-37. |
 2014, Vol. 35
2014, Vol. 35


