2. 第二军医大学长海医院肾内科, 上海 200433
2. Department of Nephrology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
肾脏缺血再灌注损伤(ischemia reperfusion injury,IRI)是造成住院患者急性肾损伤(kidney injury,AKI)的主要原因,致死率与致残率均较高[1,2],其病因包括休克、脓毒症、肾动脉狭窄、冠状动脉旁路移植术或肾移植术等。尽管肾脏IRI的病理生理过程已经得到广泛的研究,但具体机制仍未明确。
microRNA(miRNA)是一类内源性具有调控功能的小片段非编码RNA,可与靶基因mRNA 3′端非编码区(untranslated region,UTR)完全或不完全结合在转录后水平调控蛋白合成[3]。miRNA对各种生命活动发挥着重要的调控作用,近年来研究显示,肾脏缺血再灌注损伤时miRNA也可通过多种机制调控肾脏损伤与修复过程。例如,Lan等[4]研究显示,miRNA-494可通过抑制激活转录因子3(ATF3)的表达来调控肾脏IRI时各种炎性介质或黏附分子的产生,从而影响肾损伤程度;Godwin等[5]发现,miR-21通过调控PDCD4和Bcl-2影响肾小管上皮细胞的增殖与凋亡;但是,miRNA对肾脏缺血再灌注损伤的调控作用极其复杂,仍有大量miRNA调控网络尚未明确。因此,本研究拟利用miRNA芯片检测IRI肾脏miRNA的表达谱变化情况,同时利用生物信息学检索的方法初步探讨其相关机制。 1 材料和方法 1.1 实验动物
清洁级10周龄SD大鼠12只,雄性,体质量180~200 g,购自第二军医大学实验动物中心,生产许可证号:SCXK(沪)2012-0003;使用许可证号:SYXK(沪)2012-2003。大鼠随机分为2组,每组6只,分别为肾脏IRI组和假手术组。 1.2 肾脏IRI的构建 大鼠适应性饲养1周后参照Bellini等[6]的方法构建肾脏IRI模型,具体方法为:采用10%水合氯醛280~350 mg/kg腹腔注射进行麻醉后经腹正中切口分别暴露双侧肾蒂,微血管夹夹闭双侧肾蒂,伤口覆盖纱布,灯烤保暖,45 min后开放动脉,逐层缝合肌层和皮肤。假手术组小鼠采用同样手法暴露肾蒂并等待45 min后缝合伤口。动物建模12 h后再次麻醉大鼠,心脏穿刺抽血分离血清检测血尿素与肌酐水平验证造模成功情况,并取出双侧肾脏,断颈法处死。参照Supavekin等[7]的研究,再灌注后3 h肾脏无明显变化,12 h后即开始出现明显凋亡,因此选取12 h筛选差异表达的miRNA。 1.3 肾脏总RNA的提取
采用酚氯仿法抽提总RNA,具体如下。将单侧肾脏置于1 mL TRIzol溶液(Invitrogen,美国)进行匀浆,加入0.2 mL氯仿,剧烈摇晃15 s,3 min后12 000×g 4 ℃离心15 min,吸入上清液。加入0.5 mL异丙醇,静置10 min,12 000×g 4℃离心10 min,去上清。加入1 mL 75%乙醇洗涤RNA沉淀,振荡器混匀,7 500×g 4℃离心5 min,去上清,风干5 min,用DEPC水重悬RNA沉淀。分光光度计测浓度与纯度后-80℃冻存。 1.4 miRNA芯片检测
利用美国联川生物公司提供的miRNA芯片进行筛查IRI肾脏miRNA表达谱,具体方法如下。将同组肾脏的总RNA混合后进行质控检测,经质控合格后经过YM-100(Millipore)微离心过滤柱得到片段小于300 nt的小RNA,Poly(A)聚合酶在分离到的小RNA 3′端加上poly(A)尾巴,再将一个寡聚核苷酸标记与这个poly(A)尾巴连接用于后续的荧光标记。在双样品实验中,用2个不同的标记物来标记2个RNA样品。杂交反应通过微循环泵杂交仪器在μParafloTM微流体芯片上过夜(Atactic Technologies)。杂交使用含有 25%的甲酰胺的 100 μL 6×SSPE缓冲液 (0.90 mol/L NaCl, 60 mmol/L Na2HPO4, 6 mmol/L EDTA, pH 6.8),杂交温度 34℃。杂交检测使用Cy3 和 Cy5 特异性荧光标记、激光扫描仪(GenePix 4000B, Molecular Device)采集杂交图像、Array-Pro(Media Cybernetics)软件对杂交图像进行数字化转换。数据处理和分析首先是扣除背景,计算重复点平均值和标准偏差,然后通过LOWESS过滤进行标准化。对于双色标记实验,将计算2种检测信号的比值(log2)和t-test的P值。检验水准(α)为0.01。 1.5 miRNA实时定量PCR法验证
采用实时定量PCR法验证IRI肾脏miRNA的表达谱。首先利用Qiagen公司提供的miScript RTⅡ kit进行反转录实验(ABI 9700 PCR System,ABI,USA), 步骤为37℃ 60 min,95℃ 5 min,在这一步实验中,miRNA 3′端被加上poly(A)结构以便展开后续的PCR实验;再利用Qiagen公司提供的miScript SYBR Green PCR Kit和miScript Primer Assay进行实时定量PCR实验(Rotor-gene 6000 PCR system, Corbett, Australia),步骤为:95℃ 15 min;94℃ 15 s,55℃ 30 s,70℃ 30 s,40个循环;溶解曲线分析60~95℃。 1.6 生物信息学检索
根据miRNA芯片和实时定量PCR验证结果,选择IRI肾脏和假手术大鼠肾脏表达差异在2倍以上的miRNA进行生物信息学检索分析。检索网站分别为miRanda(http://www.microrna.com)、PicTar(http://pictar.mdc-berlin.de/cgi-bin/new_PicTar_vertebrate.cgi)和TargetScan(http://www.targetscan.org/)。为进一步增加靶基因预测的可靠性,我们利用RGB通路数据库中的大鼠基因组数据库进行了进一步通路相关性分析。 1.7 统计学处理
应用SPSS 16.0统计软件进行统计分析。计量资料用x±s表示,两组间比较采用Student’s t检验。检验水准(α)为0.05。 2 结 果 2.1 动物建模情况
所有动物均建模成功,肾脏IRI 12 h后大鼠血尿素氮水平为(28.2±3.5)mmol/L, 肌酐水平为(156.0±12.1)μmol/L,均高于假手术组大鼠[血尿素氮水平为(6.8±1.5)mmol/L,肌酐水平为(28.2±3.5)mmol/L, P<0.05]。 2.2 miRNA芯片结果 miRNA芯片检测发现,IRI肾脏一共有36条差异表达的miRNA,并且表达差异在2倍以上的miRNA有15条,其中表达上调的有10条,包括miR-290、miR-894、miR-292-5p、miR-327、miR-374、miR-98、miR-352、miR-132、miR-146b和miR-196a;表达下调的miRNA有5条,包括miR-145、miR-329、miR-375、miR-140*和miR-29a (图1)。
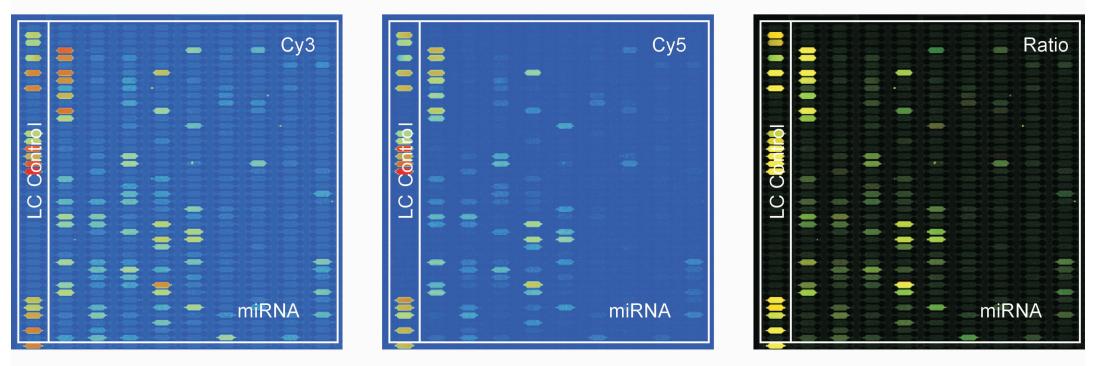 | 图1 肾脏缺血再灌注损伤和假手术大鼠肾脏miRNA表达的芯片检测结果 Fig.1 Microarray analysis of renal miRNA expression in rats with renal ischemia/reperfusion injury and sham surgery Cy3: Renal ischemia/reperfusion injury group; Cy5: Sham group |
miRNA实时定量PCR结果与芯片结果具有相同的趋势,具体数据如图2M所示。
 | 图2 肾脏缺血再灌注损伤大鼠肾脏miRNA表达的实时定量PCR检测结果 Fig.2 Quantitative real-time PCR results of renal miRNA expression in rats with renal ischemia/reperfusion injury n=6, x±s |
遵循物种保守性,筛选可能与肾脏IRI相关的靶基因,结果见表1。由表1可见,肾脏IRI相关的miRNA的靶基因可分为炎症反应、细胞死亡与增殖、血管再生和纤维化等有关。其中炎症反应相关的通路包括mTOR、MAPK和NF-κB等,而转化生长因子(transforming growth factor,TGF)和胰岛素样生长因子(insulin-like growth factor,IGF)可能是参与缺氧诱导的机体反应中较为关键的两个因素。我们进一步对MAPK通路进行分析,结果显示,miR-290、miR-874、miR-292-5p、miR-29a、miR-98、miR-132和miR-145等miRNA均可能参与了JNK/MAPK或p38/MAPK信号通路的调控(图3)。
|
|
表1 肾脏IRI相关miRNA的靶基因预测 Table 1 Potential target genes of renal ischemia/reperfusion injury(IRI)-related miRNAs |
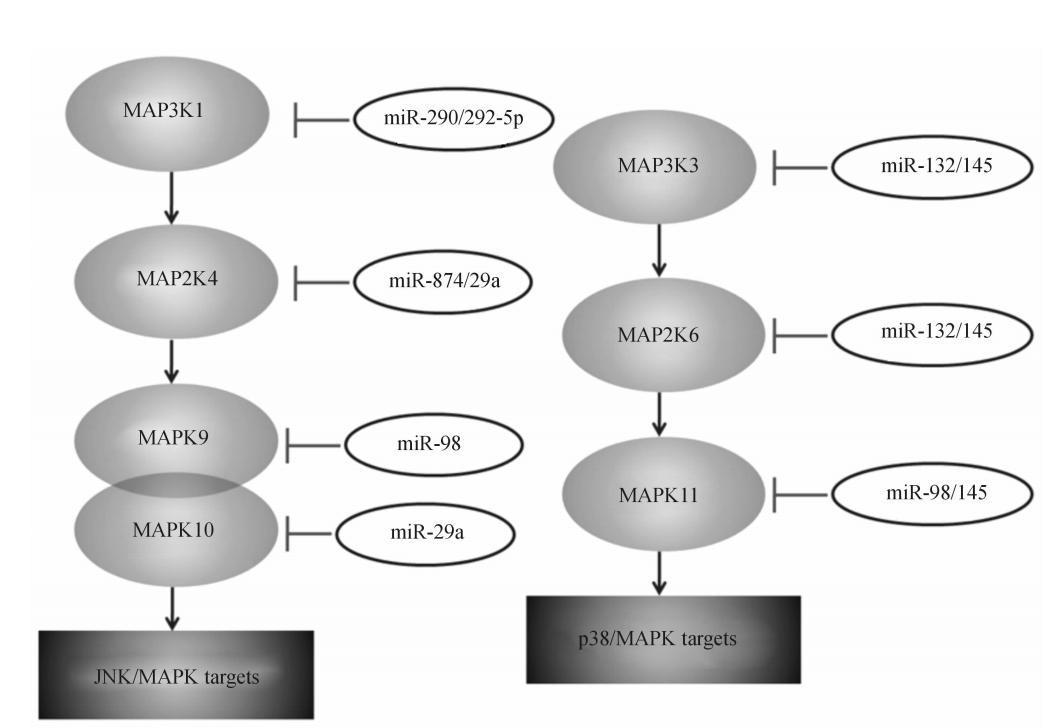 | 图3 肾脏缺血再灌注损伤相关miRNA与MAPK通路的潜在相关性 Fig.3 Potential correlation of MAPK pathways and miRNAs related to renal ischemia/reperfusion injury MAPK: Mitogen-activated protein kinase; JNK:C-jun N-terminal kinase |
AKI是临床危重病患者最常见的合并症之一,也是导致其死亡的重要原因。研究显示,AKI在全部住院患者中的发病率为7.2%,同时血清肌酐水平高于265 μmol/L的患者病死率高达37.8%[7],而在加强医疗病房(intensive care unit,ICU)中其病死率更高,可达45.6%[8]。 而肾脏IRI则是医院内发生IRI的重要原因之一。如脓毒症、休克和肾移植后发生的急性肾损伤。休克和肾移植中供体肾损伤是最经典的肾脏IRI模型,而脓毒症时发生的AKI往往发生在脓毒性休克后,其原因可能在于持续低灌注或者大剂量血管收缩药物导致的肾脏缺血。因此,防治肾脏IRI损伤是防治AKI的重要措施。
肾脏IRI的发病机制非常复杂,是多细胞多分子共同参与的结果。微血管内皮细胞损伤、炎细胞浸润、上皮细胞凋亡和成纤维细胞增生等构成了肾脏IRI的病理学基础,细胞因子、促炎介质和生长因子等介质则组成了其发生发展的分子机制[9,10,11]。但是,迄今为止仍无从机制上有效干预肾脏IRI的特异性治疗手段,主要是因为这些介质构成的网络难以从单一靶点进行干预,或是干预的同时可能造成新的负面影响。
miRNA是近年来研究的热点之一,它们通过与靶基因3′ UTR完全或不完全结合负向调控mRNA翻译[3]。这种调控作用往往缺乏特异性,一条miRNA可有多个靶基因,而一个靶基因可被多条miRNA调控。在诸多疾病模型中,miRNA被证实为具有良好前景的干预靶点,肾脏IRI也不例外。但是,目前对肾脏IRI相关的miRNA了解甚少,有限的文献显示,miRNA参与了肾脏IRI的炎症反应、纤维化和细胞死亡与修复[4,5,12,13,14]。
本研究显示,IRI后肾脏有36条miRNA出现差异性表达,其中表达差异在2倍以上的有15条。与文献相比,Liu等[15]在鼠肾脏IRI 24 h后用芯片检测发现,小鼠IRI肾脏中有76条表达差异大于2倍的miRNA,与本研究相似的结果为miR-290表达的上调。Muratsu-Ikeda等[16]用芯片检测缺氧复氧培养后人肾小管上皮细胞株(HK-2)miRNA表达的变化,结果发现miR-29a在复氧后3 h和10 h均显著上调,但是本研究中miR-29a表达是下调的。这些miRNA表达谱的差异可能为种族差异与取材时间点的不同所致。但是,鉴于miRNA物种保守性的特点,我们推测,miR-29a和miR-290可能是介导肾脏IRI的重要miRNA。
根据生物信息学检索的结果,miR-290和miR-29a均可调控炎症反应,其中Beclin-1和B7-H3分别是它们可能的靶基因。Beclin-1是自噬相关分子,在细胞自噬时表达显著上调。Chung等[17]研究显示,尿路梗阻大鼠肾小管Beclin-1表达显著上调,与之对应的是肾小管凋亡与焦亡(pyroptosis)显著增加。Zeng等[18]发现马兜铃酸诱导肾小管上皮细胞自噬时Beclin-1显著上调,siRNA阻断Beclin-1后上皮细胞凋亡加重,因此Beclin-1介导的自噬作用可能可抑制肾小管上皮细胞凋亡从而介导保护作用。肾脏IRI时miR-290与miR-292-5p表达上调,可能抑制Beclin-1的表达,从而加重了肾小管上皮细胞凋亡。B7-H3是向淋巴细胞表面CD28传递刺激信号的B7家族成员之一,可负向调控CD28介导的免疫反应。在自身免疫性疾病和肿瘤免疫中,其可传递负向信号抑制淋巴细胞杀伤肿瘤的能力;在移植免疫中,B7-H3阻断可加速排异反应的发生[19]。因此, miR-29a表达下调可导致B7-H3上调,可能是肾脏IRI时炎症反应的负反馈作用。根据靶基因预测的结果,数条miRNA均可能参与了MAPK通路的调控。MAPK通路是丝氨酸/苏氨酸特异性蛋白激酶,其与细胞增殖、分化、存活与凋亡密切相关。多项研究显示MAPK通路的激活均可能参与了肾脏缺血再灌注损伤的发病机制,同时该通路也可能是肾脏缺血再灌注损伤治疗的潜在靶点[20,21]。因此,针对本研究发现的这些miRNA进行深入研究,可能为将来利用转录后调控机制防治缺血性肾损害指引了方向。但是,这些仅仅是对于本研究中miRNA表达变化的推测,其具体作用机制还有待将来进一步研究。
本研究通过构建大鼠肾脏IRI模型,利用miRNA芯片检测了IRI时肾脏miRNA的表达谱,并通过生物信息学检索的手段初步探讨了miRNA表达变化可能的作用机制。这些miRNA可能是通过调控炎症反应、细胞死亡与增殖、血管再生和纤维化等病理生理过程来影响肾脏IRI的发生发展过程,但是具体作用机制仍有待进一步研究。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Safian R D,Textor S C. Renal-artery stenosis[J].N Engl J Med,2001,344:431-442. |
| [2] | Schrier R W,Wang W.Acute renal failure and sepsis[J].N Engl J Med,2004,351:159-169. |
| [3] | Bartel D P.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116:281-297. |
| [4] | Lan Y F,Chen H H,Lai P F,Cheng C F,Huang T,Lee Y C,et al.MicroRNA-494 reduces ATF3 expression and promotes AKI[J].J Am Soc Nephrol,2012,23:2012-2023. |
| [5] | Godwin J G,Ge X,Stephan K,Jurisch A,Tullius S G,Iacomini J.Identification of a microRNA signature of renal ischemia reperfusion injury[J].Proc Natl Acad Sci USA,2010,107:14339-14344. |
| [6] | Bellini M H,Coutinho E L,Filgueiras T C,Maciel T T,Schor N.Endostatin expression in the murine model of ischaemia/reperfusion-induced acute renal failure[J].Nephrology (Carlton),2007,12:459-465. |
| [7] | Supavekin S,Zhang W,Kucherlapati R,Kaskel F J,Moore L C,Devarajan P.Differential gene expression following early renal ischemia/reperfusion[J].Kid Int,2003,63:1714-1724. |
| [8] | Nash K,Hafeez A,Hou S.Hospital-acquired renal insufficiency[J].Am J Kidney Dis,2002,39:930-936. |
| [9] | Ostermann M,Chang R W.Acute kidney injury in the intensive care unit according to RIFLE[J].Crit Care Med,2007,35:1837-1843. |
| [10] | Daemen M A,de Vries B,Buurman W A.Apoptosis and inflammation in renal reperfusion injury[J].Transplantation,2002,73:1693-1700. |
| [11] | Molitoris B A,Sutton T A.Endothelial injury and dysfunction:role in the extension phase of acute renal failure[J].Kidney Int,2004,66:496-499. |
| [12] | Docherty N G,Pérez-Barriocanal F,Balboa N E, López-Novoa J M.Transforming growth factor-beta1 (TGF-beta1):a potential recovery signal in the post-ischemic kidney[J].Ren Fail,2002,24:391-406. |
| [13] | Aurora A B,Mahmoud A I,Luo X,Johnson B A,van Rooij E,Matsuzaki S,et al.MicroRNA-214 protects the mouse heart from ischemic injury by controlling Ca2+ overload and cell death[J].J Clin Invest,2012,122:1222-1232. |
| [14] | Kato M,Zhang J,Wang M,Lanting L,Yuan H,Rossi J J,et al.MicroRNA-192 in diabetic kidney glomeruli and its function in TGF-β-induced collagen expression via inhibition of E-box repressors[J].Proc Natl Acad Sci USA,2007,104:3432-3437. |
| [15] | Liu F,Lou Y L,Wu J,Ruan Q F,Xie A,Guo F,et al.Upregulation of microRNA-210 regulates renal angiogenesis mediated by activation of VEGF signaling pathway under ischemia/perfusion injury in vivo and in vitro[J].Kidney Blood Press Res,2012,35:182-191. |
| [16] | Muratsu-Ikeda S,Nangaku M,Ikeda Y,Tanaka T, Wada T,Inagi R.Downregulation of miR-205 modulates cell susceptibility to oxidative and endoplasmic reticulum stresses in renal tubular cells[J].PLoS One,2012,7:e41462. |
| [17] | Chung S D,Lai T Y,Chien C T,Yu H J.Activating Nrf-2 signaling depresses unilateral ureteral obstruction-evoked mitochondrial stress-related autophagy,apoptosis and pyroptosis in kidney[J].PLoS One,2012,7:e47299. |
| [18] | Zeng Y,Yang X,Wang J,Fan J,Kong Q,Yu X.Aristolochic acid I induced autophagy extenuates cell apoptosis via ERK 1/2 pathway in renal tubular epithelial cells[J].PLoS One,2012,7:e30312. |
| [19] | Ueno T,Yeung M Y,McGrath M,Yang S,Zaman N,Snawder B,et al.Intact B7-H3 signaling promotes allograft prolongation through preferential suppression of Th1 effector responses[J].Eur J Immunol,2012,42:2343-2353. |
| [20] | Chen J,Wang W,Zhang Q,Li F,Lei T,Luo D,et al.Low molecular weight fucoidan against renal ischemia-reperfusion injury via inhibition of the MAPK signaling pathway[J].PLoS One,2013,8:e56224. |
| [21] | Park K M,Fogelgren B,Zuo X,Kim J,Chung D C,Lipschutz J H.Exocyst Sec10 protects epithelial barrier integrity and enhances recovery following oxidative stress,by activation of the MAPK pathway[J].Am J Physiol Renal Physiol,2010,298:F818- F826. |
 2014, Vol. 35
2014, Vol. 35


