2. 第二军医大学长海医院普通外科, 上海 200433
2. Department of General Surgery, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
结肠癌是指结肠黏膜上皮在环境或遗传等多种致癌因素作用下发生的恶性病变,是常见的恶性肿瘤之一,占所有恶性肿瘤的10%~15%[1]。结肠癌的发病原因与遗传、结肠腺瘤、息肉病、慢性炎症、高脂肪、少纤维饮食习惯等都有一定关系[2],结肠癌发病隐匿,病程慢早期无明显的临床表现,出现明显症状时大多已到了中晚期,病死率仅次于肺癌和肝癌,是危害人们健康的可怕杀手[3]。
MicroRNA(miRNA)是一类进化上高度保守的细胞内源性非编码单链小RNA,与多种疾病的发病机制密切相关,参与肿瘤的发生发展过程。MiRNA(miR)-181家族在神经系统[4]、造血系统[5]、消化系统[6]等细胞中广泛存在,对人类生理或病理进程有调控作用。研究显示miR-181a在结肠癌组织中的表达水平与患者的预后情况相关,miR-181a高表达患者预后较差[7],但miR-181a对结肠癌生长的调控作用和机制并未完全阐明。本研究通过结肠癌细胞系转染miRNA抑制剂/模拟物的方法,确定miR-181a对结肠癌细胞生长的影响,同时确定miR-181a的作用靶基因,探索miR-181a对结肠癌的临床治疗的价值。
1 材料和方法 1.1 细胞系、主要试剂与仪器人结肠癌细胞系TCHu102和工具细胞293T分别购自上海生命科学研究院细胞库。miR-181a抑制物和模拟物购自上海吉玛公司,PRKCD抗体和GAPDH抗体购自Santa Cruz公司,M199和DMEM培养基、胎牛血清、脂质体转染试剂购自Invitrogen公司,实时定量PCR试剂盒购自TaKaRa公司,MTT试剂购自Sigma公司,内参质粒Renilla、双荧光素酶活性检测试剂盒购自Promega公司,荧光素酶报告基因质粒pGL3-PRKCD-3′UTR 由英潍捷基(上海)贸易有限公司负责构建。细胞培养箱和生物安全柜购自Thermo Fisher公司,显微镜购自Olympus公司,实时定量PCR仪(RG3000A)购自Qiagen公司,酶标仪购自BioTek公司。
1.2 细胞增殖能力检测将结肠癌细胞按1 000个/孔的细胞密度铺板于96孔培养板中,边缘孔用无菌PBS填充,在5% CO2、37℃条件下培养24 h,加入转染试剂,设5个复孔,继续培养24 h后,每孔加入20 μL 0.5% MTT溶液(5 mg/mL),孵育4 h后吸去孔内培养液,每孔加入150 μL DMSO,置摇床上低速振荡10 min,充分溶解结晶物,在酶标仪490 nm处测量各孔的光密度值。
1.3 双荧光素报告基因检测及实时定量PCR将293T细胞按105个/孔接种于24孔培养板,用含10% FBS的DMEM培养液培养,使细胞融合率达到70%左右;将内参质粒Renilla、荧光素酶报告基因质粒pGL3-PRKCD-3′UTR以及miR-181a模拟物共转染,继续培养24 h后,裂解细胞,利用双荧光素酶活性检测试剂盒检测荧光素酶活性的变化。根据TRIzol试剂的说明书提取细胞总RNA,测定RNA的浓度。取500 ng总RNA,利用反转录试剂盒合成cDNA;适当稀释后进行实时定量PCR反应,反应条件为95℃ 10 s,58℃ 15 s,72℃ 20 s,40个循环。
1.4 蛋白质印迹分析检测利用RIPA细胞裂解液提取细胞总蛋白,按常规蛋白质印迹分析方法,取30 μg总蛋白经凝胶电泳,转膜,5%脱脂牛奶封闭,一抗(PRKCD抗体1∶1 000稀释;GAPDH抗体1∶5 000稀释)于4℃过夜杂交,二抗(1∶5 000稀释)常温杂交2 h,洗膜后显影。灰度值经Image-J软件分析。
1.5 统计学处理应用SPSS 16.0软件进行统计学分析,实验数据以 ±s表示,两组间比较采用student-t检验,多组分析采用one-way ANOVA分析。检验水准(α)为0.05。
2 结 果 2.1 miR-181a抑制剂与模拟物的转染效率定量PCR结果发现,miR-181a抑制剂的转染浓度为20、50和100 nmol/L时,miR-181a在结肠癌细胞中的水平分别是对照组的(59.90±3.14)%、(22.80±1.18)%和(20.40±0.65)%,对细胞内miR-181a的水平具有抑制作用(P<0.05,P<0.01);而miR-181a模拟物的转染浓度为20、50和100 nmol/L时,miR-181a在结肠癌细胞中的水平分别是对照组的(2.26±0.19)倍、(2.99±0.22)倍和(3.30±0.11)倍,对细胞内miR-181a的水平具有过表达作用(P<0.01)当miR-181a抑制剂转染浓度为10 nmol/L时,miR-181a水平无统计学意义。
2.2 miR-181a调控结肠癌细胞的生长活力在结肠癌细胞中转染50 nmol/L的miR-181a抑制剂后,继续培养24 h,细胞的生长活力明显受到抑制(P<0.01),为对照组的(28.90±0.45)%;而转染20 nmol/L的miR-181a模拟物后,MTT结果显示结肠癌细胞的生长活力无明显变化。
2.3 靶基因的生物信息学筛选通过生物信息学预测的方法,PRKCD基因可能是miR-181a的靶基因,在该基因的3′UTR区域存在miR-181a的1个结合位点,与miR-181a种子序列完全配对,并且此位点序列在人、小鼠、大鼠等物种中高度保守。
2.4 靶基因的报告基因验证双荧光素报告基因检测结果发现转染miR-181a模拟物后,含有PRKCD基因3′UTR的荧光素酶活性受到明显抑制(P<0.01),为对照组的(30.20±5.69)%;同时转染miR-181a抑制剂后,含有PRKCD基因3′UTR的荧光素酶活性则增加(P<0.01),为对照组的(2.76±0.45)倍。
2.5 miR-181a调控PRKCD的表达在结肠癌细胞系TCHu102中转染miR-181a抑制剂24 h后,分别提取细胞总RNA和总蛋白。抑制miR-181a后,定量PCR结果显示PRKCD基因的相对表达水平无明显变化,蛋白质印迹分析结果显示,PRKCD的蛋白水平升高(P<0.05),是对照组的(1.79±0.02)倍 (图 1)。
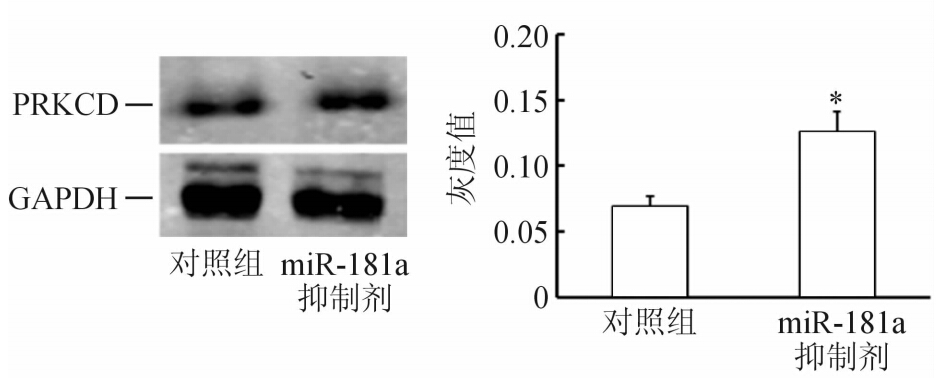
|
图 1 miR-181a对PRKCD蛋白水平表达的影响 *P<0.05与对照组比较. n=3, ±s |
miR-181家族在物种进化中较保守,最早是在小鼠淋巴细胞中发现其特异高表达,且调控早期造血系统的行程[8]。随后的研究证实miR-181是一个重要的基因表达调控因子,功能涉及生物体免疫、炎症,细胞生长、凋亡及分化成熟[9]。miR-181在肿瘤发生发展中的调控机制目前还未完全阐明,但其在白血病等疾病发生发展过程中的调控作用均已被发现[10]。本研究表明,miR-181a在结肠癌细胞中调控细胞生长活力,通过生物信息学预测和报告基因验证的方法,证实了PRKCD是其作用的靶基因。
蛋白激酶C属于多功能丝氨酸和苏氨酸激酶,是G蛋白偶联受体系统中的效应物, 在非活性状态下是水溶性的,游离存在于胞质溶胶中,激活后成为膜结合的酶[11]。PRKCD是蛋白激酶C家族的亚类,目前研究证明PRKCD的激活与细胞周期激活密切相关[12],与磷脂酰肌醇蛋白依赖性激酶-1、西多莫司靶蛋白、胰岛素受体等相互作用[13]。肿瘤的发生发展也与PRKCD的表达相关,De Servi等[14]的研究表明PRKCD的激活能充分诱导肿瘤细胞凋亡,并且是凋亡过程的主要参与者。本研究发现PRKCD的表达受到miR-181a的调控,在结肠癌细胞中敲低miR-181a可显著抑制PRKCD的蛋白表达水平,但其基因表达水平并无明显变化,提示miR-181a对PRKCD的调控是在转录后水平,通过与PRKCD基因3’UTR的不完全互补结合,抑制其翻译,不影响其转录活性。但在宫颈癌细胞化疗敏感性的研究显示miR-181a对PRKCD的调控作用不仅体现在蛋白水平的下调,其mRNA水平也受到明显的抑制[15],这可能与miR-181a在不同类型细胞中内源性水平以及miR-181a的过表达或抑制效率有关,同时增加转染时间可能也会影响miRNA靶基因的mRNA水平。
miR-181a参与细胞分化、凋亡、迁移、免疫等过程,在多种肿瘤中发现miR-181a的表达异常。深入研究miR-181a的调控机制及影响因素,将有利于探明miR-181a与肿瘤发生发展之间的因果关系,为肿瘤发生机制的研究提供新的遗传路线,开发新的癌症诊断和治疗方法,为miRNA将来可能的临床应用提供理论依据。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Watson A J, Collins P D. Colon cancer: a civilization disorder[J]. Dig Dis,2011,29:222-228. |
| [2] | Pino M S, Chung D C. The chromosomal instability pathway in colon cancer[J]. Gastroenterology,2010,138:2059-2072. |
| [3] | Klampfer L. Cytokines, inflammation and colon cancer[J]. Curr Cancer Drug Targets,2011,11:451-464. |
| [4] | Hutchison E R, Kawamoto E M, Taub D D, Lal A, Abdelmohsen K, Zhang Y, et al. Evidence for miR-181 involvement in neuroinflammatory responses of astrocytes[J]. Glia,2013,61:1018-1028. |
| [5] | Vasilatou D, Papageorgiou S, Pappa V, Papageorgiou E, Dervenoulas J. The role of microRNAs in normal and malignant hematopoiesis[J]. Eur J Haematol,2010,84:1-16. |
| [6] | Kim C H, Kim H K, Rettig R L, Kim J, Lee E T, Aprelikova O, et al. miRNA signature associated with outcome of gastric cancer patients following chemotherapy[J]. BMC Med Genomics,2011,4:79. |
| [7] | Nishimura J, Handa R, Yamamoto H, Tanaka F, Shibata K, Mimori K, et al. MicroRNA-181a is associated with poor prognosis of colorectal cancer[J]. Oncol Rep,2012,28:2221-2226. |
| [8] | Pekarsky Y, Santanam U, Cimmino A, Palamarchuk A, Efanov A, Maximov V, et al. Tcl1 expression in chronic lymphocytic leukemia is regulated by miR-29 and miR-181[J]. Cancer Res,2006,66:11590-11593. |
| [9] | Naguibneva I, Ameyar-Zazoua M, Polesskaya A, Ait-Si-Ali S, Groisman R, Souidi M, et al. The microRNA miR-181 targets the homeobox protein Hox-A11 during mammalian myoblast differentiation[J]. Nat Cell Biol,2006,8:278-284. |
| [10] | Dahlhaus M, Schult C, Lange S, Freund M, Junghanss C. MicroRNA 181a influences the expression of HMGB1 and CD4 in acute leukemias[J]. Anticancer Res,2013,33:445-452. |
| [11] | Hernández-Maqueda J G, Luna-Ulloa L B, Santoyo-Ramos P, Casta?eda-Patlán M C, Robles-Flores M. Protein kinase C delta negatively modulates canonical Wnt pathway and cell proliferation in colon tumor cell lines[J]. PLoS One,2013,8:e58540. |
| [12] | Perletti G, Marras E, Osti D, Felici L, Zaro S, de Eguileor M. PKCdelta requires p53 for suppression of the transformed phenotype in human colon cancer cells[J]. J Cell Mol Med,2004,8:563-569. |
| [13] | Jackson D, Zheng Y, Lyo D, Shen Y, Nakayama K, Nakayama K I, et al. Suppression of cell migration by protein kinase Cdelta[J]. Oncogene,2005,24:3067-3072. |
| [14] | De Servi B, Hermani A, Medunjanin S, Mayer D. Impact of PKCdelta on estrogen receptor localization and activity in breast cancer cells[J]. Oncogene,2005,24:4946-4955. |
| [15] | Chen Y, Ke G, Han D, Liang S, Yang G, Wu X. MicroRNA-181a enhances the chemoresistance of human cervical squamous cell carcinoma to cisplatin by targeting PRKCD[J]. Exp Cell Res,2014,320:12-20. |
 2014, Vol. 35
2014, Vol. 35


