2. 武警浙江嘉兴医院神经内科, 嘉兴 314000;
3. 第三军医大学新桥医院神经外科, 重庆 400037
2. Department of Neurology, Jiaxing Hospital of Chinese Armed Police Forces, Jiaxing 314000, Zhejiang, China;
3. Department of Neurosurgery, Xinqiao Hospital, Third Military Medical University, Chongqing 400037, China
蛛网膜下隙出血(subarachnoid hemorrhage, SAH)后迟发性脑血管痉挛(delayed cerebral vasospasm, DCVS)可导致死残率增加,是导致患者预后不佳的重要原因[1],确切机制仍不清楚[2]。近年来研究发现,SAH后血管平滑肌细胞增殖在DCVS的发生中起了重要作用[3,4],我们前期研究发现SAH后基底动脉中NF-κB的表达变化与增殖细胞核抗原(PCNA)的表达具有一致性,可能参与了血管平滑肌细胞的增殖[5]。吡咯烷二硫代氨基甲酸盐(ammonium pyrrolidinedithiocorbamate, PDTC)作为NF-κB的特异性抑制剂,能够抑制NF-κB的活化,本研究采用PDTC干预枕大池2次注血模型,观察基底动脉PCNA表达变化并结合血管平滑肌厚度的变化,探讨NF-κB在SAH后脑血管平滑肌增殖中的可能作用。 1 材料和方法 1.1 主要试剂及实验动物
鼠抗PCNA单克隆抗体(美国Abcam公司),兔抗NF-κB p65多克隆抗体、羊抗兔二抗(北京博奥森生物技术有限公司),SABC免疫组化试剂盒(武汉博士德生物公司),蛋白质印迹试剂盒(碧云天生物技术公司)。雄性新西兰大白兔16只,购于第三军医大学实验动物中心,体质量2.0~2.4 kg。实验动物分组采用完全随机法,SAH组8只,PDTC组8只。 1.2 模型制备及基底动脉取材
将兔经耳缘静脉按照1 mL/kg注入3%戊巴比妥钠麻醉,用23号无菌穿刺针刺入枕大池,释放约1.5 mL脑脊液;抽取等量耳动脉血,非肝素化,1~3 min内缓慢注入枕大池。术后保持头低30°俯卧位30 min。48 h后同法进行2次注血。PDTC组动物自首次注入动脉血后,按照6 mg/kg注入PDTC,每日1次,直至2次注血后第6天。第7天取兔基底动脉标本。麻醉后自剑突下U形剪开胸壁,剪开心包, 自左心室穿入8号穿刺针至升主动脉内,同时剪开右心耳,快速灌注4℃生理盐水,至从右心耳流出液清亮后为止。自枕部咬开颅骨,完整剥离脑组织并避免损伤基底动脉,把整条基底动脉平均分为3段,所有动物均取基底动脉中部1/3,带背部脑干组织作为支撑,置于4%多聚甲醛中浸泡固定,石蜡包埋切片;剥离其余基底动脉放入冻存管,液氮保存,用于蛋白定量分析。 1.3 基底动脉H-E染色
基底动脉用4%多聚甲醛固定3 d后行石蜡包埋并切片,H-E染色, 显微镜取图后行血管平滑肌厚度测量(Leica Appliation Suite软件)。方法为每个血管断面分别以管腔中点为中心取垂直的4个象限,从血管内弹力膜外侧至平滑肌层的最外侧测量取值,然后再以这4个象限测量结果的平均值作为每个标本基底动脉平滑肌厚度。 1.4 免疫组化检测
免疫组化染色按照SABC试剂盒说明进行。切片脱蜡、热修复后分别加入鼠抗PCNA单克隆抗体(1∶100)和抗NF-κB p65多抗(1∶100),4℃冰箱中过夜。PBS 摇洗后滴加生物素化二抗。37℃孵箱中孵育1 h,加入SABC三抗,DAB显色,苏木精染核,中性树胶封片。每只兔的基底动脉切片断面选取3张,计算每张切片上所有血管平滑肌细胞总数和阳性细胞数,计算阳性细胞数占所有平滑肌细胞数的比例。 1.5 蛋白质印迹检测
用剪刀剪取约50 mg组织,加入1 mL RIPA进行匀浆,然后冰上静置20 min,将匀浆液吸出放到1.5 mL离心管中, 4℃、12 000×g离心10 min,吸取上清液进行蛋白印迹分析。组织总蛋白经凝胶电泳后转移至硝酸纤维素膜上,脱脂奶粉封闭1 h,加入稀释的NF-κB p65抗体(1∶200)、PCNA抗体(1∶200)和β-actin抗体(1∶2 000)37℃孵育1 h,加二抗IgG,37℃孵育1 h后加入发光剂,测其积分光密度(IOD)值。NF-κB p65、PCNA蛋白表达以其与β-actin的相对IOD比值表示。 1.6 统计学处理
采用SPSS11.5统计软件,计量资料用x±s表示,组间比较采用方差分析。检验水准(α)为0.05。 2 结 果 2.1 基底动脉平滑肌厚度测量
基底动脉血管横切面常规H-E染色(图1)显示: SAH组血管平滑肌层厚度为(37.1±6.7) μm;PDTC干预后,血管平滑肌层厚度(24.4±4.2) μm,平滑肌增厚改善,与SAH组比较差异有统计学意义(P<0.05)。
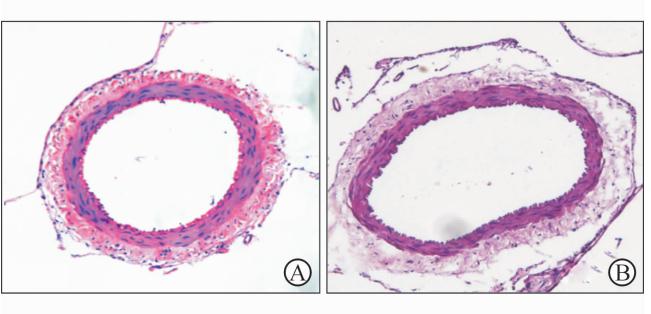 | 图1 SAH组(A)和PDTC组(B)基底动脉平滑肌厚度比较 Fig.1 Comparison of basilar artery smooth muscle thickness between SAH(A) and PDTC(B) groups (H-E staining)SAH: Subarachnoid hemorrhage; PDTC: Ammonium pyrrolidinedithiocarbamate. Original magnification: ×200 |
免疫组化结果(图2)显示,SAH组兔基底动脉NF-κB p65表达强烈,主要存在于内皮细胞、平滑肌细胞的胞质和胞核,镜下观察为条状或点片状黄褐色。PCNA表达为细胞核呈棕黄色染色。PDTC干预后,NF-κB p65在兔基动脉平滑肌中表达减弱,PCNA阳性细胞计数亦相应减少,NF-κB p65、PCNA阳性率明显低于SAH组,2组比较差异有统计学意义(P<0.05)。
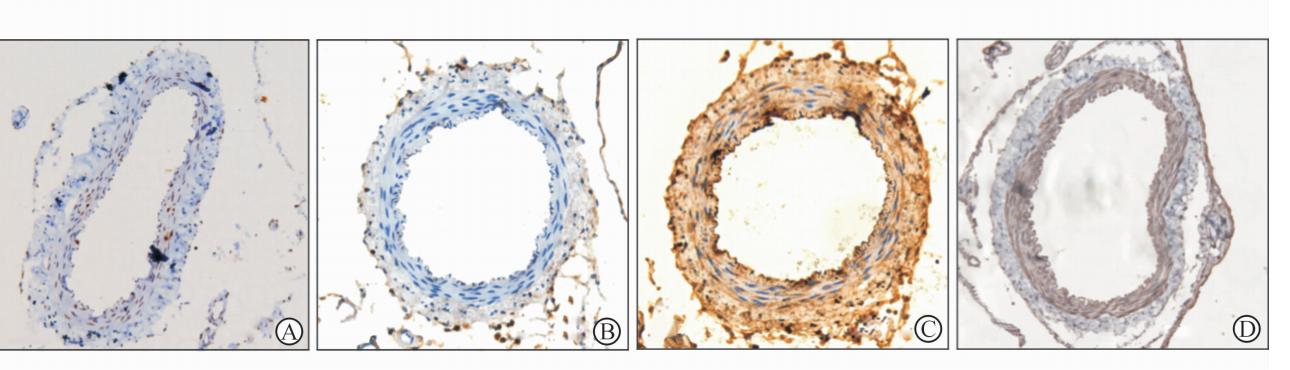 | 图2 SAH组和PDTC组兔基底动脉PCNA、 NF-κB p65的表达 Fig.2 NF-κB p65 and PCNA positive cells in SAH and PDTC groups by immunohistochemistry stainingA,B: PCNA positive cells by immunohistochemistry staining in SAH(A) and PDTC(B) groups. C,D: NF-κB p65 positive cells by immunohistochemistry staining in SAH(C) and PDTC(D) groups. SAH: Subarachnoid hemorrhage; PDTC: Ammonium pyrrolidinedithiocarbamate; PCNA: proliferating cell nuclear antigen. Original magnification: ×200. |
蛋白质印迹结果(图3)显示:PDTC抑制NF-κB p65活化后,基底动脉的NF-κB蛋白表达显著降低,PCNA蛋白表达亦相应减少,与SAH组比较差异具有统计学意义(P<0.05)。
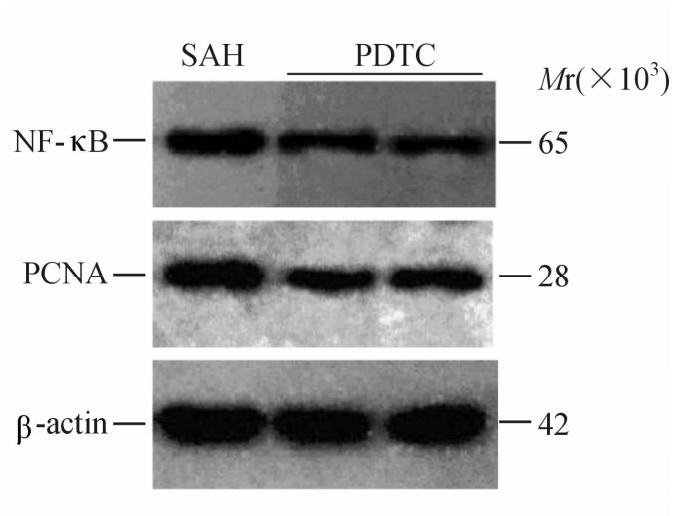 | 图3 基底动脉NF-κB p65、PCNA蛋白表达 Fig.3 Basilar artery NF-κB p65 and PCNA protein expression detected by Western blotting analysisSAH: Subarachnoid hemorrhage; PDTC: Ammonium pyrrolidinedithiocarbamate; PCNA: Proliferating cell nuclear antigen |
SAH后DCVS发生机制尚不清楚,临床上应用各种药物预防和治疗DCVS均不可能使痉挛的血管完全舒张,DCVS的发生不仅是痉挛动脉的持续收缩,也伴随血管壁的结构性改变[6],但引起血管壁重构的具体机制仍未阐明。近期研究发现,DCVS的发生与血管壁细胞的增殖关系密切,细胞的增殖性改变可能是导致血管腔狭窄的重要原因[7]。2003年Borel等[8]发现血凝块所在部位的脑血管有平滑肌细胞和成纤维细胞的增殖,并用血清刺激体外培养的人软脑膜血管7 d,发现血管外膜及平滑肌出现明显增殖性改变,并认为是细胞的增殖和管壁增厚导致了DCVS。我们前期的实验中发现NF-κB在SAH后对平滑肌细胞的异常增殖起着关键性作用[5]。本研究进一步发现:应用NF-κB抑制剂PDTC能抑制SAH后基底动脉平滑肌细胞增殖,使血管壁平滑肌增厚减轻,管腔狭窄改善。
我们实验结果发现,应用抑制剂PDTC后,基底动脉NF-κB蛋白表达受到抑制,同时H-E染色发现,动脉壁痉挛程度减轻,内皮细胞相对完整,内弹力膜皱褶程度轻,中层平滑肌增厚改善。我们同时用PCNA表达量的变化来评价细胞增殖状态,实验结果提示,PDTC在抑制基底动脉NF-κB激活的同时,显著下调基底动脉平滑肌细胞PCNA蛋白表达,与SAH组相比差异有统计学意义。因此我们认为,PDTC对SAH后脑血管平滑肌细胞增殖性改变起到一定的防治作用,同时也说明,NF-κB的表达增强在SAH后脑血管平滑肌细胞增殖中起到非常重要的作用,通过抑制NF-κB表达能够达到抑制血管平滑肌细胞增殖的目的。
PDTC是一种低分子质量的硫醇螯合物,具有很强的重金属螯合功能和抗氧化功能[9]。近年来,有文献报道应用PDTC来治疗肺损伤等疾病的实验研究[10],也有实验研究证实PDTC能够阻断NF-κB激活的信号通路,通过抑制NF-κB活化和炎性细胞因子的表达来治疗神经系统疾病[11]。目前认为PDTC的作用机制主要是:(1)通过直接清除活性氧中间产物,螯合金属离子发挥作用;(2)通过阻止NF-κB的抑制性亚单位I κB的降解发挥作用[12];(3)通过阻碍NF-κB的p65、p50亚基向细胞核转移,从而发挥其抑制作用[13]。
本实验结果表明应用PDTC干预后,基底动脉平滑肌细胞NF-κB阳性细胞数及蛋白表达明显减少, PCNA表达也相应下调,由此推测,PDTC通过抑制NF-κB的活化从而减轻脑血管平滑肌增殖反应而改善SAH后脑血管重构,进而减轻DCVS的发生,为SAH后DCVS的防治奠定了基础。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Al-Tamimi Y Z,Orsi N M,Quinn A C,Homer-Vanniasinkam S,Ross S A.A review of delayed ischemic neurologic deficit following aneurysmal subarachnoid hemorrhage: historical overview,current treatment,and pathophysiology[J].World Neurosurg,2010,73:654-667. |
| [2] | Kolias A G,Sen J,Belli A.Pathogenesis of cerebral vasospasm following aneurysmal subarachnoid hemorrhage:putative mechanisms and novel approaches[J].J Neurosci Res,2009,87:1-11. |
| [3] | Song J N,An J Y,Hao G S,Li D D,Sun P,Li Y,et al.Role of Akt signaling pathway in delayed cerebral vasospasm after subarachnoid hemorrhage in rats[J].Acta Neurochir (Wien),2013,155:2063-2070. |
| [4] | Luo C,Yi B,Chen Z,Tang W,Chen Y,Hu R,et al.PKGIalpha inhibits the proliferation of cerebral arterial smooth muscle cell induced by oxyhemoglobin after subarachnoid hemorrhage[J].Acta Neurochir Suppl,2011,110:167-171. |
| [5] | 张建忠,周政,刘俊,杨辉,张旋,冯宝海.NF-κB在兔蛛网膜下隙出血模型基底动脉中的表达及其与血管平滑肌增殖的关系[J].第三军医大学学报,2010,32:1976-1980. |
| [6] | Chen D,Chen J J,Yin Q,Guan J H,Liu Y H.Role of ERK1/2 and vascular cell proliferation in cerebral vasospasm after experimental subarachnoid hemorrhage[J].Acta Neurochir (Wien),2009,151:1127-1134. |
| [7] | Zhang W,Khatibi N H,Yamaguchi-Okada M,Yan J,Chen C,Hu Q,et al.Mammalian target of rapamycin (mTOR) inhibition reduces cerebral vasospasm following a subarachnoid hemorrhage injury in canines[J].Exp Neurol,2012,233:799-806. |
| [8] | Borel C O,McKee A,Parra A,Haglund M M,Solan A,Prabhakar V,et al.Possible role for vascular cell proliferation in cerebral vasospasm after subarachnoid hemorrhage[J].Stroke,2003,34:427-433. |
| [9] | Chen Y W,Chen K L ,Chen C H,Wu H C,Su C C,Wu C C,et al.Pyrrolidine dithiocarbamate (PDTC)/Cu complex induces lung epithelial cell apoptosis through mitochondria and ER-stress pathways[J].Toxicol Lett,2010,199:333-340. |
| [10] | Chang X,Shao C,Wu Q,Huang M,Zhou Z.Pyrrolidine dithiocarbamate attenuates paraquat-induced lung injury in rats[J].J Biomed Biotechnol,2009,2009:619487. |
| [11] | Yang R H,Strong J A,Zhang J M.NF-kappaB mediated enhancement of potassium currents by the chemokine CXCL1/growth related oncogene in small diameter rat sensory neurons[J].Mol Pain,2009,5:26. |
| [12] | Zhang J J,Xu Z M,Zhang C M,Dai H Y,Ji X Q,Wang X F,et al.Pyrrolidine dithiocarbamate inhibits nuclear factor-kappaB pathway activation,and regulates adhesion,migration,invasion and apoptosis of endometriotic stromal cells[J].Mol Hum Reprod,2011,17:175-181. |
| [13] | Jiang M Z,Tsukahara H,Ohshima Y,Todoroki Y,Hiraoka M,Maeda M,et al.Effects of antioxidants and nitric oxide on TNF-alpha-induced adhesion molecule expression and NF-kappaB activation in human dermal microvascular endothelial cells[J].Life Sci,2004,75:1159-1170. |
 2014, Vol. 35
2014, Vol. 35


