慢性环孢素A(CsA) 肾毒性以肾小管间质损伤为特征,表现为炎症和带状纤维化,其分子发病机制与炎性介质[ 1 ] 、肾素血管紧张素系统 (RAS)[ 2 ] 、转化生长因子β1[ 3 ]、细胞凋亡[ 4 ]等有关。其中,炎性介质扮演着重要的角色,因为肾小管间质炎症的发生先于纤维化的形成。炎性介质促使大量炎性细胞在肾小管间质聚集,后者反过来分泌炎性介质,形成恶性循环,最终导致肾小管间质纤维化。
骨桥蛋白(osteopontin,OPN)是一种巨噬细胞趋化和黏附分子,参与各种肾脏疾病的发生发展[ 1, 3 ]。在慢性 CsA 肾毒性中,我们曾报道过增加的OPN表达与肾小管间质炎症和带状纤维化紧密相关[ 1 ]。然而,目前还不清楚OPN通过何种途径引起肾脏损伤。本研究以慢性CsA肾毒性大鼠为动物模型,观察OPN参与肾小管间质炎症和带状纤维化是否与核转录因子有关。
1 材料和方法 1.1 主要材料及分组
雄性Sprague-Dawley 大鼠(Charles River Technology,Korea,CUMC-2010-0148-02)16只,体质量200~220 g。喂饲低盐饲料(0.05% 钠盐,Teklad Premier,Madison,WI,USA)下,随机分为两组:对照组 (VH,n=8):皮下注射橄榄油 (1 mL· kg-1·d-1,Sigma,USA);毒性组 (CsA,n=8):皮下注射 CsA (15 mg· kg-1· d-1,Novartis Pharma,Basel,Swiss)。两组大鼠治疗4周后处死,留取肾组织标本。
1.2 肾脏病理观察用过碘酸-赖氨酸-多聚甲醛液(periodate-lysine-paraformaldehyde)固定肾组织,石蜡包埋后切片(厚4 μm)。脱蜡后行Masson三色(Masson trichrome)染色,观察肾小管间质纤维化(TIF)。利用数字化显微镜分析仪(TDI Scope EyeTM Version3.0 for Windows,Olympus,Japan)定量评估肾小管间质纤维化(tubulointerstitial fibrosis,TIF)程度;在100倍显微镜下,每张切片上至少观察非重叠的20个不同区域,获取图像,利用 Polygon Program定量计算肾小管间质受损部位的百分比(单位为%/0.5 mm2)。由2个观察者对每个样本随机进行盲法评分,取平均值。
1.3 免疫组织化学染色测ED-1阳性细胞数石蜡包埋切片置二甲苯脱蜡和梯度乙醇中脱水,室温下(37℃)用0.3%过氧化氢/甲醛处理30 min 后,PBS液洗3次。置微波炉中加热行波炉抗原修复(98℃ 5 min),PBS液洗3次。室温下滴加非免疫性血清封闭液,20 min后PBS液洗3次。在4℃下滴加ED-1一抗 (Serotec Inc.,UK)孵育12~16 h。PBS液洗3次后滴加二抗,室温孵育2 h。以DAB为底物显色,呈棕黄色为止(具体调节时间)。用自来水流水洗涤,苏木精复染,常规树脂封片。在200倍显微镜下,利用数字化显微镜分析仪计数,每张切片至少观察非重叠的20个不同区域,利用 Polygon Program对ED-1阳性细胞计数,取平均值。
1.4 蛋白质印迹法测IκB抗体表达水平提取的肾组织用蛋白质溶解缓冲液 (10 mmol/L Tris-Cl,pH 7.6; 150 mmol/L NaCl; 1% 脱氧胆酸钠; 1% Triton X-100; 0.1% 十二烷基硫酸钠; 1% 抑肽酶; 2 mmol/L Na3VO4; 1 μg/mL 亮抑酶肽; 1 mmol/L 苯甲基磺酰氟) 制成匀浆; 4℃下离心(1 500 r/min,离心半径8.84 cm) 后,取上清液测定蛋白浓度 (Bio-Rad,Hercules); 20 μg 标本在十二烷基磺酸钠-聚丙烯酰胺凝胶电泳; 电转膜 (90 V) 2 h后,4℃下 置IκB抗体(Cell Signaling Technology,Inc,USA)于非脂牛乳中以1∶1 000 浓度孵育12~16 h; 室温下缓冲液液洗3次,加辣根过氧化物酶标记的驴抗兔IgG (Amersham) 1 h; 室温下缓冲液液洗3次,增强发光 (ECLTM,Amersham) 和曝光。以actin为参照进行条带分析。
1.5 RNA印迹法检测 OPN mRNA表达水平按 RNAzolBTM(Tel Test,USA)试剂盒说明书提取肾皮质总 RNA。1.2% 甲醛变性琼脂糖凝胶电泳,每泳道上样20 μg,24 h 虹吸转膜,紫外交联。68℃(OPN)或 42℃ (GAPDH)下,用 DIG 标记的OPN cRNA (或32P标记的 GAPDH cDNA) 杂交12~16 h。洗膜后显影。以GAPDH 为参照进行灰度分析。 1.6 凝胶电泳迁移率实验 (EMSA)测定NF-κB和AP-1结合活性
双链寡核苷酸排列顺序NF-κB:5′-AGT TGA GGG GAC TTT CCC AGG C-3′;AP-1:5′-CGC TTG ATG ACT CAG CCG GAA-3′ (Promega,Madison,WI,USA)。具体步骤如下:利用Bradford法(Bio-Rad,Hercules,CA)测定核胞质抽提液蛋白,常温下,含蛋白结合序列的NF-κB或AP-1寡核苷酸片段用Y-32P和T4多核苷酸激酶(Roche,Mannheim,Germany)来作核素标记30 min,用Chroma spin STE-10 column (Clontech Laboratories,Palo Alto,CA,USA)去除非结合标记物。20 μg含50 mol/L Tris (pH 7.5),250 mol/L NaCl,2.5 mol/L EDTA,20%甘油,2.5 mol/L DTT,5 mol/L MgCl2,5 μg 核蛋白抽提液,1 μg 32P标记的寡核苷酸,50 μg/mL poly(dI-dC)内容物常温下完成结合反应。为了完成supershift试验,结合反应前核蛋白抽提液与指定的抗体孵育30 min。DNA蛋白复合物在1倍Tris-硼酸-EDTA 6%聚丙烯酰胺凝胶上电泳分离,凝胶干燥并放射自显影。
1.7 统计学处理计量资料数据以x±s表示,两组间均数比较采用t检验。运用Pearson直线相关系数(single-correlation coefficient)分析比较OPN mRNA与TIF程度和核转录因子NF-κB、AP-1结合活性间的相关关系。 2 结 果 2.1 慢性CsA肾毒性肾脏病理
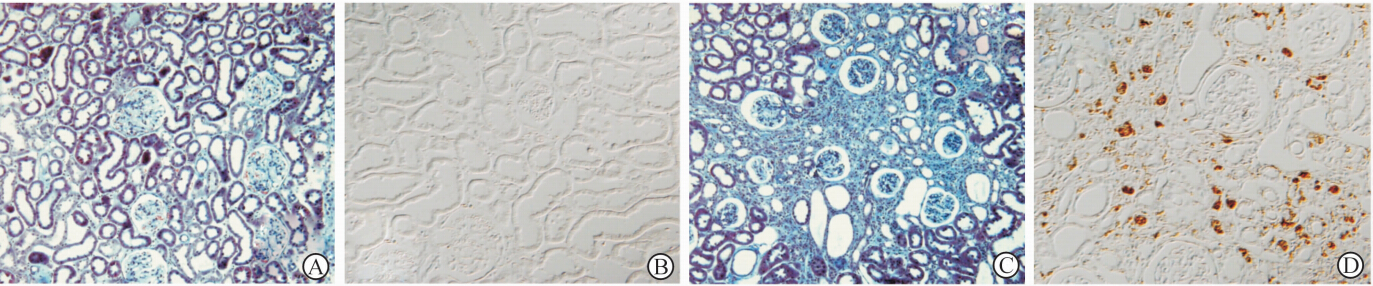
与VH组相比,CsA组肾脏表现为肾小管间质带状纤维化[(38.9±3.3)%/0.5 mm2 vs (0±0)%/0.5 mm2,P<0.01]和大量ED-1炎性细胞浸润 [(89±9) vs (7±2),P<0.01],见图 1。
|
图 1 两组间肾小管间质纤维化程度(A,C)和ED-1阳性细胞数(B,D) Fig 1 Tubulointerstitial fibrosis degrees (A and C,trichrome staining) and ED-1 positive cells (B and D,immunohistochemistry) in two groups A,B: Vehicle; C,D: CsA. Original magnification: ×100(A,C); ×200(B,D) |
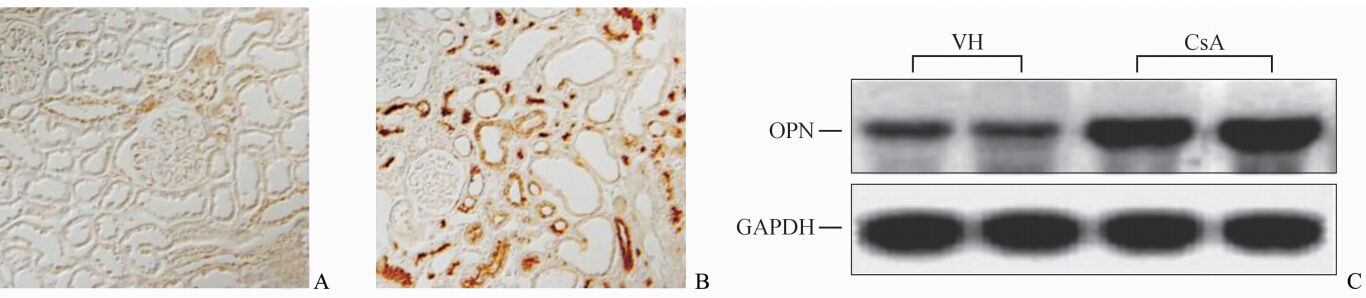
在VH组中,几乎观察不到OPN蛋白的表达(图 2A)。毒性组OPN蛋白的表达增加,尤其是在肾小管间质纤维化部位(图 2B)。Northern印迹表明,CsA组OPN mRNA的表达较VH组增加7倍之多[(729±37)% vs (103±4)%,P<0.01]。
|
图 2 两组间OPN mRNA 和蛋白的表达 Fig 2 Expression of OPN protein and mRNA in the two groups OPN: Osteopontin. A,B: Immunohistochemical staining. A: Vehicle (VH); B: CsA; C: Northern blotting. Original magnification:×200(A,B) |
结果(图3)显示,与VH组相比,NF抑制蛋白IκB 蛋白的表达减少 [(9±7)% vs (105±7)%,P<0.01],见图4。CsA组 NF-κB和AP-1结合活性增加 [NF-κB: (218±19)% vs (116±15)%; AP-1: (735±225)% vs (101±4)%,P<0.01]。
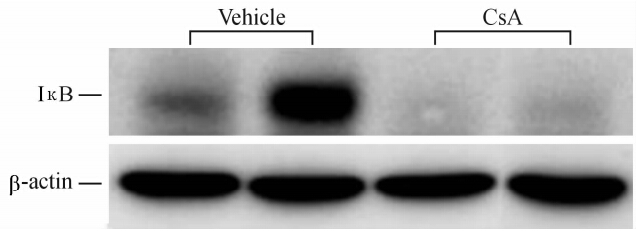 | 图 3 免疫印迹法检测两组间IκB蛋白表达Fig 3 Immunoblotting of IκB proteinexpression in the two groups |
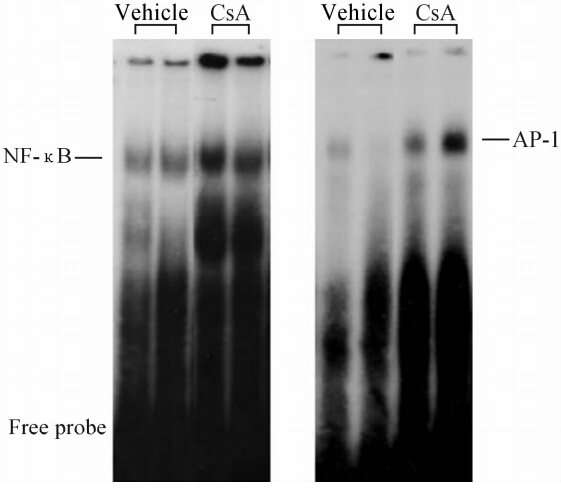 | 图 4 两组间NF-κB和AP-1结合活性(EMSA法) Fig 4 Activities of NF-κB and AP-1 in the two groups(EMSA) |
直线相关分析表明,OPN mRNA 的表达分别与TIF程度(r=0.959,P<0.001)和核转录因子结合活性正相关 (NF-κB: r=0.773,P<0.01; AP-1:r=0.619,P=0.01),见图5。
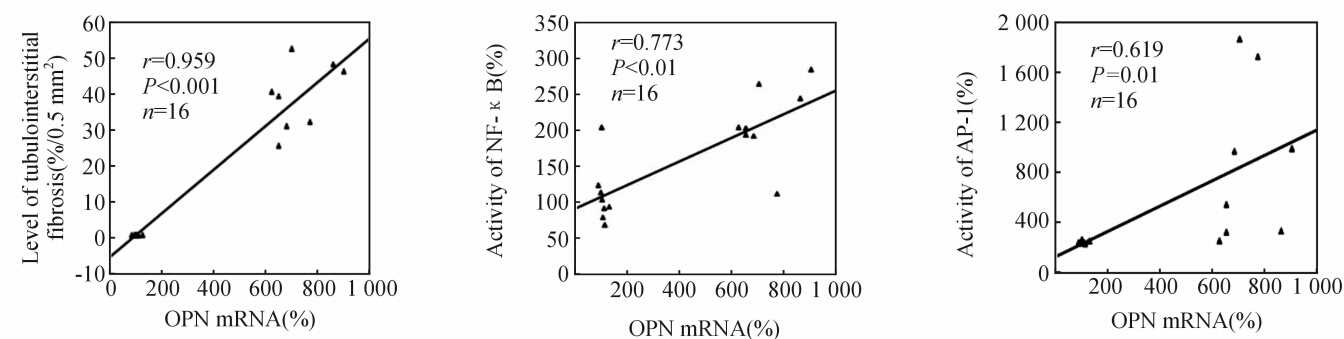 | 图5 OPN mRNA表达与肾小管间质纤维化程度和核转录因子间相关性分析Fig 5 Correlation analysis of OPN mRNA expression with tubulointerstitial fibrosis and nuclear transcription factor OPN: Osteopontin |
几乎所有的肾脏疾病由炎症反应所启动和调控包括慢性CsA肾毒性。炎症趋化因子促使大量单核细胞和巨噬细胞在肾小球、肾小管间质聚集,炎性细胞反过来又分泌炎性介质,形成恶性循环,最终导致肾小球硬化和肾小管间质纤维化。本研究利用慢性CsA肾毒性大鼠模型,观察炎症趋化因子OPN引起肾小管损伤是否与核转录因子有关。结果表明,OPN mRNA 和蛋白在肾小管上皮细胞中高表达,且与肾小管间质纤维化程度和核转录因子NF-κB和AP-1活性紧密相关。以上结果证实OPN与核转录因子NF-κB和AP-1 参与了慢性CsA肾毒性的发病。
在肾脏损伤发生发展中,OPN具有多种多样的功能,包括抑制诱生型一氧化氮合酶[ 5 ]、防止细胞凋亡[ 6 ]、加速细胞从缺血再灌注中增殖和再生[ 7 ]、作为炎症趋化因子促使单核细胞和巨噬细胞聚集[ 8,9 ]等,这些多种多样的功能是由不同的OPN受体介导完成[ 10 ]。最近研究表明,OPN的表达在血管紧张素Ⅱ介导的肾损伤模型[ 11 ]、肾小球肾炎[ 12 ]、5/6肾大部切除模型[ 8 ]、糖尿病肾病[ 9 ]中高表达,且与炎性细胞 侵袭和肾脏硬化紧密相关,说明OPN参与了多种肾脏疾病的发生发展。本实验采用免疫组化和RNA印迹法检测OPN的表达,结果显示毒性组肾OPN的表达较正常组增加近7倍之多,有趣的是其主要分布于受损的或严重纤维化的肾小管间质区域。直线相关分析提示OPN mRNA的表达与肾小管间质纤维化正相关(r=0.959,P<0.001)。本研究结果与我们以往的报道[ 1,3 ]一致,表明OPN作为炎症趋化因子参与了慢性CsA肾毒性的肾小管间质损伤。
核转录因子NF-κB和AP-1被细胞因子、促丝裂因子、病毒、机械性因素、氧化应激、各种化学制剂等生理性和非生理性刺激所激活[ 13,14 ]。Asai 等[ 15 ]和 Tamada等[ 16 ]报道钙调磷酸酶抑制剂CsA和FK506均可诱导NF-κB和AP-1活性,而且激活的NF-κB和AP-1参与慢性CsA或FK506所致的肾毒性。类似地,NF-κB和AP-1的致病作用在缺血再灌注[ 17 ]、以蛋白尿为主的肾病[ 18 ]、糖尿病肾病[ 19 ]中相继得到证实。反之,CsA或FK506抑制NF-κB活性。曹晓伟等[ 20 ]利用体外培养的人肝癌细胞株SMMC-7721发现FK506可抑制NF-κB活性,下调cyclin D1基因的表达,导致SMMC-7721细胞凋亡。为什么钙调磷酸酶抑制剂对核转录因子具有相反的作用至今还不清楚,可能是由于在特定的病理生理条件下或不同的疾病决定钙调磷酸酶抑制剂对核转录因子发挥相反的生物学效应。从本实验结果我们发现,CsA明显增加NF-κB和AP-1蛋白结合活性,相反,其抑制蛋白IκB的表达却明显减少。因此,我们推测CsA激活NF-κB和AP-1,而NF-κB和AP-1反过来参与慢性CsA肾毒性的发生发展。
核转录因子NF-κB和AP-1参与慢性CsA肾毒性的发病机制还不十分清楚,可能是与转录各种细胞因子和炎性介质包括OPN的表达有关。但是,关于OPN和核转录因子间是否存在因果关系尚无报道。Philip 等[ 21 ]报道过OPN可通过磷酸化和激活IκB激酶从而降解IκB途径直接激活NF-κB。体内试验也表明,NF-κB和AP-1通过作用于OPN和单核细胞趋化蛋白-1导致慢性FK506肾毒性[ 16 ]和膜性肾病[ 18 ]。另外,OPN通过AP-1激活途径转录,因为AP-1与Ets转录因子互相影响、互相作用,最终作用于其共同靶基因OPN[ 22 ]。在本实验中,我们运用Pearson直线相关分析发现OPN mRNA表达与核转录因子NF-κB和AP-1结合活性紧密相关(r=0.773,P<0.01;r=0.619,P=0.01)。综合以上结果,我们认为核转录因子NF-κB和AP-1作用于其靶基因OPN的表达,从而在慢性CsA 肾毒性的发生、发展中起到重要作用。
综上所述,长期使用 CsA 激活核转录因子NF-κB和AP-1活性、上调OPN表达从而参与慢性CsA肾毒性肾小管间质损伤过程。本研究为临床进一步认知慢性CsA肾毒性发病提供了分子理论基础。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Li C,Yang C W,Kim W Y,Jung J Y,Cha J H,Kim Y S,et al. Reversibility of chronic cyclosporine nephropathy in rats after withdrawal of cyclosporine[J].Am J Physiol Renal Physiol,2003,284:F389-F398. |
| [2] | 金英顺,洪英礼,崔镇花,刘雨田,金海峰,金华,等.血管紧张素 Ⅱ 及其受体在慢性环孢素 A 肾毒性大鼠肾组织中的表达[J].第二军医大学学报,2010,31:1286-1290. Jin Y S,Hong Y L,Cui Z H,Liu Y T,Jin H F,Jin H,et al.Expression of angiotensin Ⅱ and its receptors in a rat model of chronic cyclosporine nephrotoxicity[J].Acad J Sec Mil Med Univ,2010,31:1286-1290. |
| [3] | Li C,Yang C W,Park J H,Lim S W,Sun B K,Jung J Y,et al.Pravastatin treatment attenuates interstitial inflammation and fibrosis in a rat model of chronic cyclosporine-induced nephropathy[J].Am J Physiol Renal Physiol,2004,286:F46-F57. |
| [4] | 雷东明,邹洪斌,高弼虎,金英顺,刘金莲,罗康,等.促红细胞生成素及其受体在慢性环孢素A肾毒性大鼠肾组织中的表达[J].第二军医大学学报,2013,34:823-827. Lei D M,Zou H B,Gao B H,Jin Y S,Liu J L,Luo K,et al.Expression of erythropoietin and its receptors in renal tissues of rats with chronic cyclosporine A nephrotoxicity[J].Acad J Sec Mil Med Univ,2013,34:823-827. |
| [5] | Zhang X F,Liu S,Zhou Y J,Zhu G F,Foda H D.Osteopontin protects against hyperoxia-induced lung injury by inhibiting nitric oxide synthases[J].Chin Med J (Engl),2010,123:929-935. |
| [6] | Matu an-Ilija K,Damante G,Fabbro D,Dor evic'G,Hadisejdic'I,Grahovac M,et al.Osteopontin expression correlates with nuclear factor-κB activation and apoptosis downregulation in clear cell renal cell carcinoma[J].Pathol Res Pract,2011,207:104-110. |
| [7] | Xie Y,Nishi S,Iguchi S,Imai N,Sakatsume M,Saito A,et al.Expression of osteopontin in gentamicin-induced acute tubular necrosis and its recovery process[J].Kidney Int 2001,59:959-974. |
| [8] | Yu X Q,Wu L L,Huang X R,Yang N,Gilbert R E,Cooper M E,et al.Osteopontin expression in progressive renal injury in remnant kidney:role of angiotensinⅡ[J].Kidney Int,2000,58:1469-1480. |
| [9] | Ma R,Liu L,Liu X,Wang Y,Jiang W,Xu L.Triptolide markedly attenuates albuminuria and podocyte injury in an animal model of diabetic nephropathy[J].Exp Ther Med,2013,6:649-656. |
| [10] | Weber C E,Li N Y,Wai P Y,Kuo P C.Epithelial-mesenchymal transition,TGF-β,and osteopontin in wound healing and tissue remodeling after injury[J].J Burn Care Res,2012,33:311-318. |
| [11] | Giachelli C M,Pichler R,Lombardi D,Denhardt D T,Alpers C E,Schwartz S M,et al.Osteopontin expression in angiotensin Ⅱ-induced tubulointerstitial nephritis[J].Kidney Int,1994,45:515-524. |
| [12] | Zhou C,Wu J,Torres L,Hicks J M,Bartkowiak T,Parker K,et al.Osteopontin overproduction is associated with progression of glomerular fibrosis in a rat model of anti-glomerular basement membrane glomerulonephritis[J].Am J Nephrol,2010,32:262-271. |
| [13] | Barnes P J,Karin M.Nuclear factor-kappaB:a pivotal transcription factor in chronic inflammatory diseases[J].N Engl J Med,1997,336:1066-1071. |
| [14] | Karin M,Liu Z,Zandi E.AP-1 function and regulation[J].Curr Opin Cell Biol,1997,9:240-246. |
| [15] | Asai T,Nakatani T,Tamada S,Kuwabara N,Yamanaka S,Tashiro K et al.Activation of transcription factors AP-1 and NF-kappaB in chronic cyclosporine A nephrotoxicity:role in beneficial effects of magnesium supplementation[J].Transplantation,2003,75:1040-1044. |
| [16] | Tamada S,Nakatani T,Asai T,Tashiro K,Komiya T,Sumi T,et al.Inhibition of nuclear factor-kappaB activation by pyrrolidine dithiocarbamate prevents chronic FK506 nephropathy[J].Kidney Int,2003,63:306-314. |
| [17] | Hu L,Yang C,Zhao T,Xu M,Tang Q,Yang B,et al.Erythropoietin ameliorates renal ischemia and reperfusion injury via inhibiting tubulointerstitial inflammation[J].J Surg Res,2012,176:260-266. |
| [18] | Mezzano S A,Barria M,Droguett M A,Burgos M E,Ardiles L G,Flores C,et al.Tubular NF-kappaB and AP-1 activation in human proteinuric renal disease[J].Kidney Int,2001,60:1366-1377. |
| [19] | Gui D,Huang J,Guo Y,Chen J,Chen Y,Xiao W,et al.Astragaloside Ⅳ ameliorates renal injury in streptozotocin-induced diabetic rats through inhibiting NF-κB-mediated inflammatory genes expression[J].Cytokine,2013,61:970-977. |
| [20] | 曹晓伟,傅志仁,唱浩,丁国善.他克莫司对5-氟尿嘧啶诱导肝癌细胞凋亡的影响及其机制的初步探讨[J].第二军医大学学报,2005,26:663-666. Cao X W,Fu Z R,Cang H,Ding G S.Influence of tacrolimus on fluorouracil-induced apoptosis of the hepatocellular carcinoma[J].Acad J Sec Mil Med Univ,2005,26:663-666. |
| [21] | Philip S,Kundu G C.Osteopontin induces nuclear factor kappa B-mediated promatrix metalloproteinase-2 activation through I kappa B alpha/IKK signaling pathways,and curcumin (diferulolylmethane) down-regulates these pathways[J].J Biol Chem,2003,278:14487-14497. |
| [22] | Vary C P,Li V,Raouf A,Kitching R,Kola I,Franceschi C,et al.Involvement of Ets transcription factors and targets in osteoblast differentiation and matrix mineralization[J].Exp Cell Res,2000,257:213-222. |
 2014, Vol. 35
2014, Vol. 35


