2. 上海中医药大学附属上海市中医医院妇科, 上海 200071
2. Department of Gynecology, Shanghai Municipal Hospital of Traditional Chinese Medicine, Shanghai University of Traditional Chinese Medicine, Shanghai 200071, China
卵巢癌是严重影响女性健康的生殖道恶性肿瘤。高促性腺激素理论认为绝经后高水平的促卵泡激素(follicle stimulating hormone,FSH)是卵巢癌发生的高危因素,因此研究了解FSH作用的分子生物学机制对卵巢癌的治疗具有重要的指导意义。桥粒胶蛋白-3(desmocollin 3,Dsc3)属于钙粘素超家族,是细胞桥粒的重要组成部分[ 1 ]。近年研究表明,Dsc3在某些肿瘤发生发展中起到一定作用[ 2,3,4,5,6 ],但在卵巢癌中的表达情况尚未见报道。有文献报道Dsc3同家族分子Dsc2的缺失能够促进结肠上皮细胞的体外增殖,并且通过激活表皮生长因子受体(EGFR)/丝氨酸/苏氨酸蛋白激酶(Akt)信号通路(EGFR/Akt信号通路)促进肿瘤体外生长[ 7 ]。本研究旨在探究Dsc3在卵巢癌中的表达情况,以及Dsc3是否也通过EGFR/Akt信号通路促进FSH调控的卵巢癌细胞增殖活性,进而促进肿瘤的发生发展。
1 材料和方法 1.1 标本来源收集2007—2011年上海市第一人民医院病理科72例患者的石蜡卵巢组织切片标本,其中31例为卵巢恶性上皮性肿瘤,22例为卵巢交界性上皮性肿瘤,另19例为良性上皮性肿瘤,所有病例均有完整的临床病理资料。全部病变组织标本均经2位有经验的病理医师盲法确定病理诊断及分级,所有患者术前均签署了实验研究知情同意书。
1.2 细胞株 上皮性卵巢癌细胞株Hey、HO8910、ES-2、Skov3、Skov3ip,卵巢交界性囊腺瘤细胞株MCV152、卵巢永生化上皮细胞株Moody由上海市第一人民医院妇产科丰有吉教授课题组保存。 1.3 主要试剂及材料正常羊血清购自上海太阳生物技术有限公司; SS LABEL Polymer-HRP购自BioGenex公司;DAB试剂盒购自上海长岛生物科技有限公司; MCDB109/M199培养基、DMEM-F12培养基、胎牛血清购自Hyclone公司;FSH、四甲基偶氮唑盐(MTT)、二甲亚砜(DMSO)均购自Sigma公司;免疫组化试剂盒自Santa Cruz公司;Dsc3多克隆抗体(鼠抗人)、Dsc3单克隆抗体(兔抗人)、EGFR单克隆抗体(兔抗人)、Akt单克隆抗体(兔抗人)分别购自eBioscience、Abcam、Epitomics、R&D公司,pAkt单克隆抗体(兔抗人)、GAPDH单克隆抗体(兔抗人)购自Cell signaling公司;lipofecetamine 2000购自Invitrogen公司;siRNA由上海吉玛制药技术有限公司合成;ECL (electrochemiluminescence,一般用于蛋白质印迹分析)发光剂购自PerkinElmer公司。
1.4 免疫组织化学检测
应用免疫组织化学S-P法染色检测Dsc3蛋白的表达。常规脱蜡,抗原修复采用高温加热法:切片浸入柠檬酸钠缓冲液(pH 6.0)中,高压锅煮沸15 min,室温下自然冷却,正常山羊血清封闭,一抗孵育过夜后二抗孵育,显微镜下DAB显色5~10 min,苏木精复染2 min,盐酸乙醇分化后脱水、封片。 Dsc3鼠抗人多克隆抗体按1∶10稀释。实验步骤严格按照免疫组化试剂说明进行操作。每张切片随机计数5个视野,以淡黄色至棕黄色或棕褐色着色的卵巢上皮细胞作为阳性细胞,参照Remmele等[ 8 ]的评分方法,根据阳性细胞染色百分比及着色深浅评分:(1)阳性细胞染色百分比≤30%为 1分,30%~70%为2分,>70%为3分;(2)无染色为0分,淡黄色为1分,棕黄色至棕褐色为2分。标本最后评分(1)×(2),按分值将表达水平分为:0分阴性,1~3分弱阳性,4~6分强阳性(1~6分为阳性)。选择典型视野,利用显微照相系统照相。
1.5 细胞培养及处理Moody细胞株用含15%胎牛血清的MCDB109/M199培养液,余6种细胞用含10%胎牛血清、100 U/L青霉素和100 U/L链霉素双抗的DMEM-F12培养液,置于37℃、5%CO2 细胞培养箱中培养。实验用细胞均处于对数生长期。将7种不同病理类型的卵巢组织细胞于同时间,长满培养皿后收集细胞,运用蛋白质印迹分析法检测Dsc3分子的表达;Hey、HO8910细胞在血清饥饿24 h后,经浓度分别为0、20、40、80 IU/L的FSH作用48 h及选用最佳作用浓度的FSH分别作用0、24、48、72 h,收集细胞后,用蛋白质印迹分析法检测Dsc3、EGFR等蛋白分子的表达;通过siRNA干扰法分别干扰Dsc3、EGFR,以及应用PI3K/Akt通路阻断剂LY294002(10 μmol/L;购自美国Selleck公司)预处理细胞1 h后,FSH再处理细胞48 h,收集细胞,运用蛋白质印迹分析、MTT法检测信号通路分子的表达及细胞增殖情况。
1.6 蛋白质印迹分析收集上述处理后的细胞,裂解后收集上清液,BCA蛋白定量法测定蛋白浓度。将60 μg蛋白上样于10% SDS-PAGE,电泳结束后,将蛋白转印至PVDF膜上,应用稀释的Dsc3(1∶5 000)、EGFR(1∶1 000)、Akt(1∶1 000)、pAkt(1∶1 000)、GAPDH抗体(1∶1 000)于4℃孵育过夜,经TBST洗涤后,选择合适的二抗孵育1 h,经TBST洗涤后,应用ECL化学发光法检测目的蛋白表达情况。实验重复3次。
1.7 MTT实验检测细胞增殖活性收集Hey、HO-8910细胞,分别接种至96孔板中,每孔加入200 μL铺板使待测细胞密度为1 000~3 000个/孔,边缘孔用无菌1×PBS填充,用含10%胎牛血清的DMEM培养液将各孔的培养液补齐到200 μL,5%CO2、37℃孵育,至细胞贴壁。通过siRNA干扰法分别干扰Dsc3、EGFR,以及应用PI3K/Akt通路阻断剂LY294002(10 μmol/L)预处理细胞1 h后,FSH再处理细胞48 h,收集细胞,每孔200 μL,设6个复孔。每孔加入20 μL MTT溶液(5 mg/mL,即0.5%MTT),继续放入5%CO2、37℃培养4 h后,小心吸去孔内培养液,每孔加入150 μL DMSO,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪490 nm处测量各孔的光密度(D)值。
1.8 siRNA干扰实验实验分组:siCon组为转染阴性对照序列的实验组,对Dsc3或EGFR无干扰作用;siDsc3或siEGFR组:转染特异性干扰Dsc3或EGFR的siDsc3或siEGFR序列;FSH+siCon组:以FSH处理的siCon组;FSH+siDsc3、FSH+siEGFR:以FSH处理的siDsc3或siEGFR组。种植于6孔板中的Hey细胞和HO8910细胞经无血清的OPTI-MEM培养液饥饿24 h后,当细胞密度达30%~50%时,按lipofectamine 2000使用说明书将配置好的siRNA-脂质体混合物转染细胞。转染12 h后加入40 IU/L FSH处理48 h,提取蛋白,按上述步骤用蛋白质印迹分析法测定Dsc3、EGFR、Akt、pAkt表达;96孔板中相同处理的Hey细胞和HO8910细胞经FSH处理48 h后,应用MTT检测Dsc3、EGFR对细胞增殖的影响。
1.9 统计学处理应用SPSS 17.0软件进行统计学分析。免疫组化数据分析采用Kruskal-Wallis检验,MTT检测结果的数据分析采用单因素方差分析。检验水准(α)为0.05。
2 结 果 2.1 Dsc3在不同卵巢肿瘤组织和细胞株中的表达Dsc3阳性细胞定位于细胞膜。Dsc3在卵巢癌组织中的阳性表达率为77.4%(24/31),在交界性卵巢肿瘤中的阳性表达率为81.8%(18/22),均高于在良性卵巢肿瘤中的表达[15.8%(3/19)],差异均有统计学意义(P<0.05)。Dsc3在卵巢癌中的阳性表达率与交界性卵巢肿瘤比较差异无统计学意义(P>0.05)。代表性的免疫组化染色结果见图 1。

|
图 1 免疫组化染色检测Dsc3在不同卵巢肿瘤组织中的表达(SP法) Fig 1 Expression of Dsc3 in different ovarian tissues determined by immunohistochemical staining(SP method) A:Benign ovarian cyst tissues; B:Borderline ovarian tumor tissues; C:Ovarian cancer tissues. Original magnification: ×100 |
用蛋白质印迹分析法检测Dsc3在7种不同卵巢组织细胞株中的蛋白表达情况,结果(图 2)表明Dsc3在卵巢癌细胞株Hey、HO8910、Skov3、Skov3ip以及在卵巢交界性囊腺瘤细胞株MCV152中的表达均高于卵巢永生化上皮细胞株Moody和卵巢癌细胞株ES-2。

|
图 2 蛋白质印迹分析检测Dsc3在不同卵巢组织细胞株中的表达 Fig 2 Expression of Dsc3 in different ovarian cell lines detected by Western blotting analysis 1: ES-2; 2: HO8910; 3: Skov3ip; 4: Skov3; 5: MCV152; 6: Hey; 7: Moody |
蛋白质印迹分析结果(图 3)显示,不同浓度的FSH作用于Hey细胞和HO8910细胞48 h后,两种细胞的Dsc3、EGFR表达随FSH浓度的升高而逐渐增加,在一定范围内呈剂量依赖性。Dsc3在FSH浓度为40 IU/L时表达量最高,浓度为80 IU/L时略有下降。

|
图 3 蛋白质印迹分析检测不同浓度FSH对Dsc3、EGFR表达的影响 Fig 3 Effect of different concentrations of FSH on Dsc3 and EGFR expression as detected by Western blotting analysis FSH: Follicle stimulating hormone; Dsc3: Desmocollin 3; EGFR: Epidermal growth factor receptor. A: Hey cells; B: HO8910 cells |
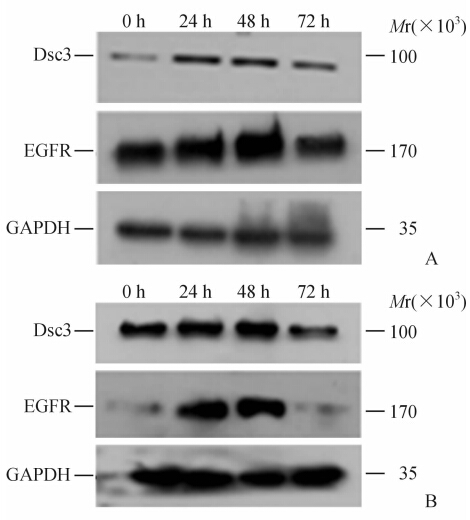
蛋白质印迹分析结果(图 4)显示,选择FSH的最佳浓度40 IU/L,分别作用于Hey细胞和HO8910细胞24、48 h后,两种细胞的Dsc3、EGFR的表达随FSH作用时间的延长而逐渐增加,呈时间依赖性,48 h时Dsc3表达最高,72 h时有所下降。
|
图 4 蛋白质印迹分析检测不同作用时间的FSH(40 IU/L)对Dsc3、EGFR表达的影响 Fig 4 Dsc3 and EGFR expression in Hey cells and HO8910 cells treated with FSH (40 IU/L) for different periods as detected by Western blotting analysis FSH: Follicle stimulating hormone; Dsc3: Desmocollin 3; EGFR: Epidermal growth factor receptor. A: Hey cells; B: HO8910 cells |
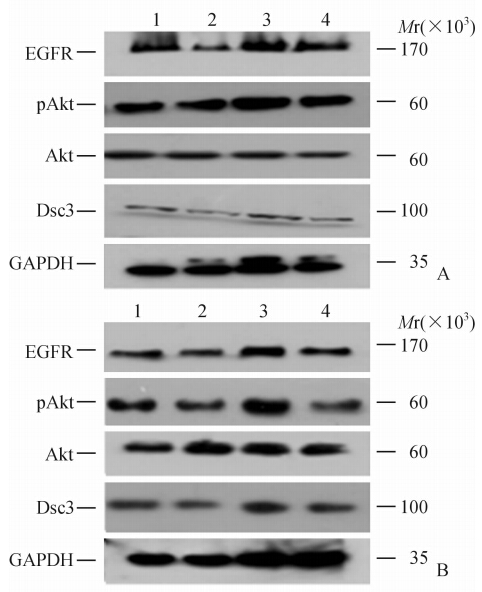
蛋白质印迹分析结果(图 5)显示,干扰Dsc3对Hey细胞和HO8910细胞的EGFR、pAkt在蛋白水平的表达有抑制作用,对Akt作用不明显,且FSH(40 IU/L)对EGFR、pAkt的上调作用被抑制,对Akt作用不明显。

|
图 5 蛋白质印迹分析检测干扰Dsc3对FSH(40 IU/L)调控的AKT信号通路蛋白分子表达的影响
Fig 5 RNA interference of Dsc3 regulates PI3K/Akt signaling pathway protein regulated by FSH(40 IU/L) as detected by Western blotting analysis
FSH: Follicle stimulating hormone; Dsc3: Desmocollin 3; EGFR: Epidermal growth factor receptor; Akt: Serine/threonine kinase; pAkt: Phosphorylated Akt. A: Hey cells; B: HO8910 cells. 1: siCon; 2: siDsc3; 3: siCon+FSH; 4: siDsc3+FSH |
蛋白质印迹分析结果(图6)显示,干扰EGFR对Hey细胞和HO8910细胞的pAkt、Dsc3蛋白水平的表达有抑制作用,对Akt作用不明显,FSH(40 IU/L)对pAkt、Dsc3的上调作用被抑制,对Akt作用不明显。
|
图 6 蛋白质印迹分析检测干扰EGFR对FSH(40 IU/L)调控的AKT信号通路蛋白分子表达的影响
Fig 6 RNA interference of EGFR regulates PI3K/Akt signaling pathway regulated by FSH(40 IU/L) as detected by Western blotting analysis
FSH: Follicle stimulating hormone; Dsc3: Desmocollin 3; EGFR: Epidermal growth factor receptor; Akt: Serine/threonine kinase; pAkt: Phosphorylated Akt. A: Hey cells; B: HO8910 cells. 1: siCon; 2: siDsc3; 3: siCon+FSH; 4: siEGFR+FSH |
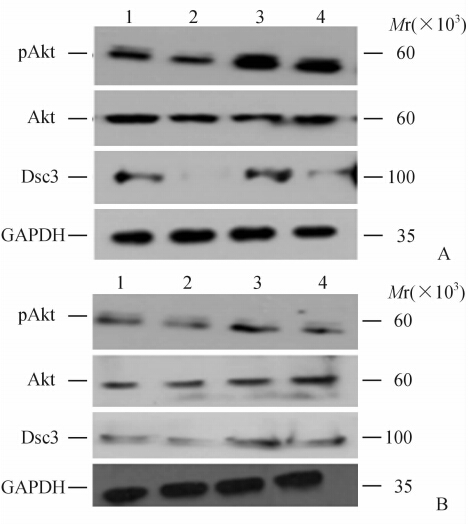
蛋白质印迹分析结果(图 7) 显示,应用PI3K/Akt通路阻断剂LY294002阻断PI3K/Akt通路后,pAkt、Dsc3蛋白表达下调,Akt蛋白表达持平,FSH(40 IU/L)对pAkt、Dsc3的上调作用被抑制,对Akt作用无明显变化。
|
图 7 蛋白质印迹分析检测阻断PI3K/Akt通路对FSH (40 IU/L)调控的通路信号分子蛋白表达的影响
Fig 7 Effect of blocking PI3K/Akt signaling pathway on protein of FSH(40 IU/L) signaling pathway as detected by Western blotting analysis
Con: Control; FSH: Follicle stimulating hormone; Dsc3: Desmocollin 3; Akt: Serine/threonine kinase; pAkt: Phosphorylated Akt. A: Hey cells; B: HO8910 cells. 1: Con; 2: Ly 294002; 3: Con+FSH; 4: Ly 294002+FSH |
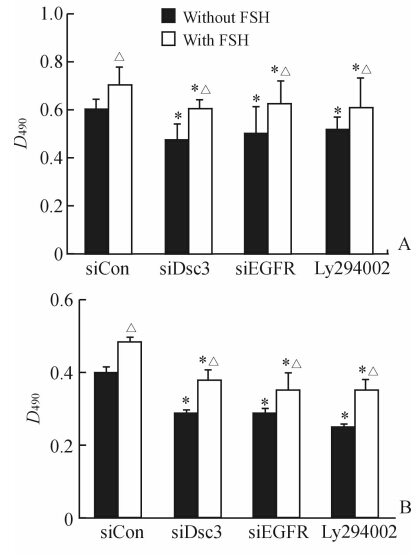
MTT检测结果(图 8)显示,siDsc3、siEGFR、LY294002分别与siCon比较,差异均有统计学意义(P<0.05);siDsc3+FSH、siEGFR+FSH、LY294002+FSH分别与siCon+FSH比较,差异均有统计学意义(P<0.05);siCon+FSH与siCon、siDsc3+FSH与siDsc3、siEGFR+FSH与EGFR、LY294002+FSH与LY294002比较,差异亦均有统计学意义(P<0.05)。结果表明分别干扰Dsc3、EGFR,应用PI3K/Akt通路阻断剂LY294002后,对卵巢癌细胞增殖有抑制作用,同时也减弱了FSH对卵巢癌细胞的增殖作用。
|
图 8 MTT法检测卵巢癌细胞增殖活性
Fig 8 Ovarian cancer cell proliferation as detected by MTT
Con: Control; FSH: Follicle stimulating hormone; Dsc3: Desmocollin 3; Akt: Serine/threonine kinase; pAkt: Phosphorylated Akt. A: Hey cells; B: HO8910 cells. 1: Con; 2: Ly 294002; 3: Con+FSH; 4: Ly 294002+FSH |
卵巢癌在妇科恶性肿瘤中的病死率高居首位,主要由于卵巢深藏盆腔,难以早期发现病变,缺乏早期预警,以致确诊时多数已属晚期。因此,了解卵巢癌发病的分子基础,寻找早期诊断方法,将有助于针对特定靶点的药物研发和进行有效的治疗。卵巢是FSH的主要靶器官体[ 9 ],FSH促进正常卵巢细胞和卵巢癌细胞增殖;流行病学研究显示绝经后妇女的卵巢癌发病率明显高于生育期妇女[ 10 ],围绝经和绝经妇女体内血清高FSH浓度与卵巢癌发生发展密切相关,李连香等[ 11 ]的研究表明,在良性与恶性上皮性卵巢肿瘤患者、良性与交界性上皮性卵巢肿瘤患者的血清和肿瘤组织液之间,FSH浓度均存在显著差异(P<0.05),且随着恶性程度的增高,FSH浓度也呈增高趋势。 FSH在促进卵巢癌发展 中的作用机制,已有很多文献报道,如盛林等[ 12 ]研究发现,FSH通过蛋白激酶C介导的信号转导途径,可刺激卵巢上皮癌细胞增殖;冯怡雯等[ 13 ]研究表明,FSH通过特异AT序列结合蛋白1调控上皮性卵巢癌ES-2细胞的增殖和侵袭活性等。有关FSH作用机制的研究虽多,但仍未完全阐明。
近年研究表明,Dsc3与某些肿瘤的发生发展可能有一定的相关性[ 14,15 ]。Dsc3的DNA甲基化可导致其在结直肠癌中表达下调[ 2 ];Dsc3的缺失导致K-Ras原癌基因介导的皮肤肿瘤发生率增高[ 3 ];Dsc3在低分化的胰腺导管癌[ 5 ]及在近半数未分化的肺大细胞癌[ 6 ]中高表达。然而,Dsc3在卵巢癌中的表达情况较少有报道,故本研究对此进行了探讨。本研究预实验结果表明,Dsc3在卵巢癌及交界性卵巢肿瘤中的阳性表达率均高于良性卵巢肿瘤(P<0.05)。选用卵巢永生化上皮细胞、交界性卵巢肿瘤细胞及卵巢癌细胞共7种进行Dsc3的蛋白质印迹分析发现,Dsc3在卵巢癌细胞株Hey、HO8910、Skov3、Skov3ip以及在卵巢交界性囊腺瘤细胞株MCV152中表达均高于卵巢永生化上皮细胞Moody和卵巢癌细胞株ES-2(P<0.05)。
有文献报道,Dsc3同族分子Dsc2的缺失可通过激活 EGFR/Akt信号通路使结肠上皮细胞体外增殖,并转化为恶性表型[ 7 ]。本课题旨在探究Dsc3在卵巢癌中是否也通过EGFR/Akt信号通路促进FSH调控的卵巢癌细胞增殖活性,进而促进肿瘤发生发展。本研究首先运用蛋白质印迹分析方法检测FSH对Dsc3以及信号通路分子EGFR在蛋白水平的影响。流行病学调查发现,卵巢癌在伴有FSH增高的人群中发病率增高;在正常月经中,排卵前FSH在血中浓度约为5~20 IU/L,而排卵前升高亦不超过30 IU/L,绝经后或卵巢功能衰退患者血FSH浓度可≥40 IU/L[ 16 ],而Halperin等[ 17 ]发现,卵巢癌患者血清中FSH浓度达(24.74±18.7)IU/L。Zheng等[ 18 ]和宋光辉等[ 19 ]研究了两种卵巢癌细胞株在FSH浓度<160 IU/L范围内的细胞增殖情况,发现均在FSH浓度为40 IU/L时最强;其后,随FSH浓度增加各细胞株增殖并不进一步增加。因此,本研究选取20、40、80 IU/L为FSH对卵巢癌细胞的作用浓度。在胡琢瑛等[ 20 ]的研究中,不同浓度的FSH作用于卵巢癌细胞株24、48、72 h后,通过MTT比色法显示,细胞增殖活性均较对照组升高,但仅40 IU/L浓度的FSH作用48 h时差异有统计学意义。因此本实验选24、48、72 h作为FSH作用的时间点。本研究结果表明FSH对Dsc3、EGFR的表达有上调作用,并呈一定的剂量-时间依赖性,选取FSH对Dsc3表达影响的较佳浓度40 IU/L与较佳时间48 h进行后续实验。本研究又通过分别干扰Dsc3和EGFR,研究这两个分子是否对信号通路分子产生影响,结果表明干扰Dsc3后对EGFR、pAkt在蛋白水平的表达有抑制作用,对Akt无明显作用,FSH对EGFR、pAkt的上调作用被抑制,对Akt作用不明显;干扰EGFR后对pAkt、Dsc3在蛋白水平的表达有抑制作用,对Akt无明显作用,FSH对pAkt的上调作用被抑制,对Akt作用不明显。同样,将干扰实验应用到MTT检测细胞增殖情况,结果表明分别干扰Dsc3和EGFR后,对卵巢癌细胞增殖有抑制,并且FSH作用后能明显促进细胞增殖(P<0.05)。之后进一步实验证明通过PI3K/Akt通路是否能影响细胞增殖,故应用该信号通路阻断剂LY294002处理细胞,蛋白质印迹分析结果表明阻断该通路后pAkt、Dsc3表达下调,Akt无明显变化,FSH对pAkt、Dsc3的上调作用被抑制,对Akt无明显影响,MTT实验进一步证实阻断该通路后,卵巢癌细胞的增殖相比对照受抑制,FSH作用后增殖活性较对照明显升高(P<0.05),从而说明PI3K/Akt信号通路确实介导了卵巢癌细胞的增殖。
综上所述,本研究结果表明Dsc3确实介导了FSH通过EGFR/Akt通路并调控的卵巢癌细胞增殖活性,进而促进卵巢癌的发展。但是,Dsc3是否会影响卵巢癌或者其他肿瘤细胞的侵袭、凋亡、增殖等,本实验并未进行研究并且目前尚少有研究及报道,另外该家族的蛋白在肿瘤细胞发生发展中所起的作用,文献记载也不多,这是我们今后可以考虑的研究方向。通过我们的进一步研究,如果能证实Dsc3对肿瘤细胞的调控的机制,将更有效的指导临床应用。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Aoyama Y,Yamamoto Y,Yamaguchi F,Kitajima Y. Low to high Ca2+-switch causes phosphorylation and association of desmocollin 3 with plakoglobin and desmoglein 3 in cultured keratinocytes[J].Exp Dermatol,2009,18:404-408. |
| [2] | Cui T,Chen Y,Yang L,Knösel T,Zöller K,Huber O,et al.DSC3 expression is regulated by p53,and methylation of DSC3 DNA is a prognostic marker in human colorectal cancer[J].Br J Cancer,2011,104:1013-1019. |
| [3] | Chen J,O'Shea C,Fitzpatrick J E,Koster M I,Koch P J.Loss of desmocollin 3 in skin tumor development and progression[J].Mol Carcinog,2012,51:535-545. |
| [4] | Wang L,Liu T,Wang Y,Cao L,Nishioka M,Aguirre R L,et al.Altered expression of desmocollin 3,desmoglein 3,and β-catenin in oral squamous cell carcinoma:correlation with lymph node metastasis and cell proliferation[J].Virchows Arch,2007,451:959-966. |
| [5] | Hamidov Z,Altendorf-Hofmann A,Chen Y,Settmacher U,Petersen I,Knösel T.Reduced expression of desmocollin 2 is an independent prognostic biomarker for shorter patients survival in pancreatic ductal adenocarcinoma[J].J Clin Pathol,2011,64:990-994. |
| [6] | Monica V,Ceppi P,Righi L,Tavaglione V,Volante M, Pelosi G,et al.Desmocollin-3:a new marker of squamous differentiation in undifferentiated large-cell carcinoma of the lung[J].Mod Pathol,2009,22:709-717. |
| [7] | Kolegraff K,Nava P,Helms M N,Parkos C A,Nusrat A.Loss of desmocollin-2 confers a tumorigenic phenotype to colonic epithelial cells through activation of Akt/β-catenin signaling[J].Mol Biol Cell,2011,22:1121-1134. |
| [8] | Remmele W,Stegner H E.[Recommendation for uniform definition of an immunoreactive score (IRS) for immunohistochemical estrogen receptor detection (ER-ICA) in breast cancer tissue][J].Pathologe,1987,8:138-140. |
| [9] | Syed V,Ulinski G,Mok S C,Yiu G K,Ho S M. Expression of gonadotropin receptor and growth responses to key reproductive hormones in normal and malignant human ovarian surface epithelial cells[J].Cancer Res,2001,61:6768-6776. |
| [10] | Stadel B V.Letter:the etiology and prevention of ovarian cancer[J].Am J Obstet Gynecol,1975,123:772-774. |
| [11] | 李连香,陈丽宏,王亚琴,郭剑.FSH 在上皮性卵巢肿瘤中的表达及意义[J].现代肿瘤医学,2009,17:927-928. |
| [12] | 盛林,刘东远,沈铿.卵泡刺激素介导卵巢上皮性癌细胞增殖的初步研究[J].中华妇产科杂志,2004,38:752-755. |
| [13] | 冯怡雯,魏桠楠,祝颖,周冬梅,吴凌,杨婷,等.FSH 通过 SATB1 调控上皮性卵巢癌 ES-2 细胞的增殖和侵袭活性[J].现代生物医学进展,2011,11:2801-2805. |
| [14] | Tsuta K,Tanabe Y,Yoshida A,Takahashi F, Maeshima A M,Asamura H,et al.Utility of 10 immunohistochemical markers including novel markers (desmocollin-3,glypican 3,S100A2,S100A7,and Sox-2) for differential diagnosis of squamous cell carcinoma from adenocarcinoma of the lung[J].J Thorac Oncol,2011,6:1190-1199. |
| [15] | Oshiro M M,Kim C J,Wozniak R J,Junk D J,Muñoz-Rodríguez J L,Burr J A,et al.Epigenetic silencing of DSC3 is a common event in human breast cancer[J].Breast Cancer Res,2005,7:R669-R680. |
| [16] | 曾泽毅.中华妇产科学[M].北京:人民卫生出版社,1999:1755-1761. |
| [17] | Halperin R,Hadas E,Langer R,Bukovsky I,Schneider D.Peritoneal fluid gonadotropins and ovarian hormones in patients with ovarian cancer[J].Int J Gynecol Cancer,1999,9:502-507. |
| [18] | Zheng W,Lu J J,Luo F,Zheng Y,Feng Y J,Felix J C,et al.Ovarian epithelial tumor growth promotion by follicle-stimulating hormone and inhibition of the effect by luteinizing hormone[J].Gynecol Oncol,2000,76:80-88. |
| [19] | 宋光辉,刘惜时.卵泡刺激素对上皮性卵巢癌细胞株的增殖及E-钙粘素表达的影响[J].实用妇产科杂志,2004,20:294-297. |
| [20] | 胡琢瑛,邓晓谷,姚珍薇.生殖激素对卵巢癌细胞株HO-8910体外生长的调控[J].重庆医科大学学报,2004,29:148-152. |
 2014, Vol. 35
2014, Vol. 35


