椎间盘退变是导致椎间盘突出以及其他脊柱疾病的病理基础,而细胞外基质成分的改变,如聚蛋白聚糖(aggrecan)的降解,是椎间盘退变的重要表现之一[ 1 ]。含有血小板凝血酶敏感蛋白结构域的解聚素与金属蛋白酶(a disintegrin and metalloproteinase thrombospondin type Ⅰ motifs,ADAMTS)家族成员中的ADAMTS-4是目前公认最重要的聚蛋白聚糖酶,研究表明它在软骨以及椎间盘退变的过程中有重要作用[ 2,3 ]。本研究通过分析人ADAMTS-4基因启动子片段后,发现该启动子中含有2个活化T细胞核因子(nuclear factor of activated T-cells,NFAT)家族结合位点。进一步采用双荧光素酶报告基因检测系统,检测了髓核细胞中NFAT-1、4、5对ADAMTS-4启动子活性的影响,探讨椎间盘退变的分子机制,以期为椎间盘退变的生物治疗提供依据。
1 材料和方法 1.1 材料
人ADAMTS-4 promoter in Pβ-gal-Basic vector获赠于Dr.Thirunavukkarasu(Lilly Research Labs),限制性内切酶XhoⅠ和HindⅢ均购自New England Biolabs公司,pRL-TK海肾荧光素酶质粒、Dual LuciferaseTM Reporter Assay System、pSVβ-galactosidase质粒、质粒提纯试剂盒、T4 DNA连接酶均购自Promega公司,胰酶-EDTA、DMEM培养基、胎牛血清均购自Gibco公司,Lipofectamine2000转染试剂购自Invitrogen公司,DNA提取试剂盒、DNA纯化试剂盒均购自Qiagen公司。
1.2 PGL3-ADAMTS-4基因质粒构建方法用XhoⅠ及HindⅢ两种内切酶将3.5 kb ADAMTS-4启动子片段从ADAMTS-4-pβ-gal-Basic质粒中切出,同时将PGL3空载体的上游和下游分别切开。琼脂糖凝胶电泳后,用Qiagen DNA提取试剂盒及Qiagen DNA纯化试剂盒对所得DNA片段进行提取,纯化。在16℃下,用T4 DNA连接酶体系将ADAMTS-4启动子片段与PGL3空载体连接,转化入大肠杆菌体内,涂布于含氨苄青霉素的琼脂糖(agarrose)细菌培养板后,再置于37℃的培养箱过夜。利用接入ADAMTS-4启动子片段后的PGL3表达氨苄青霉素耐药基因的特性,挑取有效存活细菌,将其克隆、摇菌、过柱后获得纯化质粒,并用DNA电泳方法来确认成功构建正确质粒。
1.3 髓核细胞的分离和培养用Risbud实验室分离椎间盘髓核细胞法[ 4 ],分离大鼠髓核细胞获取原代细胞后,将其放在37℃、5%CO2的培养箱中,孵育48 h后换液,以后每2 d换1次液体,按时观察细胞形态。当细胞生长满大约80%培养皿时,按1∶3的比例进行传代。消化:取待传代细胞培养瓶(皿),加入适量0.25%胰蛋白酶-EDTA,加入培养液终止消化,离心后弃去培养液,加入新鲜培养液后,按1∶3比例进行传代。冻存:髓核细胞消化后,加入1 mL冻存液(DMEM+20%胎牛血清+10%DMSO)中,转移到冻存管后放入-80℃冰箱,24~48 h后放入液氮箱中。复苏:将细胞迅速在37℃水浴箱中融化,移至加有新鲜培养液的试管内,1 200 r/min离心2 min,加入新鲜培养液后,转移至培养瓶后放入细胞培养箱内培养,次日换液。
1.4 荧光素酶报告基因检测使用双荧光素酶报告基因检测试剂盒(Dual-LuciferaseTM reporter Assay System Promega)来检测荧光素酶基因表达:每孔细胞中加入裂解液50 μL,室温下摇床裂解细胞35~40 min,以10 μL细胞裂解悬液加入萤火虫荧光素酶底物50 μL,读取荧光表达,再加入海肾荧光素酶底物50 μL,读取荧光表达,以海肾荧光素酶与底物反应读数作为校正内参,二者比值即为获得校正后的读数。
1.5 统计学处理所有的实验独立重复3次,用t检验进行组间比较,实验数据以x±s表示,检验水准(α)为0.05。
2 结 果 2.1 ADAMTS-4启动子体外扩增、酶切以及鉴定结果
ADAMTS-4-pβ-gal-Basic质粒被限制性内切酶HindⅢ和XhoⅠ进行酶切后的产物,再分别经0.8%琼脂糖电泳后,在紫外灯下可见0.8~4.5 kb不等的条带。选取3.5 kb的ADAMTS-4启动子片段作为目的基因,使用Qiagen DNA 提取试剂盒及纯化试剂盒对所得DNA片段进行提取、纯化。纯化后的PGL3-ADAMTS-4 promoter质粒,再次用内切酶HindⅢ和XhoⅠ进行双酶切,可见4.6 kb的线性PGL3-Basic质粒和3.5 kb的ADAMTS-4启动子片段(图 1),证实质粒构建成功。
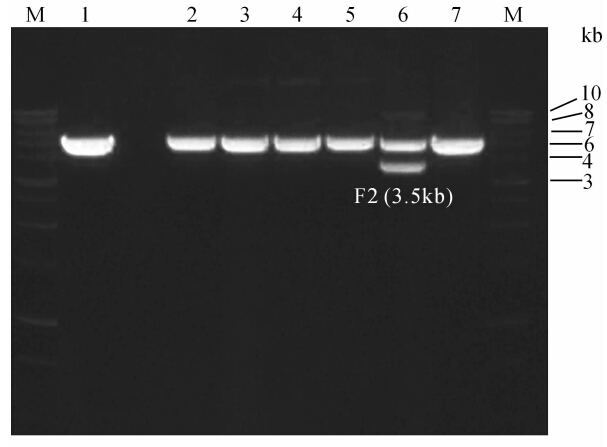 | 图 1 重组质粒的酶切鉴定 Fig 1 Identification of plasmid PGL3-ADAMTS4 promoter after digestion by XhoⅠ and HindⅢ Restriction enzyme was used to digest plasmid PGL3-ADAMTS4 promoter(1-7) again,and F2(3.5 kb) was successfully obtained. M: DNA marker; 1: PGL3-Basic; 2: PGL3-813; 3: PGL3-1203; 4: PGL3-1813; 5: PGL3-2209; 6: PGL3-3508; 7: PGL3-4524 |
对获取的3.5 kb ADAMTS-4启动子片段进行测序,并且使用JASPAR数据库[ 5 ]来研究该3.5 kb ADAMTS-4启动子序列中是否存在NFAT的结合位点。分析结果显示在3.5 kb ADAMTS-4启动子转录起始点上游-707~-702 bp和-3 098~-3 093 bp处有2个NFAT结合位点,即“GGAAAA”序列。除此之外,还可见ADAMTS-4启动子片段中存在着多个NF-κB、Runx等结合位点(图 2)。
2.3 NFAT-1和NFAT-4对ADAMTS-4启动子的调控作用使用NFAT-1、NFAT-4表达质粒分别转染大鼠髓核细胞。相比于正常的髓核细胞,转染150 ng NFAT-1质粒后ADAMTS-4启动子活性读数为0.61±0.01,差异有统计学意义(P<0.05)。而在转染50、100、150 ng NFAT-4后,相比于正常的髓核细胞,ADAMTS-4启动子活性读数分别为0.89±0.13、0.7±0.098、0.97±0.24,差异无统计学意义(P>0.05)。
2.4 渗透压以及NFAT-5/TonEBP对ADAMTS-4启动子活性的调控作用分别检验了在标准渗透压和450 osm渗透压状态下ADAMTS-4启动子活性。结果显示,与标准渗透压条件下培养的髓核细胞相比,高渗条件下培养的髓核细胞中ADAMTS-4启动子活性读数为0.43±0.042,差异有统计学意义(P<0.05)。分别将50、100、150 ng的DN-TonEBP质粒转染处于高渗透压条件下培养的髓核细胞中,相比于未转染DN-TonEBP的髓核细胞,转染了DN-TonEBP的髓核细胞中ADAMTS-4启动子活性的读数分别为0.53±0.09、0.46±0.05、0.52±0.07,差异无统计学意义(P>0.05)。为了进一步验证NFAT-5/TonEBP是否对ADAMTS-4的转录具有调控作用,我们分别将50、100、150 ng的NFAT-5/TonEBP表达质粒转染髓核细胞,相比于正常的髓核细胞,其ADAMTS-4启动子活性读数分别为0.89±0.08、0.73±0.15、0.80±0.11,差异无统计学意义(P>0.05)。
3 讨 论ADAMTS是一种新型Zn2+依赖性分泌型金属蛋白酶,广泛存在于哺乳动物和无脊椎动物中。ADAMTS-4是生物体中最重要的聚蛋白聚糖酶,在髓核中TNF-α、IL-1β等炎症因子能够通过MAPK、NF-κB信号转导通路诱导表达导致聚蛋白聚糖分解,在椎间盘退变的过程中发挥作用[ 6 ]。NFAT家族包括NFAT-1~4以及NFAT-5/TonEBP,其中NFAT-1~4由Ca2+信号调节,NFAT-5则通过渗透压的改变而被激活。NFAT在软骨细胞以及髓核细胞中也有表达,具有促进软骨退变的作用[ 7,8 ],并且在软骨细胞中NFAT-1上调了ADAMTS-4启动子活性[ 9 ]。
本实验克隆了3.5 kb 人ADAMTS-4基因启动子片段,成功构建了ADAMTS-4基因双荧光素酶报告质粒。对该启动子序列进行分析,结果显示在该启动子转录起始点上游有2个NFAT结合元件。NFAT-1转染髓核细胞,数据显示在髓核细胞中NFAT-1下调了ADAMTS-4启动子活性,该结果与软骨细胞中[ 7,8 ]的并不一致。由于在不同的组织或者细胞型中,NFATs可以与不同的转录因子结合形成不同的转录复合体或者激活其他的转录因子,从而对启动子活性产生不同的影响[ 10 ],推测在髓核细胞和软骨细胞中,NFAT可能结合了不同的转录因子从而对ADAMTS-4的转录产生相反的作用。Tomita等[ 11 ]的研究已经证实NFAT-4通过上调骨形态发生蛋白2的表达促 进软骨分化以及聚蛋白聚糖产生。我们的结果显示NFAT-4对ADAMTS-4启动子无调控作用,但文献报道NFAT-4通过抑制合成糖胺聚糖(glycosaminoglycan,GAG)的关键酶——葡萄糖醛酸转移酶的转录活性[ 12 ],参与髓核细胞外基质代谢过程,在蛋白聚糖成熟的过程中发挥重要的调控作用。
本研究还检测了髓核细胞中渗透压对ADAMTS-4启动子活性的影响,与文献[ 13 ]的结果一致,高渗透压抑制了ADAMTS-4启动子活性。将DN-TonEBP在高渗透压条件下共转染髓核细胞,数据显示DN-TonEBP并没有解除高渗透压对ADAMTS-4启动子的抑制作用,说明在这个过程中高渗透压没有激活NFAT-5/TonEBP。用NFAT-5/TonEBP质粒转染髓核细胞,数据与之前的结果一致,NFAT-5/TonEBP对ADAMTS-4启动子活性没有明显影响。我们推测与既往报道中高渗透压激活NFAT-5/TonEBP的经典通路发挥作用[ 14 ]不同,高渗状态抑制ADAMTS-4启动子的活性并不是通过该通路来实现的,这个过程中可能存在其他未知的调控机制。
 | 图 2 3.5 kb ADAMTS-4启动子序列分析结果 Fig 2 Sequence analysis of 3.5 kb ADAMTS-4 promoter by JASPAR The consensus NFAT-binding elements containing the sequence “GGAAAA” were located at positions -707 to -702 and -3 098 to -3 093 upstream of the transcription start site. NFAT: Nuclear factor of activited T-cells |
所有作者声明本文不涉及任何利益冲突。
| [1] | Colombini A,Lombardi G,Corsi M M,Banfi G.Pathophysiology of the human intervertebral disc[J].Int J Biochem Cell Biol,2008,40:837-842. |
| [2] | Song R H,Tortorella M D,Malfait A M,Alston J T,Yang Z,Arner E C,et al.Aggrecan degradation in human articular cartilage explants is mediated by both ADAMTS-4 and ADAMTS-5[J].Arthritis Rheum,2007,56:575-585. |
| [3] | Bondeson J,Wainwright S,Hughes C,Caterson B.The regulation of the ADAMTS-4 and ADAMTS-5 aggrecanases in osteoarthritis:a review[J].Clin Exp Rheumatol,2008,26:139-145. |
| [4] | Risbud M V,Guttapalli A,Stokes D G,Hawkins D, Danielson K G,Schaer T P,et al.Nucleus pulposus cells express HIF-1 alpha under normoxic culture conditions: a metabolic adaptation to the intervertebral disc microenvironment[J].J Cell Biochem,2006,98:152-159. |
| [5] | Wasserman W W,Sandelin A.Applied bioinformatics for the identification of regulatory elements[J].Nat Rev Genet,2004,5:276-287. |
| [6] | Tian Y,Yuan W,Fujita N,Wang J,Wang H,Shapiro I M,et al.Inflammatory cytokines associated with degenerative disc disease control aggrecanase-1 (ADAMTS-4) expression in nucleus pulposus cells through MAPK and NF-κB[J].Am J Pathol,2013,182:2310-2321. |
| [7] | Ranger A M,Gerstenfeld L C,Wang J,Kon T,Bae H,Gravallese E M,et al.The transcription factor NFATp is a repressor of chondrogenesis[J].J Exp Med,2000,191:9-21. |
| [8] | Nishigaki F,Sakuma S,Ogawa T,Miyata S,Ohkubo T,Goto T.FK506 induces chondrogenic differentiation of clonal mouse embryonic carcinoma cells,ATDC5[J].Eur J Pharmacol,2002,437:123-128. |
| [9] | Thirunavukkarasu K,Pei Y,Moore T L,Wang H,Yu X P,Geiser A G,et al.Regulation of the human ADAMTS-4 promoter by transcription factors and cytokines[J].Biochem Biophys Res Commun,2006,345:197-204. |
| [10] | Flanagan W M,Corthésy B,Bram R J,Crabtree G R.Nuclear association of a T-cell transcription factor blocked by FK-506 and cyclosporin A[J].Nature,1991,352:803-807. |
| [11] | Tomita M,Reinhold M I,Molkentin J D,Naski M C.Calcineurin and NFAT4 induce chondrogenesis[J].J Biol Chem,2002,277:42214-42218. |
| [12] | Hiyama A,Gajghate S,Sakai D,Mochida J,Shapiro I M,Risbud M V.Activation of TonEBP by calcium controls {beta}1,3-glucuronosyltransferase-Ⅰ expression,a key regulator of glycosaminoglycan synthesis in cells of the intervertebral disc[J].J Biol Chem,2009,284:9824-9834. |
| [13] | Tsai T T,Danielson K G,Guttapalli A,Oguz E,Albert T J,Shapiro I M,et al.TonEBP/OREBP is a regulator of nucleus pulposus cell function and survival in the intervertebral disc[J].J Biol Chem,2006,281:25416-25424. |
| [14] | Cheung C Y,Ko B C.NFAT5 in cellular adaptation to hypertonic stress-regulations and functional significance[J].J Mol Signal,2013,8:5. |
 2014, Vol. 35
2014, Vol. 35


