2. 第二军医大学学员旅学员5队, 上海 200433
2. Student Brigade the 5th Team, Second Military Medical University, Shanghai 200433, China
炎症性肠病(IBD)是一种以复发缓解为特征的慢性肠道炎症性疾病,主要包括克罗恩病(CD)和溃疡性结肠炎(UC)[1,2,3]。CD呈现多病灶透壁性的炎症,可见于胃肠道的任何部位,而溃疡性结肠炎病变主要发生于结肠和直肠,炎症呈连续性,集中在黏膜层[4]。炎症性肠病临床表现复杂多样,常见症状有反复的腹痛、腹泻、黏液血便、体质量减轻等。
肠炎动物模型在研究过程中不可或缺。尽管IBD存在多种动物模型,但是化学试剂诱导的肠炎模型因造模方便、快捷而被广泛应用。常见的肠炎诱导剂包括2,4,6-三硝基苯磺酸(TNBS)、噁唑酮(oxazolone)和葡聚糖硫酸钠 (DSS)[5]。与IBD特征一致,化学试剂诱导的肠炎模型内脏敏感性增高、肠道动力改变[6,7,7,9],而这些改变通常认为与肠道炎症引起的肠道内在神经丛及内脏感觉传入通路发生改变有关,包括分布于肠壁内感受多种刺激的受体、初级传入感觉神经元及存在于中枢的传入通路。本实验利用TNBS肠炎模型对IBD发病时传入神经元的电生理特性进行了初步探索,以期更全面地了解IBD,为进一步探索肠道神经系统与肠炎的关系奠定基础。
1 材料和方法 1.1 动物分组及试剂
成年雄性SD大鼠,体质量160~200 g,动物许可证号:50793712,购自上海西普尔-必凯实验动物有限公司,所有的动物随机分为两组,每组5只。TNBS、L-15培养液、胎牛血清蛋白(BSA)、胰酶、层黏蛋白(laminin) 购自美国Sigma公司,Ⅱ型胶原酶、Hank’s平衡盐溶液购自美国Life Technologies公司。 1.2 动物模型的建立
利用TNBS灌肠建立肠炎模型[5]。按40 mg/kg TNBS的用量来计算的30% TNBS 溶液的体积,将1 mL注射器连接8 cm长的细塑料管,吸取计算好的TNB量,将细塑料管缓慢插入大鼠肛门7 cm,缓慢推注药物,缓慢取出塑料管后保持大鼠头向下60 s。 1.3 炎性指标测定
在TNBS或生理盐水灌肠后,连续监测大鼠体质量及粪便性状变化。第8 天处死大鼠,取其结肠标本进行H-E染色,确定肠炎造模是否成功,剔除肠炎造模失败个体。成功的肠炎模型鼠在应用TNBS后体质量显著下降,疾病活动指数(DAI)显著升高,H-E染色可见明显炎性细胞浸润。DAI评分规则如下[10]:体质量无减轻,或粪便呈正常粒状,或无便血计0分;体质量下降≤5%计1分;体质量下降>5%且≤10%,或粪便松软(有黏性但不黏到肛门周围),或粪便带血计2分;体质量下降>10%且≤20%计3分;体质量下降>20%,或稀便(水样便,可黏于肛门周围),或便血计4分。DAI评分为体质量变化、粪便性状及粪便带血情况3个参数评分总和除以3所得。 1.4 背根神经节(DRG)神经元分离培养
将大鼠轻度麻醉后快速断头致死,取出DRG,置于L-15培养液中,将神经节分离干净后置于2 mL含有1.5 mg/mLⅡ型胶原酶和6 mg/mL BSA的无钙无镁Hank’s平衡盐溶液中。在37℃的恒温下孵育30 min。然后将神经节置于2 mL含1 mg/mL的胰酶中,在37℃下孵育10 min。然后用1 mL培养液(由含有10% BSD、50 ng/mL神经生长因子、2 mg/mL NaHCO3、5.5 mg/mL葡萄糖溶液、200 μg/mL青霉素和200 μg/mL链霉素的L-15培养液组成)轻轻吹打直至将神经节分离成单个细胞,将这些细胞800 r/min离心(离心半径8 cm)2 min,弃去上清,用适量培养液重悬,铺在用10 μg/mL laminin预先涂过的35 mm 的平皿上。在含有5% CO2的37℃的恒温箱中孵育,1 h后每个平皿中加入37℃预热的培养液1 mL,放在含有5% CO2的37℃的恒温箱中孵育4 h后用于膜片钳记录。 1.5 记录电极
采用软质中性无芯苏打玻璃管,外径1.5 mm,内径1.3 mm。购买的玻璃微电极先在超声仪内用洗洁精进行处理,以除去杂质、灰尘和油脂,然后用自来水彻底冲洗干净,再用蒸馏水冲洗,最后在180℃烤箱内烤干。经处理后的玻璃微管密封保存以防止灰尘污染。使用时用PC-10拉制仪两步拉制成尖端1~2 μm的微电极。拉制的电极尖端形状应不锐利,尖颈部尽量粗短,即电极尖部短些。微电极充灌电极内液后进入灌流液时阻抗即电极电阻约为2~5 MΩ。 1.6 全细胞膜片钳记录
采用常规高阻抗封接的全细胞记录方式。从CO2孵箱中取出载有细胞的平皿,用细胞外灌流液进行灌流,灌流速度为1~2 mL/min。在倒置显微镜下选取合适的细胞,放置好给药头,通过MP-225显微操纵仪将玻璃微电极以45°角轻轻推向细胞表面,观察封接电阻的变化。在电极进入液面前,通过注射器向记录电极施加一正压(约20 mmH2O,1 mmH2O=0.098 kPa),防止气液界面上积聚的灰尘或溶液中的粒子附着在电极尖端而妨碍紧密封接的形成。
当记录电极接触细胞表面时,可观察到窗口显示封接电阻突然增加。此时迅速放掉开始所加正压,根据需要通过注射器施加一负压(约2~3 mmH2O),使电极和细胞膜表面形成紧密封接,封接阻抗升至GΩ级时表明封接形成。加上-60 mV的钳制电压,利于高阻封接的形成并补偿电极电容。此时用建立贴附式记录方法来记录电极腔正下方膜片上的单个(或几个)通道电流。待细胞稳定以后,向电极内施加较大负压(约100 mmH2O)则可吸破电极腔正下方的膜片,有时也可用电极腔下膜片施加持续的短周期、大强度的单个脉冲来打破膜片的方法(ZAP法)[11]。采用细胞记录模式记录细胞膜的跨膜电容电流,并补偿这一电容电流和串联电阻所造成的电压降。观察细胞的电压门控和化学门控离子通道的全细胞电流。全细胞记录通常维持20 min左右,实验温度为22~25℃。使用pCLAMP 9.2系列软件采集及处理数据。 1.7 统计学处理
采用SAS9.1软件进行统计分析,所有数据均以x±s表示。体质量、DAI评分用双因素多水平重复测量资料的方差分析进行比较,将每只大鼠所有记录的DRG神经元数据求均值作为各只大鼠的电生理指标,再采用独立样本t检验进行组间比较。检验水准(α)为0.05。 2 结 果 2.1 TNBS灌肠成功建立了IBD模型
TNBS灌肠组(n=5)与生理盐水灌肠组(n=5)相比,从第2天起,动物体质量显著降低(图1A,P<0.01),DAI评分显著增高(图1B,P<0.01),H-E染色示肠黏膜腺体结构严重破坏,炎性细胞浸润明显(图1C)。以上结果说明IBD大鼠模型建立成功。
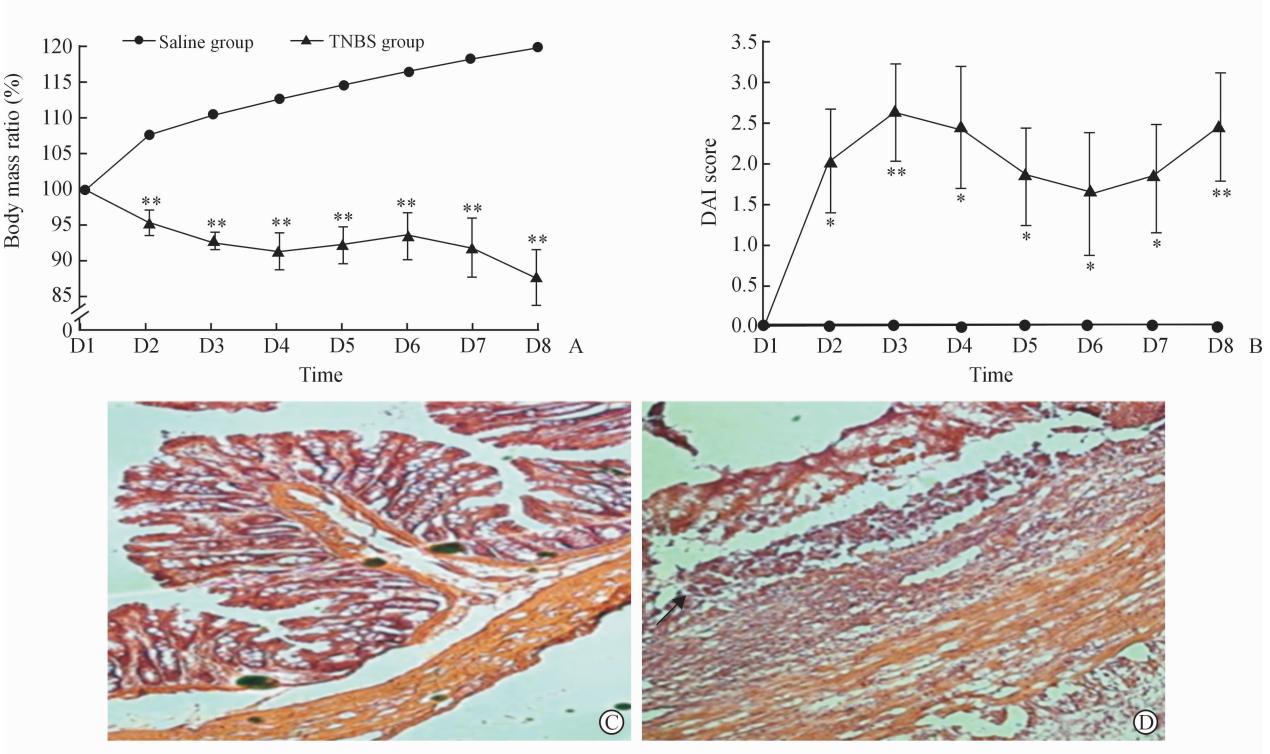 | 图1 TNBS灌肠成功建立炎症性肠病模型 Fig.1 Rat IBD model induced by intracolonic administration of TNBSIBD: Inflammatory bowel disease; TNBS: 2,4,6-trinitrobenzenesulfonic acid. A, B: Body mass ratio (BMR) before and after treatment and disease activity index (DAI) on different days after TNBS or saline administration. *P<0.05, **P<0.01 vs saline group. n=5, x±s. C, D: Representative images of H-E staining of two groups, with TNBS group (D) showing regions of inflammatory cell infiltration (arrow) and destroyed glandular structure compared with the saline group (C). Original magnification:×200 |
生理盐水灌肠组的动作电位阀电流为(226.0±18.1)pA,TNBC灌肠组的动作电位阀电流为(119.5±28.6)pA。与生理盐水灌肠组(n=5)相比,TNBS灌肠组(n=5)大鼠DRG(L4-S1)神经元动作电位的阈电流(AP threshold current)减小(P<0.05),神经元膜电位(Vm)、膜电容(Cm)、膜电阻(Rm)、在双倍阈电流刺激下产生动作电位的频率、动作电位幅值及动作电位时程差异均无统计学意义。图2为TNBS致肠炎组与生理盐水对照组DRG神经元动作电位原始图。
 | 图2 TNBS致肠炎组与生理盐水对照组DRG神经元动作电位原始图Fig.2 Original images of DRG neuron action potentials in TNBS-induced colitis and saline control groups DRG: Dorsal root ganglion; TNBS: 2,4,6-trinitrobenzenesulfonic acid |
肠炎可引起腹痛、肠道高敏感和肠动力改变,其潜在机制涉及肠炎引起的肠神经系统(内在神经系统和外来神经系统)的改变[12]。本实验在TNBS诱发肠炎的基础上,应用全细胞膜片钳技术对肠炎大鼠的初级传入神经元(DRG神经元)电生理特征进行了初步分析,探究肠炎对神经传入通路的影响。
TNBS肠炎模型被大量应用于研究炎症性肠病,是经典的IBD模型。研究表明,TNBS肠炎主要是由Th1细胞介导的肠炎[13],与克罗恩病的病理状态更为接近。实验中我们利用TNBS建立肠炎模型,记录了大鼠腰骶段(L4-S1)DRG神经元的被动电特性和动作电位特性。结果显示与生理盐水灌肠组相比,TNBS灌肠组大鼠DRG神经元Vm、Cm、Rm改变差异均无统计学意义;神经元动作电位的阈电流减小,在双倍阈电流刺激下产生动作电位的频率、动作电位时程及动作电位幅值差异均无统计学意义,说明TNBS致肠炎后大鼠DRG神经元兴奋性增高,这种变化可能是肠炎引起的腹痛腹泻、肠道高敏感和肠动力改变的原因之一。先前也有研究证实TNBS所致肠炎可使小鼠及豚鼠DRG神经元兴奋性增高[14,15]。还有文献报道,肠炎不仅可使初级传入神经元兴奋性增高,而且可以引起肠内神经元兴奋性增高,也可易化肠内神经环路神经突触传递[12]。
对于TNBS致肠炎后引起DRG神经元电生理特性变化的具体分子机制有待进一步研究。有文献表明TNBS致炎后大鼠Ca(v)3.2 T-type Ca2+通道表达上调,在介导肠腔内硫化氢引起的感觉神经兴奋作用上发挥了主要作用[16]。其他涉及这一现象的分子还包括DRG神经元上的特定蛋白,如TRPV1、TRPA1、TRPV4通道蛋白[12]和降钙素基因相关肽(CGRP)[17]。在现有的肠炎模型中,不论是通过基因修饰诱导的自发性肠炎还是通过化学试剂诱发的肠炎,其原理均涉及直接诱发免疫缺陷或形成自身免疫反应进而引发肠炎,TNBS肠炎就是利用半抗原TNBS结合肠道蛋白后形成完全抗原而诱发免疫炎症反应的。这些模型对于研究炎症性肠病的特征、影响因素及治疗是比较适用的,而对于研究IBD的发病或复发过程,包括始动因素、传动因素等发病早期机制存在先入为主的缺陷。所以长期以来关于IBD的发病通常认为是基因、肠道环境或肠道微生物、肠道细胞(包括肠上皮细胞、免疫细胞、间质细胞)综合作用的结果;关于肠炎与神经系统的关系往往只能阐述肠炎对于神经系统的影响。而神经细胞作为广泛存在于肠道中的细胞之一,在IBD发生发展中的作用研究甚少,所知有限。包括本实验也只是能反映在IBD发生后作为一级传入神经元的DRG神经元所发生的变化。基于这种构想,我们提出假说,即神经系统或肠道神经元的结构或功能改变触发或参与了IBD的发生或发展,还有待进一步的实验研究予以证实。
本实验通过全细胞膜片钳技术证实了TNBS诱发肠炎可使大鼠的初级传入神经元(DRG神经元)兴奋性增高,从电生理特征的角度明确了肠炎对初级传入神经元的影响,为肠炎发生时肠道功能的改变提供了依据。然而肠炎发生时肠道敏感性增高、肠道动力改变除了与神经传入通路的改变有关,其他因素可能还包括肠道神经胶质细胞、肠道间质Cajal细胞、肠道平滑肌细胞、肠道上皮细胞、肠道血管床等结构或功能的改变。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Baumgart D C,Carding S R.Inflammatory bowel disease: cause and immunobiology[J].Lancet,2007,369:1627-1640. |
| [2] | Baumgart D C,Sandborn W J.Inflammatory bowel disease:clinical aspects and established and evolving therapies[J].Lancet,2007,369:1641-1657. |
| [3] | Xavier R J,Podolsky D K.Unravelling the pathogenesis of inflammatory bowel disease[J].Nature,2007,448:427-434. |
| [4] | García de Tena J,Espinosa L M,Alvarez-Mon M.Inflammatory bowel disease[J].N Engl J Med,2002,347:1982-1984. |
| [5] | Wirtz S,Neufert C,Weigmann B,Neurath M F.Chemically induced mouse models of intestinal inflammation[J].Nat Protoc,2007,2:541-546. |
| [6] | Gschossmann J M,Liebregts T,Adam B,Puenger L,Ruwe M,Gerkon G,et al.Long-term effects of transient chemically induced colitis on the visceromotor response to mechanical colorectal distension[J].Dig Dis Sci,2004,49:96-101. |
| [7] | Yang J,Li Y,Zuo X,Yu Y,Gao L.Transient receptor potential ankyrin-1 participates in visceral hyperalgesia following experimental colitis[J].Neuroscience lett,2008,440:237-241. |
| [8] | Lamb K,Zhong F,Gebhart G F,Bielefeldt K.Experimental colitis in mice and sensitization of converging visceral and somatic afferent pathways[J].Am J Physiology Gastrointestinal Liver Physiology,2006,290:G451-G457. |
| [9] | Vermeulen W,DeMan J G,De Schepper H U,Bult H,Moreels T G,Pelckmans P A,et al.Role of TRPV1 and TRPA1 in visceral hypersensitivity to colorectal distension during experimental colitis in rats[J].Eur J pharmacology,2013,698:404-412. |
| [10] | Cooper H S,Murthy S N,Shah R S,Sedergran D J.Clinicopathologic study of dextran sulfate sodium experimental murine colitis[J].Lab invest,1993,69:238-249. |
| [11] | Wickenden A D.Overview of Electrophysiological Techniques[J].Curr Protoc Pharmacol,2001,1:1101-1103. |
| [12] | Mawe G M,Strong D S,Sharkey K A.Plasticity of enteric nerve functions in the inflamed and postinflamed gut[J].Neurogastroenterol Motil,2009,21:481-491. |
| [13] | Camoglio L,te Velde A A,de Boer A,tenkate F J,Kopf M,van Deventes S J.Hapten‐induced colitis associated with maintained Th1 and inflammatory responses in IFN-γ receptor-deficient mice[J].Eur J immunol,2000,30:1486-1495. |
| [14] | Beyak M J,Ramji N,Krol K M,Kawaja M D,Vanner S J.Two TTX-resistant Na+ currents in mouse colonic dorsal root ganglia neurons and their role in colitis-induced hyperexcitability[J].Am J Physiol Gastrointest Liver Physiol,2004,287:G845-G855. |
| [15] | Moore B A,Stewart T M R,Hill C,Kawabata A.TNBS ileitis evokes hyperexcitability and changes in ionic membrane properties of nociceptive DRG neurons[J].Am J Physiol Gastrointest Liver Physiol,2002,282:G1045-G1051. |
| [16] | Matsunami M,Kirishi S,Okui T,et al.Hydrogen sulfide-induced colonic mucosal cytoprotection involves T-type calcium channel-dependent neuronal excitation in rats[J].J Physiol Pharmacol,2012,63:61. |
| [17] | Yang X,Han J,Liu R.Effects of experimental colitis on the expressions of calcitonin gene-related peptide and vanilloid receptor 1 in rat spinal cord sensory neurons[J].Shang Li Xue Bao,2008,60:143-148. |
 2014, Vol. 35
2014, Vol. 35


