2. 第二军医大学长海医院消化内科, 上海 200433
2. Department of Gastroenterology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
缩窄性心包炎(constrictive pericarditis,CP)是指各种原因导致心包纤维性增厚、钙化,使心脏舒张期充盈受限而产生的一系列循环障碍综合征[ 1,2,3,4,5 ]。我们发现心包间质细胞(pericardial interstitial cells,PICs)生物学行为的改变是导致CP的中心环节,其主要机制就是心包间质细胞在致病因素的作用下向成肌纤维细胞、成骨细胞转分化以及凋亡[ 6,7 ]。 国内外关于PICs体外分离培养方法的报道尚少,本研究在现有组织间质细胞培养方法[ 8,9,10 ]的基础上,建立较为高效的人原代PICs分离、培养及鉴定方法,为今后研究提供有效的体外细胞应用模型。
1 材料和方法 1.1 主要试剂
Ⅱ型胶原酶、透明质酸酶、胰蛋白酶、四甲基偶氮唑盐(MTT)、二甲亚砜(DMSO)、碘化丙啶(PI)、RNA酶均购自美国Sigma公司;细胞培养相关DMEM培养基、FBS、磷酸盐缓冲液(PBS)、青霉素-链霉素抗生素均购于美国Invitrogen公司;细胞培养玻片购自于美国Thermo Scientific公司;免疫组织化学抗体:细胞角蛋白(CK)、波形蛋白(vimentin)、α-平滑肌肌动蛋白(α-SMA)以及二抗均购自福州迈新生物技术开发有限公司,流式细胞检测CD34、CD45抗体购自于美国BD公司。
1.2 主要仪器移液器系列为法国Gilson公司产品,冷冻水平离心机(Sorvall ST16R,美国Thermo Scientific公司),温控培养摇床(SCS-24,上海市离心机械研究所),倒置相差显微镜(Olympus IX70,日本Olympus公司),正置显微镜(Olympus BX60,日本Olympus公司),二氧化碳培养箱(Heraeus BB5060,德国Heraeus公司),流式细胞仪(BD FACSCalibur,美国BD公司),酶联免疫检测仪(ELx800,德国BioTeK公司)。
1.3 取材取2013年1月至2013年4月在本院胸心外科进行心脏瓣膜直视手术患者的心包组织,年龄3~60岁(平均年龄44.3岁),标本取材均获患者知情授权同意。获取大小约为3.0 cm×1.0 cm×1.0 cm的正常心包组织,置于无血清DMEM培养液中备用。
1.4 心包组织修剪及酶消化在细胞培养室将获取的心包组织放在超净台中进行实验,用含100 U/mL青霉素和100 μg/mL链霉素的PBS液反复漂洗3次,眼科剪去除血凝块与脂肪等无关组织;待PBS液清澈后,在细胞培养皿内将心包组织剪切成约1 mm×1 mm×1 mm大小的组织块,用PBS液洗涤2次后备用。加入10 mL无血清DMEM培养液配制的组织消化液(内含1 mg/mL的Ⅱ型胶原酶与1 mg/mL的透明质酸酶),将组织悬液吸取至50 mL离心管中,在37℃、200次/min温控培养摇床内振荡2 h后,加入10 mL无血清DMEM培养液配制的2 mg/mL胰蛋白酶,37℃、200次/min温控培养摇床内振荡继续作用30 min。消化结束后,加入含10%FBS的DMEM培养液20 mL中和组织消化悬液,通过不锈钢筛网(200目)过滤后,以25℃、400×g离心10 min,弃上清,加入含10%FBS的DMEM 培养液1 mL,轻柔吹打混匀后吸取移入到6孔细胞培养板中,37℃、5%CO2细胞培养箱中培养,每3 d换液1次。次日可见细胞贴壁伸展趋势,10 d左右细胞局部生长达到90%融合,进行传代培养。
1.5 细胞的传代及形态学特征观察
用PBS液洗涤1次,加入0.25%胰蛋白酶(其中含0.53 mmol/L EDTA)0.5 mL消化1~3 min。当在倒置相差显微镜下观察到超过85%的细胞趋向圆形及细胞间隙增大,加入含10%FBS的DMEM 培养液中和,轻柔吹打使半贴壁细胞脱落并成为单细胞悬液,以25℃、400×g离心5 min,弃上清,按细胞数1∶3比例传代至直径为10 cm的细胞培养皿中,置入37℃、5%CO2细胞培养箱中培养,为P1代细胞。每3 d换液1次,当细胞达到85%融合后传代。本实验中细胞传至第5代。
1.6 流式细胞术检测细胞表面标记物CD34与CD45表达将P1、P3、P5代培养的细胞用0.25%胰蛋白酶(含0.53 mmol/L EDTA)消化并收集细胞,PBS洗涤2次,调整细胞密度为2×105个/mL,每管细胞为500 μL。将5 μL CD34-FITC与5 μL CD45-PE加入同一管细胞管检测,同时设同型对照,37℃避光孵育30 min,PBS洗涤3次后,重悬于500 μL PBS,上流式细胞仪检测。
1.7 免疫细胞化学检测CK、vimentin、α-SMA表达将P5代处于对数生长期的PICs制备成单细胞悬液,调整细胞密度为1×105个/mL,以每孔1 mL接种于12孔细胞培养板(内置直径为18 mm的圆型培养盖玻片),置入37℃、5%CO2细胞培养箱中培养,间隔3 d换液1次。7 d左右可观察到细胞均匀覆盖于盖玻片上,将载有细胞的盖玻片从孔板中取出,PBS液冲洗3次,4%多聚甲醛(含0.1 mol/L PBS)固定10 min,PBS液冲洗3次,0.5% Triton X-100处理30 min,PBS液冲洗3次,分别滴加CK抗体(1∶50)、vimentin抗体(1∶50)、α-SMA抗体(1∶50),以PBS代替一抗作为阴性对照,以SP染色法进行染色,苏木精衬染,中性树脂封片,镜下观察细胞染色情况。
1.8 细胞倍增时间的测定
将P1、P3、P5代处于对数生长期的PICs制备密度为1×104个/mL细胞悬液,以每孔200 μL接种至96孔板中,于24 h与96 h两个时间点采用MTT法来测定细胞增殖活性:每孔加入30 μL MTT(5 mg/mL)后置于37℃、5%CO2细胞培养箱中培养4 h。吸弃MTT上清液并每孔加入150 μL的DMSO,室温下100次/min振荡10 min使紫色结晶物充分溶解,用酶联免疫检测仪读取各组细胞测定孔570 nm处的光密度(D)值。细胞倍增时间(DT)计算公式为:DT=t×[lg2/(lgNt-lgN0)],其中t为培养时间,Nt为培养t时间后的D值,N0为接种后D值。
1.9 细胞周期分析将P1、P3、P5代处于对数生长期的细胞制备成密度为1×105个/mL的细胞悬液,取1 mL离心后弃上清,PBS液洗涤2次,重悬于70%乙醇(-20℃预冷)固定细胞,4℃放置24 h后离心弃上清,PBS液洗涤2次,加入0.5 mL PI(50 μg/mL,内含50 μg/mL的RNA酶)染色30 min避光保存,上流式细胞仪分析。
1.10 统计学处理应用SPSS 19.0 统计软件进行数据分析,均数比较采用单因素方差分析(ANOVA),检验水准(α)为0.05。
2 结 果 2.1 细胞培养效率获取心脏直视手术患者的心包组织10例,对其分离培养后,其中8例获得可用于实验的PICs。 2.2 细胞形态学观察
在倒置显微镜下观察,分离培养的细胞接种后24 h可见大部分细胞贴壁,细胞未完全伸展(图 1A);但培养3 d后PICs逐渐伸出突起、伸展呈梭形并开始进行增殖(图 1B);10 d后细胞生长近90%融合,细胞核明显、核仁清晰、核质比例大,此时可进行细胞传代(图 1C)。自细胞P1代传至P5代,细胞呈梭形或纺锤形外观(图 1D~1F)。
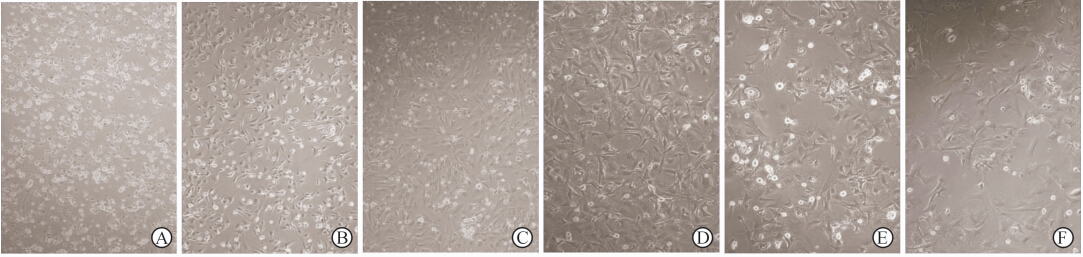
|
图 1 倒置相差显微镜下PICs形态观察 Fig 1 Morphology of pericardial interstitial cells(PICs) under inverted microscope A-C:P0 cells; D: P1 cells; E: P3 cells; F: P5 cells; A,D: Culture for 1 days; B,E: Culture for 3 days; C,F: Culture for 10 days.Original magnification:×100 |
CD34为内皮细胞标记物,CD45为髓源性细胞标记物。检测结果显示分离培养的细胞表面CD34、CD45均为阴性,表明本实验中分离培养的细胞不属于内皮细胞或髓源性细胞。
2.4 CK、vimentin、α-SMA抗体细胞免疫组织化学检测结果分离、培养的P5代细胞,免疫组织化学检测显示CK染色为阴性,细胞无着色,说明细胞非间皮源性细胞(图 2A);vimentin染色为阳性,细胞质均为稍浅棕褐色,说明细胞属于间叶组织来源(图 2B);α-SMA染色为阳性,细胞质均为稍深棕褐色,细胞质内阳性颗粒均匀分布,细胞膜染色不明显,细胞核清晰且苏木精衬染为浅蓝色(图 2C)。以上结果表明本研究培养的细胞为PICs。

|
图 2 PICs免疫组织化学染色 Fig 2Immunohistochemical staining of pericardial interstitial cells(PICs) A: CK(-); B: Vimentin(+); C: α-SMA(+). Original magnification:×100 |
本研究培养的P1、P3、P5 代PICs之间倍增时间差异无统计学意义。
2.6 细胞周期检测结果流式细胞术检测结果显示,培养的P1、P3、P5 代PICs中S~G2/M期细胞比例之间无明显差异,且细胞有稳定良好的增殖能力(图 3)。
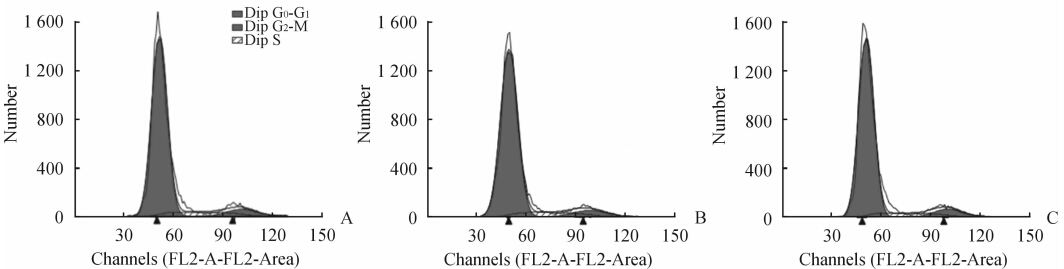
|
图 3 流式细胞术检测PICs周期 Fig 3 Cell cycle of pericardial interstitial cells(PICs) by flow cytometry A: P1 cell,S-G2/M 15.77%; B: P3 cell,S-G2/M 15.67%; C: P5 cell,S-G2/M 16.18% |
CP病因复杂,结核、化脓菌感染、心脏损伤、类风湿关节炎等均可引起心包进行性粘连、纤维性增厚和钙化,从而使心脏的收缩和舒张受限、心功能减退[ 1,2,3,4,5 ]。近年来,结核性和化脓性CP在逐渐减少,而特发性及与心脏损伤(手术、外伤)等导致的CP比例逐年上升。有报道称特发性缩窄性心包炎(idiopathic constrictive pericarditis,ICP)可占发达国家所有心包炎手术的46%[ 10 ];而随着心脏直视手术的大量开展,心脏损伤后缩窄性心包炎(post-cardiac-injury constrictive pericarditis,PCP)也有所增加,有报道称由心脏手术引起的CP达总量的18%~37%,且这一比例仍在逐年增加[ 11,12,13,14 ]。
近年来,国内外学者对特发性和心脏损伤后缩窄性心包炎(IAPCP)的发病机制和预防进行了深入研究,Afanasyeva等[ 15 ]敲除干扰素γ后成功构建ICP小鼠模型,呈现出CP的典型临床表现:心输出量下降、心室腔舒张僵硬、心室在舒张期充盈受限;组织学证实心包壁炎症浸润并有明显的纤维化病灶。因而心包纤维和(或)钙化是IAPCP缩窄症状发生发展的关键环节。本实验旨在高效地建立人原代PICs体外应用模型,以此研究心包纤维钙化的发病机制,应用细胞干预寻找延缓甚至是逆转心包纤维钙化的方法,为临床有效防治CP提供药物靶点和理论依据。
前期研究中我们应用组织块贴壁法分离培养PICs[ 6,7 ]。但该方法培养周期较长,近组织周边细胞生长密度过高,远端细胞稀疏,生长至1周左右就需要传代,否则细胞局部稠密易加速衰老或提前凋亡;组织块贴壁法效率为80%,大多数组织都在贴壁过程中被浪费,所获PICs达不到实验所需数量。本实验所采取的Ⅱ型胶原酶和透明质酸酶混合消化液并联合胰蛋白酶作用消化心包组织,一次性分离获得一定量的初代PICs,然后同步扩增培养,较短时间内可获得足够量供研究的PICs。
本实验选用Ⅱ型胶原酶和透明质酸酶混合消化液联合胰蛋白酶作用消化心包组织获得原代PICs。接种后初代细胞贴壁快,24 h细胞就可贴壁伸展,10 d左右细胞趋于融合,可开始传代。为了提高细胞的获得率,需注意以下两点:(1)选择温控培养摇床振荡频率在37℃、200次/min、2 h,可使心包组织充分消化,增加细胞的获取比例。但时间不宜过长,过长会降低细胞活性;应用消化液中酶的浓度适中,过高则细胞活性降低,过低则细胞获得率不高。(2)务必将心包组织修剪成细小组织块,再次应用PBS液漂洗,如果剪切不够均匀、细小,将会直接影响消化效果,降低PICs的获得率。
在初期实验中,我们设计采用磁珠或流式分选去除内皮细胞与髓源性细胞,但随后流式CD34(内皮细胞的标记物)与CD45(髓源性细胞的标记物)检测发现均为阴性,证实本实验中分离培养的细胞不属于内皮细胞或髓源性细胞,因而本实验不再进行分选,只进行流式检测,以证实获得细胞即为PICs。此外,我们通过细胞免疫表型进一步证实所培养的细胞不是间皮细胞(CK+,vimentin-)、内皮细胞(CD34+,vimentin-)和血细胞(CD45+,vimentin-)。在细胞传代的后期(P5代),我们还发现α-SMA表达阳性,表明在传代过程中PICs能够自发性地向成肌纤维细胞转化,提示在探讨致病因素作用于PICs的实验研究中应采用早期分离的PICs(P1~P3代细胞)。
总之,本实验首次应用Ⅱ型胶原酶和透明质酸酶混合消化液并联合胰蛋白酶作用消化心包组织,加以温控培养摇床振荡的实验方法,有效地获得了大量的PICs。通过细胞的形态学观察、倍增时间测定、细胞周期检测及免疫组化染色鉴定,证实本方法分离、培养的PICs生长较良好,增殖能力较强,特征典型,这为今后进一步研究该细胞的生物学特性以及CP的体外研究提供了良好的细胞应用模型。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Oh J K,Tajik A J,Appleton C P,Hatle L K,Nishimura R A,Seward J B. Preload reduction to unmask the characteristic Doppler features of constrictive pericarditis. A new observation[J].Circulation,1997,95:796-799. |
| [2] | Myers R B,Spodick D H.Constrictive pericarditis: clinical and pathophysiologic characteristics[J].Am Heart J,1999,138(2 Pt 1):219-232. |
| [3] | Little W C,Freeman G L.Pericardial disease[J].Circulation,2006,113:1622-1632. |
| [4] | Kabbani S S,LeWinter M M.Pericardial diseases[J].Curr Treat Options Cardiovasc Med,2002,4:487-495. |
| [5] | Kabbani S S,LeWinter M M.Diastolic heart failure.Constrictive,restrictive,and pericardial[J].Cardiol Clin,2000,18:501-509. |
| [6] | Liu X,Bai C,Gong D,Yuan Y,Han L,Lu F,et al. Pleiotropic effects of transforming growth factor-β1 on pericardial interstitial cells.Implications for fibrosis and calcification in idiopathic constrictive pericarditis[J].J Am Coll Cardiol,2011,57:1634-1635. |
| [7] | Liu X,Tan M,Gong D,Han L,Lu F,Huang S,et al.Characteristics of pericardial interstitial cells and their implications in pericardial fibrocalcification.[J].J Mol Cell Cardiol,2012,53:780-789. |
| [8] | 刘延玲,刘晓红,龚德军,袁扬,陶婧,黄盛东,等.钙化性主动脉瓣疾病瓣膜间质细胞的生物学特征分析[J].第二军医大学学报,2011,32:617-621. Liu Y L,Liu X H,Gong D J,Yuan Y,Tao J,Huang S D,et al.Biological characteristics of vavular interstitial cells in calcific aortic value disease[J].Acad J Sec Mil Med Univ,2001,32:617-621. |
| [9] | 张米,刘晓红,张伯尧,韩林,陆方林,张锡武,等.人主动脉瓣间质细胞原代培养及体外钙化模型的建立[J].第二军医大学学报,2013,34:488-492. Zhang M,Liu X H,Zhang B Y,Han L,Lu F L,Zhang X W,et al.Primary culture and in vitro calcification model establishment of human aortic value interstitial cells[J].Acad J Sec Mil Med Univ,2013,34:488-492. |
| [10] | 李春穴,童卫东,刘宝华,张连阳,张安平.Cajal间质细胞的分离、培养方法探讨[J].消化外科,2004,3:267-269. |
| [11] | Bertog S C,Thambidorai S K,Parakh K,Schoenhagen P,Ozduran V,Houghtaling P L,et al.Constrictive pericarditis: etiology and cause-specific survival after pericardiectomy [J].J Am Coll Cardiol,2004,43:1445-1452. |
| [12] | Ling L H,Oh J K,Schaff H V,Danielson G K,Mahoney D W,Seward J B,et al.Constrictive pericarditis in the modern era: evolving clinical spectrum and impact on outcome after pericardiectomy[J].Circulation,1999,100:1380-1386. |
| [13] | Cimino J J,Kogan A D.Constrictive pericarditis after cardiac surgery: report of three cases and review of the literature[J].Am Heart J,1989,118:1292-1301. |
| [14] | Bansal R,Perez L,Razzouk A,Wang N,Bailey L.Pericardial constriction after cardiac transplantation[J].J Heart Lung Transplant,2010,29:371-377. |
| [15] | Afanasyeva M,Georgakopoulos D,Fairweather D,Caturegli P,Kass D A,Rose N R.Novel model of constrictive pericarditis associated with autoimmune heart disease in interferon-gamma-knockout mice[J].Circulation,2004,110:2910-2917. |
 2014, Vol. 35
2014, Vol. 35


