p21活化激酶(p21-activated kinase,Pak)是一类胞内丝/苏氨酸蛋白激酶,是Rho家族小GTP酶Rac1和Cdc42下游的主要靶蛋白,在生物体发育及疾病的产生和发展过程中都起着重要的作用[1]。Pak1是第1个被克隆和验证的Pak家族成员[2],在胞内被激活后,通过磷酸化相应的底物介导Erk[3]、PI3K/Akt[4]、MAPK[5]等多条通路的信号转导,参与调控多种细胞生物学过程,对肿瘤的生长和侵袭[1]、神经系统疾病和发育[6]、心脏收缩和电传导[7]、病毒感染[8]、机体代谢[9]等都有重要影响。近年来,有研究发现Pak1是内皮细胞特异高表达的微小RNA-126(microRNA-126,miR-126)的靶分子,而后者参与调节胚胎发育过程中血管内皮的完整性[10],因此推测Pak1影响血管发育,但是对其具体作用和机制尚不明确。本研究用斑马鱼在体水平过表达Pak1,观察其对胚胎血管新生的影响,并通过体外培养的内皮细胞初步分析其相关机制,为进一步探索Pak1在血管发育中的作用提供线索。 1 材料和方法 1.1 材料、试剂及仪器
组成激活型Pak1(constitutively active Pak1,caPak1)的重组过表达质粒PCS2-caPak1和SP6 RNA聚合酶由中国科学院上海生命科学研究院健康科学研究所提供; 野生型斑马鱼及人脐静脉内皮细胞株(human umbilical vein endothelial cell,HUVEC)由第二军医大学长海医院心血管内科实验室保存; 内皮细胞培养基、青链霉素、内皮生长因子购自ScienCell公司; 胰蛋白酶购自Gibco公司; TRIzol、Lipofectamine LTX购自Invitrogen公司; 限制性内切酶、PrimeScriptTM RT反应试剂盒、SYBR® Premix Ex Taq定量PCR检测试剂购自大连宝生物工程有限公司; 膜联蛋白Ⅴ(Annexin Ⅴ)购自eBioscience公司; 7-氨基放线菌素D(7-amino-actinomycin D,7-AAD)购自Molecular Probes公司。主要实验仪器:无菌超净工作台(上海淀山湖净化设备厂),CO2细胞培养箱(美国谢尔登公司),电热恒温水槽(上海精宏实验设备有限公司),旋涡混合器(江苏海门其林贝尔仪器制造有限公司),双通道实时荧光定量PCR仪(美国Corbett公司),倒置显微镜(日本Olympus公司),垂直电泳仪(美国Bio-Rad公司),低温离心机(日本Hitachi公司),流式细胞仪(美国BD公司)。 1.2 斑马鱼水平实验 1.2.1 目的片段mRNA合成 用限制性内切酶Not Ⅰ对重组过表达质粒进行单酶切,取5 μL酶切产物电泳,确认质粒线性化后,用酚-氯仿沉淀酶切产物,而后根据SP6 RNA聚合酶试剂盒的说明,将caPak1体外转录为mRNA,稀释、分装后于-80℃保存。 1.2.2 过表达Pak1
野生型斑马鱼进行交配,收集并选择单细胞期胚胎,固定于注射板上,调试显微注射仪,根据注射压、平衡压及注射针尖大小,调节注射剂量,将caPak1 mRNA注入胚胎细胞内,以注射等量双蒸水的胚胎作为对照。28℃恒温孵育,于倒置显微镜下观察胚胎发育至受精后72 h,记录胚胎表型变化和异常表型出现比例。同时用蛋白质印迹法检测Pak1的蛋白水平变化,以验证是否成功过表达。 1.2.3 血管壁超微结构观察
出现大体表型异常的胚胎用2.5%戊二醛溶液固定,缓冲液漂洗后,用不同浓度的乙醇溶液梯度脱水,而后用环氧树脂包埋胚胎组织,经超薄切片机切片,在光学显微镜下确定损伤血管的部位和观察范围,对切片进行染色后,在透射电镜下观察血管壁和内皮细胞的超微结构。 1.3 细胞水平实验 1.3.1 过表达Pak1
用含有1%青链霉素、5%内皮生长因子的内皮细胞培养液培养HUVEC,传代后接种于12孔板中,待细胞长至80%~90%融合度后,按Lipofectamine LTX转染试剂说明将PCS2-caPak1转入HUVEC细胞,以加入相同浓度脂质体溶液的细胞作为对照。观察细胞形态学改变。转染48 h后,每孔加入1 mL TRIzol提取细胞内总RNA,按TaKaRa反转录试剂盒说明反转录成cDNA,反应体系10 μL,反应条件:25℃ 5 min; 42℃ 15 min; 85℃ 90 s。以上述反应所得的cDNA为模板,用Primer 3.0软件设计特异性定量引物,检测细胞内Pak1的表达水平。上游引物序列: 5′-ACA GCC AGA AAT ACA TGA GCT TT-3′,下游引物序列: 5′-GCC TTC ACA TTC AAG GCA TTA-3′,反应体系20 μL。反应条件:95℃ 1 min; 94℃ 15 s,60℃ 15 s,72℃ 10 s,共40个循环。 1.3.2 细胞活力检测
HUVEC按每孔104个细胞的密度接种到96孔板中,用Lipofectamine LTX将PCS2-caPak1转入细胞,对照组处理同前,并设置无细胞调零孔。转染48 h后,每孔加入20 μL浓度为5 mg/mL的四甲基偶氮唑盐(MTT)溶液,继续培养4 h,继而吸出培养液,加入150 μL 二甲亚砜,室温震荡10 min充分显色,在酶标仪上测出其在492 nm处的光密度值。 1.3.3 细胞凋亡检测
将HUVEC按每孔2×105个细胞的密度接种到无菌6孔板内,转染方法同前,转染后48 h用0.05%的胰蛋白酶消化,离心收集细胞,用预冷的PBS洗涤2次,用1×结合缓冲液调节细胞密度为1×106/mL,取100 μL细胞悬液,加入5 μL Annexin Ⅴ,轻轻混匀后再加入10 μL 7-AAD,避光反应15 min,而后加入400 μL 1×结合缓冲液,用流式细胞仪检测细胞凋亡情况。 1.4 统计学处理
用SPSS 18.0软件进行统计学分析,两组计量资料的比较采用独立样本t检验,发生率的比较采用χ2检验。检验水准(α)为 0. 05。 2 结 果 2.1 过表达Pak1对斑马鱼胚胎发育的影响
对斑马鱼单细胞期胚胎注射caPak1 mRNA,观察胚胎发育。与对照组(图 1A)相比,过表达Pak1组大体发育未见明显差异,两组畸形率和死亡率相似,但过表达Pak1组胚胎发育至30~36 h时出现明显的颅内出血(图 1B),出血比例约25%~30%。继续观察胚胎发育,至受精后60 h左右,过表达Pak1组出血逐渐减少,出血胚胎均可成活。用蛋白质印迹法检测过表达情况,发现Pak1蛋白水平升高 (图 2)。
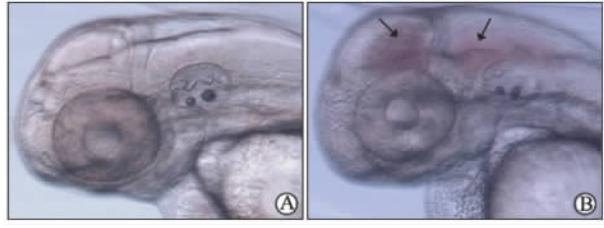 | 图 1 斑马鱼胚胎过表达Pak1造成头部出血 Fig 1 Overexpression of Pak1 in zebrafish embryos caused cerebral hemorrhage A: Embryos injected with ddH2O; B: Embryos injected with caPak1 mRNA. Black arrows indicate hemorrhage |
 | 图 2 斑马鱼胚胎过表达Pak1(蛋白质印迹结果) Fig 2 Overexpression of Pak1 protein in zebrafish embryos as detected by Western blotting analysis 1: Embryos injected with ddH2O; 2: Embryos injected with caPak1 mRNA |
对出血胚胎和对照组胚胎进行固定和头部组织切片,用透射电镜观察超微结构,如图 3所示,发现出血胚胎头部血管管腔存在, 大小正常,但血管壁结构发生改变,主要表现为血管内皮细胞肿胀,细胞膜卷曲,染色质稀疏,胞内出现空泡和颗粒,细胞间连接模糊不清。对照组血管内皮细胞形态规则,胞膜完整,细胞间连接紧密,细胞器分布均匀,无明显空泡。
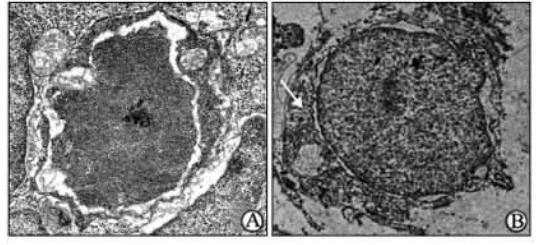 | 图 3 透射电镜下斑马鱼胚胎头部血管 Fig 3 Intracerabral vessels of zebrafish embryos under transmission electron microscope A: Embryos injected with ddH2O; B: Embryos injected with caPak1 mRNA. The white arrow indicates the endothelial cell. Original magnification: × 20 000 |
通过脂质体转染的方法将PCS2-caPak1转入HUVEC,用倒置显微镜观察细胞形态,发现细胞出现变圆、缩小、部分脱落等凋亡改变(图 4B)。转染后48 h提取细胞总RNA、反转录成cDNA并用定量PCR检测Pak1过表达情况,结果显示转染重组过表达质粒的细胞内Pak1表达水平较对照组升高(P<0.01,图 5)。MTT法和流式细胞术检测显示,过表达Pak1组存活的细胞明显减少(P<0.01,图 6),凋亡细胞明显增加(P<0.01,图 7)。
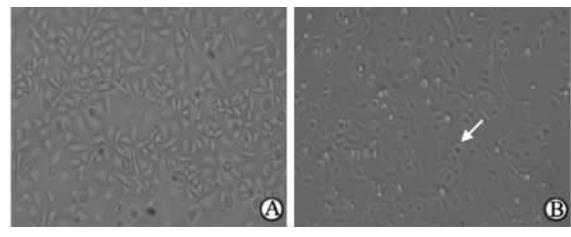 | 图 4 光镜下HUVECs形态学改变 Fig 4 Morphological changes of HUVECs under optical microscope A: HUVECs treated with Lipofectamine LTX; B: HUVECs transfected with PCS2-caPak1. The white arrow shows the cell with morphological change, rounded up and detached from the plate HUVECs: Human umbilical vein endothelial cells. |
 | 图 5 定量PCR检测HUVECs内Pak1表达水平 Fig 5 Pak1 expression level in HUVECs as detected by real-time PCR HUVECs: Human umbilical vein endothelial cells. Control: HUVECs treated with Lipofectamine LTX; caPak1: HUVECs transfected with PCS2-caPak1. **P<0.01 vs control. n=3, ±s |
 | 图 6 MTT法检测HUVECs细胞活力 Fig 6 Viability of HUVECs as detected by MTT assay HUVECs: Human umbilical vein endothelial cells. Control: HUVECs treated with Lipofectamine LTX; caPak1: HUVECs transfected with PCS2-caPak1. **P<0.01 vs control. n=3, ±s |
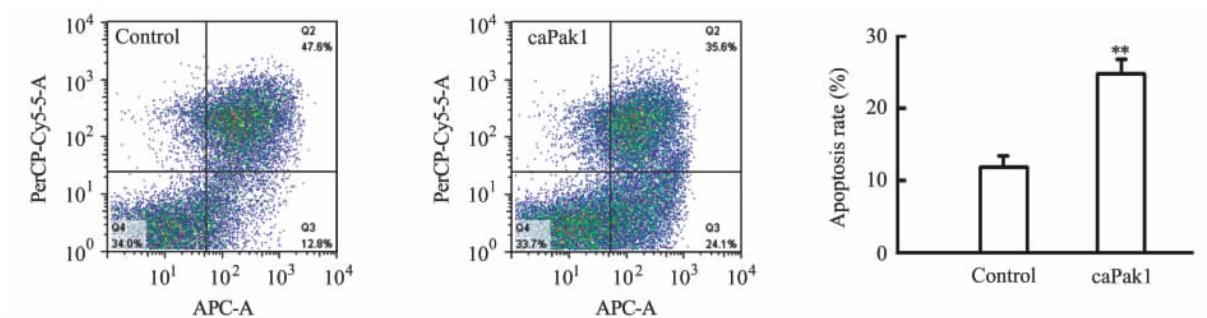 | 图 7 流式细胞术检测HUVECs凋亡 Fig 7 Apoptosis of HUVECs as detected by flow cytometry HUVECs: Human umbilical vein endothelial cells. Apoptosis analysis of HUVECs labeled with Annexin Ⅴ (APC channel) and 7-AAD (PerCP channel). Control: HUVECs treated with Lipofectamine LTX; caPak1: HUVECs transfected with PCS2-caPak1. **P<0.01 vs control. n=3, ±s |
Pak1是Rho家族小GTP酶Cdc42和Rac的一个主要下游效应子[11],作为一种胞内丝/苏氨酸蛋白激酶,Pak1广泛分布于机体各种组织和细胞,充当将胞外信号转换为胞内反应的重要信使,参与细胞增殖、凋亡、迁移等多种细胞病理生理过程的调控,与肿瘤、阿尔茨海默病、哮喘、2型糖尿病、结节性硬化、癫 等多种疾病的发展和预后相关[12]。 然而,目前对Pak1在正常发育尤其是血管发育和血管新生中的作用研究较少,Zou等[10]发现Pak1是内皮细胞特异高表达的miR-126的靶基因,而后者参与调控胚胎发育中的血管完整性,从而推测Pak1也可能影响胚胎血管发育,但是对其具体作用和机制尚未进一步阐明。
为了研究Pak1在血管发育中的作用,我们分别在斑马鱼水平和细胞水平过表达Pak1,观察其对胚胎血管新生和体外培养的血管内皮细胞生长的影响。重组过表达质粒PCS2-caPak1所携带的caPak1是将野生型氨基酸序列第423位的苏氨酸突变为谷氨酸[10],使其具有持续活化的激酶活性,可以实现有功能的Pak1的过表达。本研究通过胚胎显微注射的方法在斑马鱼整体水平过表达Pak1,发现胚胎血管发育早期即可出现颅内出血,而在这一发育期,斑马鱼头部血管主要由内皮细胞和基底膜形成,基底膜下尚无周细胞包围,因此我们推测Pak1可能主要通过影响血管内皮完整性和(或)通透性而造成相应表现。随着胚胎发育至受精60 h以后,头部出血逐渐减轻,出血胚胎可继续存活,一方面可能与该时期基底膜修复和周细胞发育弥补了内皮细胞的缺损有关,另一方面可能由于我们注射的是 caPak1 mRNA,只能实现目的基因的瞬时过表达,随着胚胎的继续发育,活化的Pak1水平逐渐降至正常,对细胞功能的一过性影响减小直至消失。
影响血管内皮完整性和通透性的主要因素有:内皮细胞增殖减少[13]、凋亡增多[14]、内皮细胞收缩[15]、内皮间连接改变[16]等。我们对出血胚胎和对照组胚胎进行固定和组织切片,在透射电镜下进一步确认血管结构,结果发现出血胚胎血管内皮细胞明显破坏,因此我们推测斑马鱼水平过表达Pak1可能通过诱导内皮凋亡而引起胚胎头部出血。
为了进一步证实在动物水平的发现,我们通过脂质体转染的方法,在体外培养的HUVEC内过表达Pak1, 结果发现过表达Pak1细胞体积缩小、变圆,并出现部分脱落等形态学改变,用MTT法检测细胞活力,发现过表达 Pak1后存活的内皮细胞数量减少,而用Annexin Ⅴ/7-AAD双染色法结合流式细胞术分析,可见过表达组细胞凋亡增加。以上结果均提示,在HUVEC水平过表达Pak1可诱导内皮细胞凋亡。
我们的研究结果表明,Pak1过表达影响胚胎血管发育,Pak1持续激活可能通过诱导内皮细胞凋亡而影响胚胎早期血管新生。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Eswaran J, Li D Q, Shah A, Kumar R.Molecular pathways:targeting p21-activated kinase 1 signaling in cancer——opportunities, challenges, and limitations[J].Clin Cancer Res, 2012, 18:3743-3749. |
| [2] | Parrini M C.Untangling the complexity of PAK1 dynamics:the future challenge[J].Cell Logist, 2012, 2:78-83. |
| [3] | Wang Z, Fu M, Wang L, Liu J, Li Y, Brakebusch C, et al.p21-activated kinase 1 (PAK1) can promote ERK activation in a kinase-independent manner[J].J Biol Chem, 2013, 288:20093-20099. |
| [4] | Walsh K, McKinney M S, Love C, Liu Q, Fan A, Patel A, et al.PAK1 mediates resistance to PI3K inhibition in lymphomas[J].Clin Cancer Res, 2013, 19:1106-1115. |
| [5] | Qing H, Gong W, Che Y, Wang X, Peng L, Liang Y, et al.PAK1-dependent MAPK pathway activation is required for colorectal cancer cell proliferation[J].Tumour Biol, 2012, 33:985-994. |
| [6] | Li S, Leshchyns'ka I, Chernyshova Y, Schachner M, Sytnyk V.The neural cell adhesion molecule (NCAM) associates with and signals through p21-activated kinase 1 (Pak1)[J].J Neurosci, 2013, 33:790-803. |
| [7] | Kelly M L, Astsaturov A, Chernoff J.Role of p21-activated kinases in cardiovascular development and function[J].Cell Mol Life Sci, 2013, 70:4223-4228. |
| [8] | Van den Broeke C, Radu M, Chernoff J, Favoreel H W.An emerging role for p21-activated kinases (Paks) in viral infections[J].Trends Cell Biol, 2010, 20:160-169. |
| [9] | Chiang Y T, Jin T.P21-activated protein kinases and their emerging roles in glucose homeostasis[J].Am J Physiol Endocrinol Metab, 2013 Dec 24.[Epub ahead of print] |
| [10] | Zou J, Li W Q, Li Q, Li X Q, Zhang J T, Liu G Q, et al.Two functional microRNA-126s repress a novel target gene p21-activated kinase 1 to regulate vascular integrity in zebrafish[J].Circ Res, 2011, 108:201-209. |
| [11] | Shin Y J, Kim E H, Roy A, Kim J H.Evidence for a novel mechanism of the PAK1 interaction with the Rho-GTPases Cdc42 and Rac[J].PLoS One, 2013, 8:e71495. |
| [12] | Maruta H.Herbal therapeutics that block the oncogenic kinase PAK1:a practical approach towards PAK1-dependent diseases and longevity[J].Phytother Res, 2013 Aug 14.doi:10.1002/ptr.5054.[Epub ahead of print] |
| [13] | Toblli J E, Cao G, Giani J F, Angerosa M, Dominici F P, Gonzalez-Cadavid N F.Antifibrotic effects of pioglitazone at low doses on the diabetic rat kidney are associated with the improvement of markers of cell turnover, tubular and endothelial integrity, and angiogenesis[J].Kidney Blood Press Res, 2011, 34:20-33. |
| [14] | MLüller H C, Hocke A C, Hellwig K, Gutbier B, Peters H, SchLönrock S M, et al.The Sphingosine-1 Phosphate receptor agonist FTY720 dose dependently affected endothelial integrity in vitro and aggravated ventilator-induced lung injury in mice[J].Pulm Pharmacol Ther, 2011, 24:377-385. |
| [15] | Rudzinski P, Wegrzyn P, Lis G J, Piatek J, Konstanty-Kalandyk J, Nosalski R, et al.Vasodilatory effect and endothelial integrity in papaverine-and milrinone-treated human radial arteries[J].J Physiol Pharmacol, 2013, 64:41-45. |
| [16] | Rehm K, Panzer L, van Vliet V, Genot E, Linder S.Drebrin preserves endothelial integrity by stabilizing nectin at adherens junctions[J].J Cell Sci, 2013, 126(Pt 16):3756-3769. |
 2014, Vol. 35
2014, Vol. 35


