2. 广州军区广州总医院心血管外科中心, 广州 510010;
3. 第二军医大学长海医院心血管内科, 上海 200433
2. Centre of Cardiovascular Surgery, Guangzhou General Hospital, PLA Guangzhou Military Area Command, Guangzhou 510010, Guangdong, China;
3. Department of Cardiovasology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
自2000年经导管肺动脉瓣置入术(transcatheter pulmonary valve implantation,TPVI)在临床上取得成功[1]以来,全世界已有上千例患者接受了TPVI治疗,中期随访结果满意,发展前景令人振奋[2]。但目前TPVI只能选择生物瓣,而大多数需要行TPVI的患者是年轻患者,生物瓣的衰败导致的二次换瓣势必给患者带来巨大痛苦。高分子材料心脏瓣膜是新型介入心脏瓣膜材料的研究热点,其低致血栓性、高耐久性和容易折叠压缩的特点有望使其替代生物瓣膜成为下一代介入心脏瓣膜的首选,而超微孔膨体聚四氟乙烯(expanded polytetrafluoroethylene,ePTFE)则是新型高分子材料的代表[3,4,5]。 第二军医大学长海医院自主研制了一种以超微孔ePTFE为瓣叶材料的新型自膨式介入肺动脉瓣膜,并通过经右室心尖途径在动物体内原位置换肺动脉瓣,在安全性和有效性方面均取得满意效果,现报告如下。 1 材料和方法 1.1 实验动物
实验用雄性绵羊7只,由上海甲干生物科技有限公司提供,7~10月龄,体质量 (27.2±1.2) kg。驱寄生虫,检疫隔离4周后接受外科手术。 1.2 超微孔ePTFE自膨式介入肺动脉瓣膜的设计
自膨式支架委托北京乐普医疗器械股份有限公司制作,材料为具有形状记忆效应的镍钛合金,设计为酒杯型网状结构。根据绵羊肺动脉解剖,设计支架高35 mm,按腰部直径分为20、22、24 mm 3种型号。瓣叶材料选择厚度0.1 mm的超微孔(纤维结点小于1 μm)ePTFE薄膜(美国W.L. Gore & Associates公司),表面接枝首先以2-甲基丙烯酰氧乙基磷酰胆碱(MPC)和甲基丙烯酸正丁酯(BMA)为原料合成磷酰胆碱(PC)衍生物MPC-BMA,然后通过等离子体表面活化的方法,将MPC-BMA接枝于ePTFE表面。将表面改性后的ePTFE薄膜裁剪成3片瓣叶,将每片瓣叶的两端相互重叠,瓣叶的一端与另一片瓣叶的一端相对放置,沿着瓣叶两端用7-0聚丙烯缝线将瓣膜缝合,然后缝合在支架上形成3个瓣叶,制成带瓣膜支架。支架腰部下段外周以ePTFE薄膜缝制成密封套囊以防止瓣周漏。见图 1。
 | 图 1 超微孔ePTFE自膨式介入肺动脉瓣膜的流出面(A)、侧面(B)和流入面(C)Fig 1 Outflow view (A),lateral view (B),and inflow view (C) of a self-expanding stent containing a trileaflet ultramicroporous ePTFE pulmonary valve ePTFE: Expanded polytetrafluoroethylene |
支架输送装置由输送外鞘、预载内鞘和操作手柄组成。输送外鞘直径为18F。输送外鞘与预载内鞘一体相连,输送外鞘的头端设有硅胶材料制成的圆锥形平滑过渡,便于输送外鞘从心尖穿刺口置入。输送装置后端为操作手柄,通过固定预载内鞘、回撤输送外鞘可释放支架。操作手柄上设有螺杆装置用以准确、精细调节支架释放速度。见图 2。
 | 图 2 超微孔ePTFE自膨式介入肺动脉瓣膜输送系统Fig 2 Delivery system for the self-expanding ultramicroporous ePTFE pulmonary valveePTFE: Expanded polytetrafluoroethylene |
术前禁食12 h,禁水8 h。麻醉前用药: 氯胺酮(10~15 mg/kg,肌内注射);地西泮(0.2 mg/kg,肌内注射);阿托品(0.05 mg/kg,肌内注射)。麻醉诱导: 咪达唑仑( 0.05 mg/kg,静脉注射);芬太尼(2~4 μg/kg,静脉注射);维库溴铵(0.05 mg/kg,静脉注射)。麻醉维持: 芬太尼[1~4 μg/(kg·h)];异丙酚[0.3 mg/(kg·h)]。术中监测心电图、血氧饱和度(SpO2)及无创血压。以自制喉镜和5.5号气管套管进行气管插管。接呼吸机辅助呼吸,潮气量15 mL/kg,呼吸频率18~22次/min,呼气末正压通气(PEEP) 2~3 cmH2O (1 cmH2O=0.098 kPa)。穿刺左侧股静脉,留置6F动脉鞘。
1.5 手术方法绵羊左侧卧位,右前外侧切口,经第4肋间进胸,前端切至胸骨旁2 cm,“L”形切开心包,制作心包吊篮悬吊心脏,暴露右室近心尖处。用5-0聚丙烯线在右室心尖处距前降支5~10 mm处缝合2个荷包,每缝一针用毛毡垫片加固以防心肌撕裂。沿左侧股静脉6F动脉鞘送入猪尾巴导管至肺动脉干,行肺动脉瓣上造影,以确定最佳投射体位、肺动脉瓣环直径及肺动脉瓣的位置(图 3A)。根据肺动脉瓣环直径选择相应大小的支架。将猪尾巴导管退至下腔静脉。穿刺针从荷包中心处向右室流出道方向刺入右室(与冠状面成30°~45°),见回血后退出针芯,沿外套管置入泥鳅短钢丝至肺动脉干远端。退出穿刺针外套管,沿短导丝置入8F动脉鞘至右室流出道。沿8F动脉鞘置入260 cm×0.038英寸(1英寸=2.54 cm)加硬钢丝,并送入左或右肺动脉,保持钢丝原位。退出8F动脉鞘,同时收紧荷包线,经加硬钢丝交换置入预载有带瓣膜支架的18F输送鞘管,沿加硬钢丝将鞘管送入肺动脉,将预留的猪尾巴导管送至右室,进行右室造影,反复确认支架位置正确(图 3B),透视下固定预载鞘,缓慢回退外鞘,释放自膨式带瓣膜支架,退出加硬钢丝和输送鞘管,收紧荷包。再次将猪尾巴导管送入肺动脉干行肺动脉造影判断介入瓣膜有无反流(图 3C),退猪尾巴导管至右室行右室造影判断介入瓣膜有无狭窄(图 3D)。结扎荷包线,关闭心包,止血关胸。
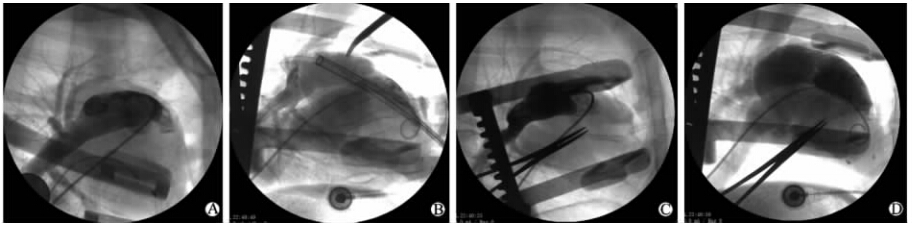 | 图 3 超微孔ePTFE自膨式介入肺动脉瓣膜置入过程(代表图像)Fig 3 Implantation process of self-expanding ultramicroporous ePTFE pulmonary valve (representative images) ePTFE: Expanded polytetrafluoroethylene. A: Image of the pulmonary valve was obtained for the size and location of pulmonary valve; B: After the valved stent was advanced to the pulmonary valve via the 18F sheath,a right ventricular angiography was performed to confirm that the valved stent was at the optimal position; C: A pulmonary angiography showed the correct position of the valved stent in the pulmonary position. No regurgitation was assessed; D: A right ventricular angiography showed no stenosis of the valved stent |
术后给予肌内注射头孢拉定25 mg/kg,1次/12 h,3 d;皮下注射低分子肝素60~80 IU/kg,1次/12 h,1周;口服阿司匹林1 mg/kg,1次/d,实验维持期间;口服华法林钠片6周,国际标准化比值(INR)维持在2.0~2.5。术后10 d拆线,拆线后送回农场喂养。
1.7 超微孔ePTFE自膨式介入肺动脉瓣膜功能评价术前、术后即刻、术后4周通过股静脉途径行右心导管检查,测量右室压力、肺动脉压力及人工瓣膜跨瓣压差。术后即刻通过右心造影和术后4周通过经胸心脏超声对支架瓣膜位置、形状及功能进行评价。
1.8 统计学处理应用SPSS 16.0软件进行统计学分析,计量资料以 ±s表示,采用单因素方差分析,两两比较采用Dunnett法。检验水准(α)为0.05。 2 结 果
7只羊手术均获得成功。通过数字减影血管造影(DSA)测量肺动脉瓣环直径为(18.8±1.1) mm,置入直径20 mm介入瓣膜1个、22 mm介入瓣膜6个。术后即时心血管造影提示支架打开充分,无变形或断裂,人工瓣膜位置满意,无瓣周漏,瓣叶开闭良好,无明显狭窄或关闭不全(图 3C、3D)。术中1只羊支架释放后退鞘管时出现持续性单形性室性心动过速,心率190次/min左右,给予快速静脉推注胺碘酮50 mg后恢复窦性心律,术后恢复正常。1只羊术后出现反复咳嗽,给予抗感染、化痰、叩背等治疗后效果差,术后10 d出现食欲下降、活动减少,术后16 d死亡,尸检提示肺部感染合并人工瓣膜感染性心内膜炎。其余术后无明显并发症。术后随访4周,6只羊存活,状况良好,人工瓣膜评价数据来自这6只羊。术后4周经胸心脏超声(图 4)提示心脏功能及右室大小正常,人工瓣膜开闭正常,无明显血栓或赘生物,测量人工瓣膜直径提示支架无明显压缩变形,彩色多普勒超声提示4只羊无明显反流,2只羊微量反流,人工瓣膜峰值跨瓣压差平均(13.2±4.0) mmHg(1 mmHg=0.133 kPa)。术前、术后即刻、术后4周行右心导管检查,测量的右室压力、肺动脉压力及人工瓣膜峰值跨瓣压差结果见表 1。右室平均压术前、术后即刻、术后4周分别为(10.2±2.0)、(11.7±2.0)、(14.0±2.2) mmHg,均在正常 范围,且术后4周较术前增大(P<0.05)。肺动脉 平均压术前、术后即刻、术后4周分别为(13.0±2.6)、(12.8±1.7)、(13.5±2.2) mmHg,均在正常范围,统计分析提示差异无统计学意义。人工瓣膜峰值跨瓣压差术前为(3.5±1.0) mmHg,术后即时为(6.0±2.2) mmHg,术后4周为(9.5±2.7) mmHg,术后4周较术前增大(P<0.05)。右心导管测量结果证明人工瓣膜无明显狭窄。
 | 图 4 术后4周绵羊心脏超声图Fig 4 Echocardiography 4 weeks after implantation in a sheepA: The latticed shape of echo enhancement showed appropriate position and open shape of the valved stent(white arrow); B: The two parallel lines of echo enhancement showed that the long axis of the valved stent(white arrow) was 35 mm; C: Color Doppler ultrasonography revealed no regurgitation or paravalvular leakage; D: Color Doppler ultrasonography revealed that the peak-to-peak transvalvular pressure gradient of the valve was 5.0 mmHg (1 mmHg=0.133 kPa) |
| 表 1 绵羊的血流动力学数据Tab 1 Hemodynamic data of sheepn=6, ±s,p/mmHg |
21世纪以来,TPVI因其创伤小、风险低、患者容易接受等特点得到了快速发展,该技术主要适用于先天性心脏病(如法洛四联症和肺动脉闭锁)行肺动脉重建术后出现管道及瓣膜狭窄和(或)关闭不全的患者以及肺动脉瓣狭窄行外科手术或球囊扩张术后出现瓣膜关闭不全的患者[2, 6]。通过最长达83个月的随访已初步证明了其安全性和有效性[7,8],应用前景良好。
然而,临床使用的介入瓣膜受限于生物瓣,其固有的衰败的缺陷限制了其在年青患者中的应用。而且,生物瓣还存在一些明显的缺陷。Zegdi等[9]通过对从介入主动脉瓣膜置换的患者体内取出的牛心包瓣膜研究发现,牛心包经过折叠、压缩、球囊再撑开后出现了明显的损伤,表现为胶原纤维的断裂和破坏,以及瓣叶厚度的改变,在纤维断裂的地方可以发现自身组织的侵入,而这往往会导致钙化的出现,并最终影响生物瓣的耐久性。Munnelly等[10]同样证实了牛心包经过折叠、压缩后出现表面裂缝和纤维断裂,同时通过对其机械性能的研究还发现戊二醛固定的牛心包经过折叠、压缩后会变得更加僵硬,而这势必会影响瓣膜的生物力学性能和耐久性。介入生物瓣对于高龄的退行性主动脉瓣人群是适用的,这些患者预期寿命比较短,而对于年青的、需要肺动脉瓣膜置换的人群,瓣膜材料的耐久性无疑非常重要。目前介入生物瓣考虑到牛心包厚度和牛颈静脉尺寸受限的问题,其在临床上可供选择的尺寸有限,不适用于外周血管偏细(不能通过18F以上鞘管)的年轻患者以及肺动脉管道明显扩张(直径在22~24 mm以上)的患者[2]。
高分子材料心脏瓣膜的不断研究为这些患者带来了希望。李海波等[11]采用ePTFE制作成四瓣叶无支架瓣膜,体外加速疲劳实验证实经过4亿次循环后,瓣叶无明显损伤,瓣膜机械性能与实验前无显著差异。高分子材料便于设计和批量生产,抗折叠或压缩的能力强,通过调整材料的厚度和结构、改良瓣膜的设计可使其压缩到更小的尺寸[5],这使其可能替代生物瓣成为新一代的介入心脏瓣膜。目前几种介入高分子材料瓣膜已取得了体外实验的成功[12,13],而Metzner等[5]设计了一种以聚氨酯为材料的介入高分子材料瓣膜,并将其置入绵羊的肺动脉瓣位置,早期(术后1个月)结果满意,瓣膜工作良好。
ePTFE是一种采用特殊工艺制成的多孔的理化性质极其稳定的医用高分子材料,它具有极端惰性的表面和高度的化学稳定性,是已知固体材料中表面自由能最低的材料之一,长达40年的临床应用证实其有良好的生物力学性能和生物相容性。20世纪90年代,研究者将ePTFE三叶瓣在绵羊体内置换右房室瓣3~42周后,发现在瓣叶交接的地方出现中度的钙化,瓣膜的框架和缝合部分(由孔径较大的ePTFE材料覆盖)出现钙化和血管翳,而由孔径更致密的ePTFE制作的瓣叶没有发现组织进入、血栓形成或降解[14]。
近些年,超微孔(纤维结点小于 1 μm)ePTFE人工瓣膜成为研究热点,由于其直径很小,血浆、血细胞很难渗透到材料内部。超微孔ePTFE单瓣[15]、双叶瓣[16]、三叶瓣[17]在肺动脉重建的临床应用中取得可喜的结果。Ando等[17]总结超微孔ePTFE三叶瓣在139名患者中肺动脉重建的10年经验,所有患者术后无需华法林钠抗凝,肺动脉瓣关闭不全小于或等于轻度的占75.0%。所有的瓣膜均运动良好,无血栓形成。超微孔ePTFE在肺循环方面取得的可喜成绩为进一步开发ePTFE介入肺动脉瓣应用带来了希望。
在本研究中,我们选择了超微孔ePTFE作为瓣膜材料,并通过PC表面改性以期进一步增强其生物相容性和耐久性。PC是一种总电荷为零的两性离子头基,位于细胞膜的脂质双层膜。PC衍生物对高分子材料进行表面改性,研究证实可以减少纤维蛋白的吸附,降低血小板的黏附和活化,抑制新生内膜及血管翳的增生,从而增加生物材料的生物相容性[18,19]。我们在前期绵羊体内实验中发现超微孔ePTFE肺动脉瓣膜置入体内3个月后瓣叶流出面会出现明显的血管翳增生,以窦底为主。Ito等[20]也发现用超微孔ePTFE修复的左房室瓣前瓣在人体内6个月后出现了明显的增厚和僵硬,病理检查发现新生内膜显著增生。鉴于此,在本研究中我们对超微孔ePTFE进行了PC表面改性,通过术后早期(4周)体内观察,发现人工瓣膜工作良好,无明显反流及狭窄,表面无明显赘生物形成,中期结果有待进一步观察。
目前,临床上使用的TPVI介入瓣膜包括Melody和SAPIEN两种,手术入路均是通过外周途径。对于外周血管偏细或伴有狭窄或扭曲的患者,以及体质量小于30 kg的患者,TPVI尚不适用[2]。针对这些患者,小切口经右室途径是最可行的办法,目前已有一些经右室途径的TPVI介入瓣膜和输送系统应用于临床试验,早期结果满意[21,22]。鉴于此,本研究选择了经右室心尖入路,操作时应注意在不损伤前降支的前提下穿刺点尽量靠右室心尖近前降支处,且穿刺角度应向右室流出道方向,以避免损伤调节束、前乳头肌、右房室瓣等重要结构。实验证明该入路操作简便,手术成功率高,并发症少。
通过DSA造影可以发现,绵羊肺动脉主干从肺动脉瓣环发出后呈底小口大型,肺动脉干最宽处比瓣环直径大 2~3 mm,所以在本研究中我们将自膨胀支架设计呈酒杯型,而不是传统的直筒型,这样支架释放后贴合更牢靠,通过4周观察,发现无1例出现支架移位。在选择瓣膜尺寸方面,我们建议人工瓣膜直径比肺动脉瓣瓣环直径大约2~4 mm,同时为了保证最佳的瓣膜释放位置,应通过肺动脉瓣上造影反复确定最佳投射体位,使肺动脉主干与右室长轴的角度尽量平直。
综上所述,本中心设计了一种新型高分子材料自膨式介入肺动脉瓣膜,瓣叶材料为经PC表面改性的超微孔ePTFE,通过微创经右室心尖途径成功置入绵羊体内,观察4周未发现明显狭窄与反流,无明显血栓、赘生物形成,血流动力学结果正常,早期结果满意,中长期结果尚待进一步观察。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Bonhoeffer P, Boudjemline Y, Saliba Z, Merckx J, Aggoun Y, Bonnet D, et al.Percutaneous replacement of pulmonary valve in a right-ventricle to pulmonary-artery prosthetic conduit with valve dysfunction[J].Lancet, 2000, 356:1403-1405. |
| [2] | Kenny D, Hijazi Z M.State-of-the-art percutaneous pulmonary valve therapy[J].Expert Rev Cardiovasc Ther, 2012, 10:589-597. |
| [3] | 张 本, 徐志云.高分子材料人造心脏瓣膜: 下一代人造心脏瓣膜?[J].中华胸心血管外科杂志, 2013, 29:53-58. |
| [4] | Claiborne T E, Slepian M J, Hossainy S, Bluestein D.Polymeric trileaflet prosthetic heart valves: evolution and path to clinical reality[J].Expert Rev Med Devices, 2012, 9:577-594. |
| [5] | Metzner A, Iino K, Steinseifer U, Uebing A, de Buhr W, Cremer J, et al.Percutaneous pulmonary polyurethane valved stent implantation[J].J Thorac Cardiovasc Surg, 2010, 139:748-752. |
| [6] | 刘瀚旻.经皮肺动脉瓣置换术:先天性心血管畸形介入治疗的新突破[J].中华妇幼临床医学杂志(电子版), 2010, 6:77-81. |
| [7] | Lurz P, Coats L, Khambadkone S, Nordmeyer J, Boudjemline Y, Schievano S, et al.Percutaneous pulmonary valve implantation: impact of evolving technology and learning curve on clinical outcome[J].Circulation, 2008, 117:1964-1972. |
| [8] | Lurz P, Bonhoeffer P, Taylor A M.Percutaneous pulmonary valve implantation: an update[J].Expert Rev Cardiovasc Ther, 2009, 7:823-832. |
| [9] | Zegdi R, Bruneval P, Blanchard D, Fabiani J N.Evidence of leaflet injury during percutaneous aortic valve deployment[J].Eur J Cardiothorac Surg, 2011, 40:257-259. |
| [10] | Munnelly A E, Cochrane L, Leong J, Vyavahare N R.Porcine vena cava as an alternative to bovine pericardium in bioprosthetic percutaneous heart valves[J].Biomaterials, 2012, 33:1-8. |
| [11] | 李海波, 王武军, 梁 勇, 蔡开灿, 邹小明, 王振康.膨体聚四氟乙烯人工心脏瓣膜体外加速疲劳的实验研究[J].南方医科大学学报, 2006, 26:1749-1752. |
| [12] | Claiborne T E, Bluestein D, Schoephoerster R T.Development and evaluation of a novel artificial catheter-deliverable prosthetic heart valve and method for in vitro testing[J].Int J Artif Organs, 2009, 32:262-271. |
| [13] | Tzamtzis S, Ghanbari H, Seifalian A, Burriesci G.A new generation aortic valve device for transcatheter implantation[J].Cardiology, 2010, 115:292. |
| [14] | Nistal F, García-Martínez V, Arbe E, Fernández D, Artiano E, Mazorra F, et al.In vivo experimental assessment of polytetrafluoroethylene trileaflet heart valve prosthesis[J].J Thorac Cardiovasc Surg, 1990, 99:1074-1081. |
| [15] | Gil-Jaurena J, Ferreiros M, Castillo R, Conejo L, Cuenca V, Zabala J.Use of a pulmonary neovalve with a transannular patch for repair of tetralogy of fallot[J].Rev Esp Cardiol, 2010, 63:1438-1443. |
| [16] | Lee C, Lee C H, Kwak J G, Song J Y, Shim W S, Choi E Y, et al.Bicuspid pulmonary valve implantation using polytetrafluoroethylene membrane: early results and assessment of the valve function by magnetic resonance imaging[J].Eur J Cardiothorac Surg, 2012, 43:468-472. |
| [17] | Ando M, Takahashi Y.Ten-year experience with handmade trileaflet polytetrafluoroethylene valved conduit used for pulmonary reconstruction[J].J Thorac Cardiovasc Surg, 2009, 137:124-131. |
| [18] | Chen C, Ofenloch J C, Yianni Y P, Hanson S R, Lumsden A B.Phosphorylcholine coating of ePTFE reduces platelet deposition and neointimal hyperplasia in arteriovenous grafts[J].J Surg Res, 1998, 77:119-125. |
| [19] | Chevallier P, Janvier R, Mantovani D, Laroche G.In vitro biological performances of phosphorylcholine-grafted ePTFE prostheses through RFGD plasma techniques[J].Macromol Biosci, 2005, 5:829-839. |
| [20] | Ito T, Maekawa A, Yamana K, Yoshizumi T, Sunada M.Use of an expanded polytetrafluoroethylene patch as an artificial leaflet in mitral valve plasty: an early experience[J].Ann Thorac Surg, 2010, 89:1620-1624. |
| [21] | Schreiber C, HLörer J, Vogt M, Fratz S, Kunze M, Galm C, et al.A new treatment option for pulmonary valvar insufficiency: first experiences with implantation of a self-expanding stented valve without use of cardiopulmonary bypass[J].Eur J Cardiothorac Surg, 2007, 31:26-30. |
| [22] | Al Qethamy H, Momenah T, El Oakley R, Al Redhyan A, Tageldin M, Al Faraidi Y.Minimally invasive transventricular implantation of pulmonary xenograft[J].J Card Surg, 2008, 23:339-340. |
 2014, Vol. 35
2014, Vol. 35


