2. 中国科学院兰州化学与物理研究所固体润滑国家重点实验室, 兰州 730000;
3. 兰州大学口腔医学院外科学教研室, 兰州 730000
2. State Key Laboratory of Solid Lubrication, Lanzhou Institute of Chemical Physics, Chinese Academy of Sciences, Lanzhou 730000, Gansu, China;
3. Department of Oral and Maxillofacial Surgery, School of Stomatology, Lanzhou University, Lanzhou 730000, Gansu, China
X线钡餐造影检查是胃肠道疾病常用的诊断技术,但当有气泡、凝块及钡池等伪影存在时对病变的观察会产生影响[1],而且检查过程复杂,给患者造成痛苦,对患者及医务工作者亦有放射损伤[2,3]。
石墨烯量子点(graphene quantum dots,GQDs)是新型的碳材料量子点,由于其优异的成像性能及良好的生物安全性[4,5],近年来被广泛应用于细胞成像[4,5]及肿瘤组织成像[6]等生物医学领域的研究,但对于在肠壁成像中的应用尚未见相关报道。本研究将GQDs用于小鼠小肠造影并与钡餐造影进行比较,观察成像效果及对小鼠肠系膜微循环的影响,探求一种新型的肠壁显影剂。 1 材料和方法 1.1 实验动物
C57BL/6N小鼠28只,体质量25~30 g,雌雄各半,购于兰州大学实验动物中心(SPF级),生产许可证号: SCXK(甘)2013-0002。 1.2 主要试剂与仪器
GQDs(中国科学院兰州化学与物理研究所固体润滑国家重点实验室提供),碲化镉量子点(CdTe quantum dots,CdTe QDs;南京捷纳思新材料有限公司);硫酸钡(Ⅱ型)干混悬剂(青岛东风化工有限公司);水合氯醛 (天津市大茂化学试剂厂)。X52-H光学显微镜、BT-2000微循环数字恒温仪、BT-2000图像分析系统(成都泰盟科技有限公司);FX-in vivo小动物活体成像系统(Carestream Health公司)。 1.3 钡餐的配制
按照医学标准配方将硫酸钡(Ⅱ型)干混悬剂溶于纯水配制成200% (质量体积百分浓度)钡餐。 1.4 小鼠小肠成像实验
将28只C57BL/6N小鼠随机分为4组,每组7只,每组中随机抽出2只用于小肠成像实验,其余5只用于肠系膜微循环测定。实验前小鼠禁食过夜,自由饮水。 各组小鼠分别用500 μL 2.0 g/L GQDs/纯水悬液、2.0 g/L CdTe QDs/纯水悬液、钡餐、纯水灌胃,灌胃1 h后用10%水合氯醛(0.35 mL/100 g)腹腔注射麻醉,麻醉妥后沿中隔开腹长约1 cm切口,轻柔拉出阑尾处一段空肠襻,将肠系膜展平置于FX-in vivo成像系统载物台上,选择相应条件进行成像观察。GQDs、CdTe QDs 、纯水灌胃后在紫外光激发下成像,激发波长(Ex): 465 nm,发射波长(Em): 535 nm;钡餐灌胃后在X线照射下成像,能量范围: 0~150 μA;曝光时间: 3 s。 1.5 小鼠肠系膜微循环的测定
实验分组和方法如前所述,小鼠麻醉妥后沿中隔开腹长约1 cm的切口,轻柔拉出阑尾处一段空肠襻,将肠系膜展平,找脂肪少、血管丰富的位置平铺于有机玻璃灌流小池中并固定,肠系膜下37℃恒温生理盐水槽进行保温保湿,在BT-2000微循环数字恒温仪10×10倍镜下寻找清晰微动脉(约15 μm)、微静脉 (约25 μm)、毛细血管(约10 μm)各2~3支,使用BT-2000图像分析系统测量并记录微动、静脉和毛细血管管径、血流速度、每平方毫米毛细血管开放数(毛细血管网交点记数法) [7],然后各组小鼠分别用500 μL 2.0 g/L GQDs/纯水悬液、2.0 g/L CdTe QDs/纯水悬液、钡餐、纯水灌胃,记录灌胃后10、20、30、60 min肠系膜微动、静脉和毛细血管管径、血流速度、每平方毫米毛细血管开放数。 1.6 统计学处理
应用SPSS 13.0软件进行统计学分析,计量数据以 ±s描述,采用重复测量设计的方差分析进行差异性检验,同组不同时间点多重比较采用LSD-t法。检验水准(α)为0.05。 2 结 果 2.1 GQDs及钡餐对小鼠肠壁的成像实验
纯水灌胃1 h后,小肠没有显示特殊的影像(图 1A)。 GQDs灌胃1 h后,C57BL/6N小鼠的小肠呈现鲜亮的绿色荧光充盈影像(图 1B),肠壁边缘形态及肠壁黏膜细微结构显示清晰(图中红色箭头所示),肠系膜上的血管也呈清晰的淡绿色影像(图中白色箭头所示),CdTe QDs 灌胃后的肠成像效果跟GQDs基本一致(图 1C)。钡餐灌胃1 h后X线片示小肠呈高密度团块影像,边缘基本清晰,但不能显示肠壁黏膜细微结构及肠系膜上的血管影像(图 1D)。
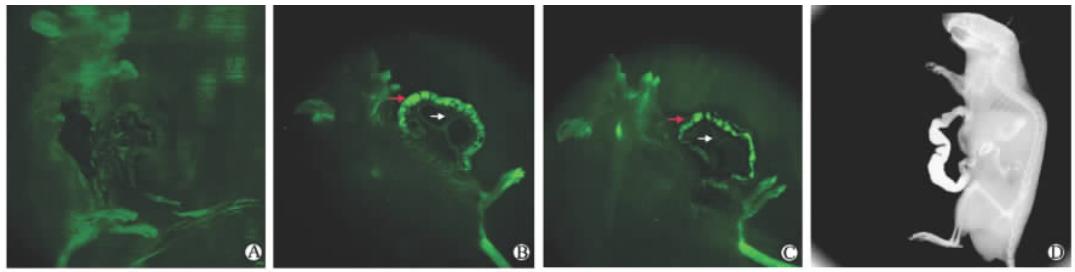 | 图 1 GQDs灌胃后在FX-in vivo成像系统中的成像 Fig 1 Image formation of GQDs in intestine after gavage by FX-in vivo image formation system A: Pure water; B: GQDs; C: CdTe QDs; D: Barium meal. A, B and C were excited by ultraviolet (Ex: 465 nm, Em: 535 nm); D was observed by X-ray irradiation. GQDs: Graphene quantum dots; CdTe QDs: CdTe quantum dots; Ex: Excitation; Em: Emission. Red arrow: Intestinal wall; White arrow: Mesenteric vessel |
GQDs灌胃后小鼠微动脉管径逐渐增大, 20 min达到最大, 与灌胃前相比差异有统计学意义(P<0.05,表 1),提示GQDs有扩张微动脉的作用; 而CdTe QDS和钡餐灌胃后小鼠微动脉管径变化不明显,与灌胃前比较差异无统计学意义。 钡餐及CdTe QDs灌胃后小鼠微动脉的血流速度加快, CdTe QDs灌胃后各时间点及钡餐灌胃后20、30 min 与灌胃前相比差异有统计学意义(P<0.05,表 2); GQDs灌胃后对微动脉血流速度无明显影响(表 2)。
| 表 1 GQDs对小鼠肠系膜微动脉管径的影响 Tab 1 Effect of GQDs on diameter of arteriole in mouse mesentery |
| 表 2 GQDs对小鼠肠系膜微动脉血流速度的影响 Tab 2 Effect of GQDs on velocity of blood flow of arterioles in mouse mesentery |
GQDs、CdTe QDs、钡餐灌胃后对小鼠微静脉管径均无明显影响(表 3)。钡餐和CdTe QDs灌胃后微静脉的血流速度加快,灌胃后各时间点与灌胃前相比差异均有统计学意义(P<0.05,表 4),说明钡餐及CdTe QDs灌胃可使微静脉血流速度增快。 2.2.3 GQDs对毛细血管的影响
GQDs灌胃对毛细血管管径(表 5、表 6)、血流速度(表 7)、每平方毫米毛细血管开放数(表 8)均无明显影响。 CdTe QDs对毛细血管入口管径无明显影响,但灌胃后20 min内毛细血管出口管径持续增大,与 灌胃前相比差异有统计学意义(P<0.05,表 6),30 min后恢复至灌胃前水平, 表明CdTe QDs灌胃有一过性扩张毛细血管出口管径的作用。 与灌胃前相比,CdTe QDs灌胃后毛细血管血流速度逐渐加快, 每平方毫米毛细血管开放数逐渐减少,20 min时前后差异有统计学意义(P<0.05,表 7、表 8),之后有所恢复。钡餐灌胃对毛细血管管径无明显影响,但毛细血管血流速度逐渐加快,灌胃后60 min与灌胃前比较差异有统计学意义(P<0.05,表 7);每平方毫米毛细血管开放数逐渐减少,灌胃30 min时达到最少,与灌胃前相比差异有统计学意义(P<0.05,表 8)。
| 表 3 GQDs对小鼠肠系膜微静脉管径的影响 Tab 3 Effect of GQDs on diameter of venules in mouse mesentery |
| 表 4 GQDs对小鼠肠系膜微静脉血流速度的影响 Tab 4 Effect of GQDs on velocity of blood flow of venules in mouse mesentery |
| 表 5 GQDs对小鼠肠系膜毛细血管入口管径的影响 Tab 5 Effect of GQDs on inflow diameter of capillaries in mouse mesentery |
| 表 6 GQDs对小鼠肠系膜毛细血管出口管径的影响Tab 6 Effect of GQDs on outflow diameter of capillaries in mouse mesentery |
| 表 7 GQDs对小鼠肠系膜毛细血管血流速度的影响Tab 7 Effect of GQDs on velocity of blood flow in capillaries in mouse mesentery |
| 表 8 GQDs对小鼠肠系膜毛细血管开放数的影响 Tab 8 Effect of GQDs on number of circulating capillaries in mouse mesentery |
半导体量子点(semiconductor quantum dots, QDs)独特的光学性能使其在生物医学领域应用的研究受到广泛的关注[8 ,9]。Wu等[10]研究表明QDs成像的特异性及稳定性均显著优于有机荧光染料。但是也有研究表明QDs有潜在的细胞及体内毒性[11 ,12,1513]。本研究将GQDs用于小鼠小肠成像也是基于其良好的生物安全性[6,14,15]及优异的成像性能[15,16,17],紫外光或近红外光激发就能进行成像,检查过程简单、方便,对患者及医务工作者无损伤;而X线钡餐造影技术检查过程复杂,给患者造成痛苦,对患者及医务工作者亦有不同程度的放射损伤[2,3],因此从检查方法来说GQDs具有很好的应用前景。
Cao等[18]的研究结果显示QDs体内成像的荧光强度及稳定性受组织深度及皮毛的影响很大,我们的预实验也证实了这点。因此,为了避免小鼠皮毛及组织深度对小鼠小肠成像的影响,我们将小鼠小肠解剖出来进行成像研究。而X线钡餐造影检查受到钡剂涂布及充盈效果的影响,当有气泡、凝块及钡池等伪影存在时会对病变的观察造成 不便,以致出现误诊、漏诊[1]。本研究也发现钡餐对小肠黏膜的细微结构不能很好地显示,而GQDs能很好地显现小鼠小肠的肠壁边缘形态和肠壁黏膜细微结构以及肠系膜血管影像,这对早期的小肠肠壁黏膜疾病及血管系统疾患的诊断有重要意义。
体外细胞实验[19,20]和体内实验[21]已证实QDs能快速被毛细血管内皮细胞吸收,GQDs及QDs灌胃后首先进入小鼠肠系膜微循环,观察GQDs对肠系膜微循环的影响,是评价其体内生物安全性能很好的指标。Shukur 等[22]研究表明CdTe QDs对小鼠肠系膜微动脉的影响取决于其粒径及表面涂层,表面无涂层的CdTe QDs对微动脉管径无影响,本实验所测结果与其一致。我们观察到GQDs对肠系膜微动脉有扩张作用,可能与其表面的含氧官能团有关。因而GQDs在成像的同时可以改善肠系膜局部的血运,而钡餐灌胃后有收缩微动脉的作用,有可能造成肠系膜局部缺血。钡餐及CdTe QDs灌胃后可加速微动、静脉及毛细血管血流速度,其机制尚不清楚。
综上所述,本研究表明: GQDs对小鼠肠壁的成像与X线钡餐造影相比,方法更简便、快捷,无放射损伤,而且对肠系膜微循环的影响较小,有更好的成像效果。因此,GQDs在肠成像领域有潜在的应用前景。但从实际应用角度看,光学成像受感光距离(组织深度)影响明显,目前只能用于小动物实验,用于临床的前景有限。我们正在做进一步的研究,一方面通过改进GQDs的制备方法或进行表面修饰增强其荧光强度及稳定性,另一方面改变其激发光波长,由紫外激发上转至近红外激发[23]。提高GQPs体内成像的荧光强度,消除皮毛对荧光强度及稳定性的影响将是今后相关研究和改进的重要方向。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | 邱 涛, 王文斌.钡餐造影在胃癌中的临床诊断价值[J].临床合理用药杂志, 2012, 5:51-53. |
| [2] | 邓爱平, 李新文.X 线检查对人体的危害与防护[J].临床合理用药杂志, 2010, 3:151-152. |
| [3] | Thierens H, Vral A, Morthier R, Aousalah B, De Ridder L.Cytogenetic monitoring of hospital workers occupationally exposed to ionizing radiation using the micronucleus centromere assay[J].Mutagenesis, 2000, 15:245-249. |
| [4] | Zhu S J, Zhang J H, Tang S J, Qiao C Y, Wang L, Wang H Y, et al.Surface chemistry routes to modulate the photoluminescence of graphene quantum dots:from fluorescence mechanism to up-conversion bioimaging applications[J].Adv Funct Mater, 2012, 22:4732-4740. |
| [5] | Zhang M, Bai L L, Shang W H, Xie W J, Ma H, Fu Y Y, et al.Facile synthesis of water-soluble, highly fluorescent graphene quantum dots as a robust biological label for stem cells[J].J Mater Chem, 2012, 22:7461-7467. |
| [6] | Nurunnabi M, Khatun Z, Huh K M, Park S Y, Lee D Y, Cho K J, et al.In vivo biodistribution and toxicology of carboxylated graphene quantum dots[J].ACS Nano, 2013, 7:6858-6867. |
| [7] | 李 军, 杨 梅, 张宏馨, 廉海晨.富铬酵母对实验性糖尿病大鼠肠系膜微循环的影响[J].时珍国医国药, 2012, 23:1406-1407. |
| [8] | Bruchez M, Moronne M, Gin P, Weiss S M, Alivisatos A P.Semiconductor nanocrystals as fluorescent biological labels[J].Science, 1998, 281:2013-2016. |
| [9] | Chan W C W, Nie S.Quantum dot bioconjugates for ultrasensitive nonisotopic detection[J].Science, 1998, 281:2016-2018. |
| [10] | Wu X, Liu H, Liu J, Haley K N, Treadway J A, Larson J P, et al.Immunofluorescent labeling of cancer marker Her2 and other cellular targets with semiconductor quantum dots[J].Nat Biotechnol, 2003, 21:41-46. |
| [11] | Zhang Y, Chen W, Zhang J, Liu J, Chen G P, Pope C.In vitro and in vivo toxicity of CdTe nanoparticles[J].J Nanosci Nanotechnol, 2007, 7:497-503. |
| [12] | Cho S J, Maysinger D, Jain M, RLöder B, Hackbarth S, Winnik F M.Long-term exposure to CdTe quantum dots causes functional impairments in live cells[J].Langmuir, 2007, 23:1974-1980. |
| [13] | Soenen S J, Demeester J, De Smedt S C, Braeckmans K.The cytotoxic effects of polymer-coated quantum dots and restrictions for live cell applications[J].Biomaterials, 2012, 33:4882-4888. |
| [14] | Liu Q, Guo B, Rao Z, Zhang B, Gong J R.Strong two-photon-induced fluorescence from photostable, biocompatible nitrogen-doped graphene quantum dots for cellular and deep-tissue imaging[J].Nano Lett, 2013, 13:2436-2441. |
| [15] | Zhu S J, Zhang J, Qiao C, Tang S, Li Y, Yuan W, et al.Strongly green-photoluminescent graphene quantum dots for bioimaging applications[J].Chem Commun(Camb), 2011, 47:6858-6860. |
| [16] | Qian Z S, Ma J J, Shan X Y, Shao L X, Zhou J, Chen J R, et al.Surface functionalization of graphene quantum dots with small organic molecules from photoluminescence modulation to bioimaging applications:an experimental and theoretical investigation[J].RSC Adv, 2013, 3:14571-14579. |
| [17] | Wu X, Tian F, Wang W, Chen J, Wu M, Zhao J X.Fabrication of highly fluorescent graphene quantum dots using L-glutamic acid for in vitro/in vivo imaging and sensing[J].J Mater Chem C Mater Opt Electron Devices, 2013, 1:4676-4684. |
| [18] | Cao Y, Yang K, Li Z, Zhao C, Shi C, Yang J.Near-infrared quantum-dot-based non-invasive in vivo imaging of squamous cell carcinoma U14[J].Nanotechnology, 2010, 21:475104. |
| [19] | Xiao Y, Forry S P, Gao X, Holbrook R D, Telford W G, Tona A.Dynamics and mechanisms of quantum dot nanoparticle cellular uptake[J].J Nanobiotechnology, 2010, 8:13. |
| [20] | Zhang B, Liang X, Hao L, Cheng J, Gong X, Liu X, et al.Quantum dots/particle-based immunofluorescence assay:synthesis, characterization and application[J].J Photochem Photobiol B, 2009, 94:45-50. |
| [21] | Praetner M, Rehberg M, Bihari P, Lerchenberger M, Uhl B, Holzer M, et al.The contribution of the capillary endothelium to blood clearance and tissue deposition of anionic quantum dots in vivo[J].Biomaterials, 2010, 31:6692-6700. |
| [22] | Shukur A, Rizvi S B, Whitehead D, Seifalian A, Azzawi M.Altered sensitivity to nitric oxide donors, induced by intravascular infusion of quantum dots, in murine mesenteric arteries[J].Nanomedicine, 2013, 9:532-539. |
| [23] | Yang Y, An F, Liu Z, Zhang X, Zhou M, Li W, et al.Ultrabright and ultrastable near-infrared dye nanoparticles for in vitro and in vivo bioimaging[J].Biomaterials, 2012, 33:7803-7809. |
 2014, Vol. 35
2014, Vol. 35


