随着生活水平的改善,急性心肌梗死(myocardial infarction,MI)的发病率逐年提高,已经成为威胁人类健康的重要疾病之一。心室重构是由于缺血坏死的心肌引起交感神经兴奋和肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)激活,造成梗死区心肌逐渐变薄、扩张,梗死边缘区心肌不断肥厚、伸展[1,2]。心室重构与心力衰竭、恶性心律失常等并发症密切相关,严重影响MI患者的预后。2010年Esler等[3]发现,经导管射频消融去肾交感神经术(renal sympathetic denervation,RDN)可以显著降低去甲肾上腺素流溢率,有效抑制交感神经兴奋和RAAS激活,对于顽固性高血压可获得显著而持久的降压疗效。2012年Brandt等[4]发现对肾交感神经进行射频消融还能抑制高血压患者的左室肥厚、提高左室舒张功能,显著改善高血压患者的预后。经导管射频消融RDN作为一种新兴的介入治疗手段,除了显著地降压疗效外,是否可以通过抑制交感神经兴奋和RAAS激活发挥对MI后心室重构的治疗作用,目前鲜有报道。本课题通过结扎大鼠左冠状动脉前降支构建MI模型,研究双侧肾交感神经切除是否可以改善MI后心室重构、提高心脏功能,并通过梗死边缘区Ⅰ型胶原、Ⅲ型胶原和转化生长因子β1(transforming growth factor β1,TGF-β1)的检测进行可能的机制探讨。
1 材料和方法 1.1 实验分组健康清洁级雄性Wistar大鼠30只,体质量180~220 g,由第二军医大学动物实验中心提供。饲养温度22~25℃,相对湿度55%~60%,光照时间12 h/d。动物随机分成3组,分组如下:MI组(n=10)、MI+RDN组(MI建模1周后进行RDN,n=10)和假手术组(n=10),开胸后不结扎冠状动脉,开腹后保留肾交感神经。
1.2 大鼠MI模型制备及处理大鼠适应环境1周,采用左冠状动脉前降支结扎法制备MI模型。术前禁食12 h,以乙醚吸入麻醉。左侧3~4肋间开胸暴露心脏,将心脏迅速挤出胸壁外,0号丝线结扎左冠状动脉前降支(左心耳和肺动脉圆锥交界稍下方)。肉眼可见左室前壁颜色变白,闭合胸腔,开胸时间不超过30 s。标准肢体Ⅱ导联心电图ST段抬高,即为结扎成功。假手术组只穿线不结扎前降支。
大鼠MI建模1周后进行双侧肾交感神经切除。术前禁食12 h,腹腔注射10%水合氯醛(3~5 mL/kg)进行麻醉。行腹正中切口,暴露肾脏及肾动、静脉,在解剖显微镜下(×25)将可见的肾神经、脂肪和结缔组织剥离、切断, 并在肾血管涂以10%苯酚(溶于95%乙醇)化学消融残留神经。术中采用电刺激神经验证RDN的完整性,用Grass S48刺激仪(15 V,0.2 ms,10 Hz)刺激肾动脉10~30 s,正常大鼠电刺激后血压增加5~10 mmHg(1 mmHg=0.133 kPa),心率增加8~15次/min,肾脏由红色变为苍白。RDN手术成功的大鼠进行电刺激,血压、心率和肾脏颜色均不会发生改变。假手术组开腹后仅用生理盐水涂抹肾动、静脉周围,保留肾交感神经。
1.3 超声心动图检查
MI建模4周后对各组大鼠进行超声心动图检查。采用加拿大Visual Sonics公司的多普勒超声诊断仪,选用RMV-716探头,探头频率为17.5 MHz。术前禁食12 h,腹腔内注射氯胺酮(2 mL/kg)麻醉大鼠,测量大鼠左室收缩末期内径(left ventricular internal dimensions at end systole,LVIDS)、左室舒张末期内径(left ventricular internal dimensions at end diastole,LVIDD)、左室射血分数(ejection fraction,EF)和左室短轴缩短率(fractional shortening,FS),取3个心动周期记录数据的平均值。
1.4 大鼠心肌组织Masson染色大鼠心腔内注射10%氯化钾溶液1 mL,使心脏停跳在舒张期。迅速取出心脏,计算梗死面积:梗死面积(%)=梗死区弧长/[(心外膜周长+心内膜周长)/2]×100%。沿垂直于心脏长轴的方向剪开左室,取左室中部冠状切面心肌,用4%多聚甲醛溶液固定。经石蜡包埋制成石蜡切片,取部分心肌进行Masson染色评估梗死边缘区纤维化程度。切片脱蜡至水,蒸馏水洗3次,浸入苏木精染核。PBS洗3次,入丽春红酸性复红溶液染色5 min,以1%磷钼酸液分色5 min沥干。亮绿溶液染色5 min,醋酸溶液浸洗,树胶封片。每张Masson切片在显微镜下观察染色情况并取100倍视野摄片,心肌细胞呈红色、胶原纤维呈蓝绿色。
1.5 免疫组化染色检测大鼠心肌Ⅰ型胶原、Ⅲ型胶原和TGF-β1表达将剩余石蜡切片脱蜡、水化、煮沸法修复。切片放入3%过氧化氢溶液,室温下孵育10 min以阻断内源性过氧化物酶。取出切片,PBS洗3次后滴加封闭液(5% BSA),室温10 min后弃之。滴加适当稀释的一抗(鼠抗Ⅰ型胶原一抗、鼠抗Ⅲ型胶原一抗和鼠抗TGF-β1一抗,效价1 100)。PBS洗3次后滴加聚合HRP 标记抗鼠IgG,37℃孵育30 min。PBS洗3次后加DAB显色,自来水冲洗后苏木精复染,盐酸乙醇分化、脱水、封片。显微镜下观察以棕黄色颗粒为阳性信号,每张切片在梗死边缘区随机取4~5个200倍视野进行摄片,应用Image Pro Plus 6.0软件进行累积光密度(integrated optical density,IOD)定量分析。
1.6 统计学处理采用SPSS 17.0软件进行统计分析。符合正态分布的计量资料以 ±s表示,多组样本均数的比较用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q检验。检验水准(α)为0.05。
2 结 果 2.1 RDN对MI大鼠心室重构和心功能的影响MI 组大鼠存活8只,死亡2只,死亡率为20%;MI+RDN组大鼠存活7只,死亡3只,死亡率为30%;假手术组10只大鼠全部存活。MI组大鼠梗死面积与MI+RDN组相比,差异无统计学意义(P>0.05)。MI建模4周后,与假手术组相比,MI组EF、FS下降,LVIDS和LVIDD增加(P均<0.05);与MI组相比,MI+RDN组EF、FS升高,LVIDS和LVIDD减少(P均<0.05)。结果见表 1。
| 表 1 建模4周后各组大鼠心功能的变化Tab 1 Cardiac function of rats in different groups 4 weeks after modeling ±s |
光镜下Masson染色显示,心肌细胞呈红色,胶原纤维为蓝绿色。与假手术组相比,MI组大鼠梗死边缘区心肌细胞排列紊乱,间质内蓝色胶原纤维增多、分割心肌束,部分胶原纤维融合,心肌纤维化程度增加。与MI组相比,MI+RDN组蓝色胶原纤维减少、心肌纤维化程度减轻。见图 1。
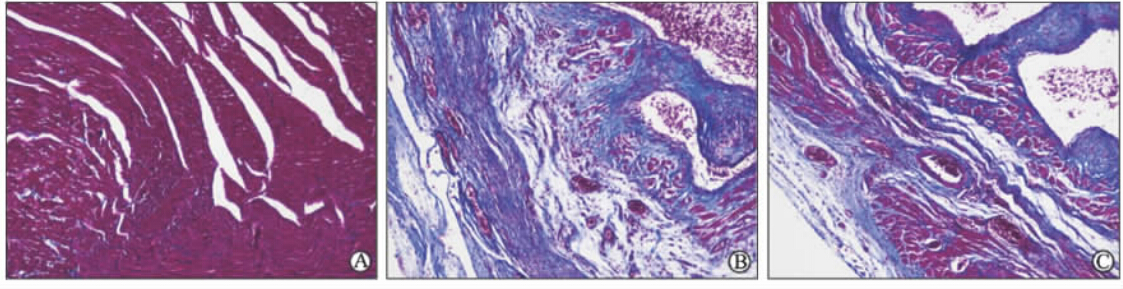 | 图 1 各组大鼠心肌组织Masson染色Fig 1 Masson trichrome staining of rat cardiac sections in different groups A: Sham group; B: MI group; C: MI+RDN group. MI: Myocardial infarction; RDN: Renal sympathetic denervation. Original magnification: × 100 |
免疫组化染色结果显示,Ⅰ型胶原、Ⅲ型胶原和TGF-β1呈棕黄色颗粒。IOD定量分析显示,与假手术组相比,MI组大鼠梗死边缘区Ⅰ型胶原、Ⅲ型胶原表达增加(P<0.05);与MI组相比,MI+RDN 组Ⅰ型胶原、Ⅲ型胶原表达减少(P<0.05)。MI组大鼠梗死边缘区TGF-β1表达高于假手术组(P<0.05);与MI组相比,MI+RDN组TGF-β1表达减少(P<0.05)。见图 2。
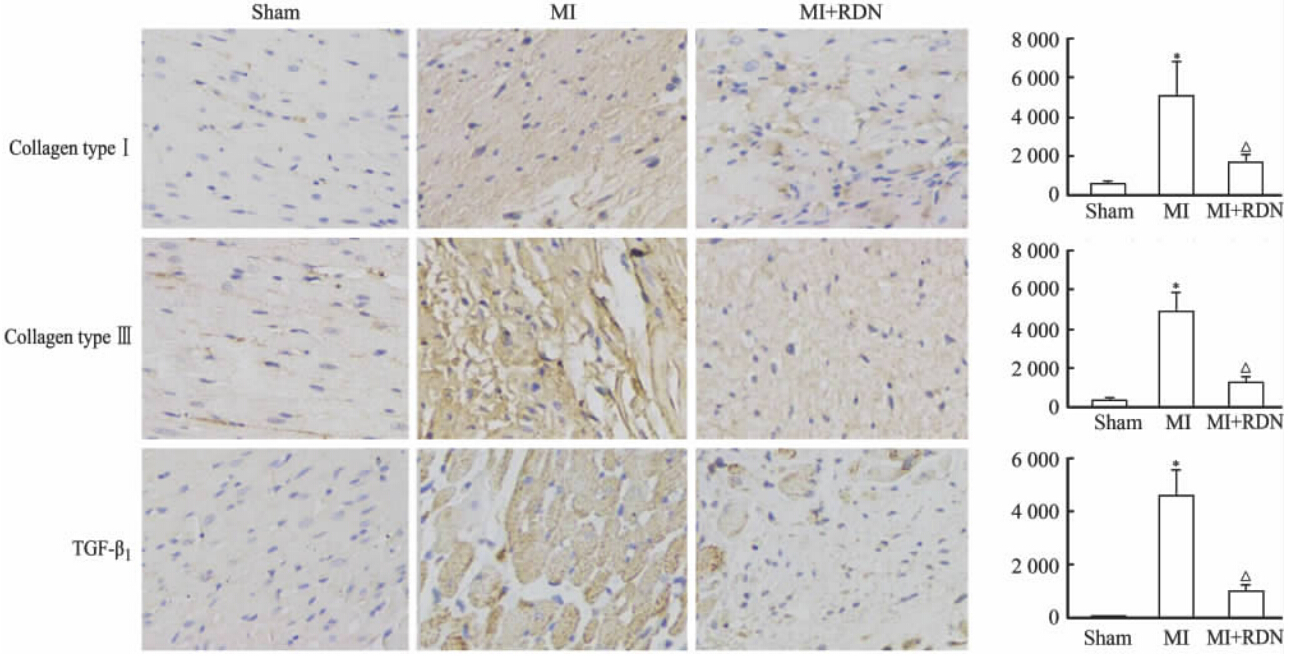 | 图 2 RDN对心梗大鼠心肌Ⅰ型胶原、Ⅲ型胶原和TGF-β1表达的影响Fig 2 Effect of RDN on expressions of myocardial collagen typeⅠ,type Ⅲ and TGF-β1 in MI rats MI: Myocardial infarction; RDN: Renal sympathetic denervation; TGF-β1: Transforming growth factor β1. Original magnification: × 200 (immunohistochemical staining). *P<0.05 vs sham group; △P<0.05 vs MI group. n=10 for sham group; n=8 for MI group; n=7 for MI+RDN group. ±s |
免疫组化染色结果显示,Ⅰ型胶原、Ⅲ型胶原和TGF-β1呈棕黄色颗粒。IOD定量分析显示,与假手术组相比,MI组大鼠梗死边缘区Ⅰ型胶原、Ⅲ型胶原表达增加(P<0.05);与MI组相比,MI+RDN 组Ⅰ型胶原、Ⅲ型胶原表达减少(P<0.05)。MI组大鼠梗死边缘区TGF-β1表达高于假手术组(P<0.05);与MI组相比,MI+RDN组TGF-β1表达减少(P<0.05)。见图 2。
3 讨 论及时、有效地开通靶血管能够挽救濒死心肌,但是单一的血运重建对于缓解MI后心室重构难以获得理想的效果。目前心室重构的治疗以药物为主,包括血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)和β受体阻滞剂等。协同使用ACEI和β受体阻滞剂,可以有效降低交感神经兴奋并抑制RAAS过度激活,对于改善MI后心室重构具有显著效果。然而药物治疗存在一定的局限性,部分患者服用ACEI后出现急性肾功能衰竭、血管神经性水肿等严重不良反应;部分患者存在长期服药依从性差的问题,且多种药物的联合使用增加了家庭和社会的经济负担。
经导管射频消融RDN通过抑制交感神经兴奋和RAAS过度激活,使得顽固性高血压患者可获得显著而持久的降压疗效[3]。我们希望扩大这一手术的获益人群,从而研究RDN对MI后心室重构是否也能起到改善效果并进行可能的机制探讨。2012年Hu等[5]发现RDN通过增加MI大鼠的尿量排出,可以减少左室舒张末期和收缩末期容积,提高左室收缩功能。我们采用结扎大鼠前降支的方法构建MI模型,MI建模4周后超声心动图结果显示,与假手术大鼠相比,MI大鼠左室收缩功能明显下降,LVIDS和LVIDD显著增加。我们对建模1周的MI大鼠进行双侧肾交感神经切除,3周后发现RDN可以显著提高MI大鼠的左室EF和FS,减少LVIDS和LVIDD。我们的研究显示,对MI大鼠进行双侧肾交感神经切除可以显著改善MI后心室重构并提高左心收缩功能。
研究显示,ACEI和β受体阻滞剂等药物除了抑制交感神经兴奋和RAAS过度激活,还能通过抑制梗死边缘区的心肌纤维化进程改善MI后心室重构[6]。据此,我们推测RDN也可能通过作用于梗死边缘区的胶原蛋白和促纤维因子发挥抑制心肌纤维化的作用。细胞外基质(extracellular matrix,ECM)是由胶原蛋白和纤维连接蛋白等组成的复杂网状空间结构,在维持心脏的正常组织结构中发挥重要作用[7]。胶原蛋白是心肌缺血发生发展过程中梗死区和梗死边缘区进行修复的主要基质,是影响间质纤维化和心室重构进程的重要因素[8]。本研究中,我们对大鼠的梗死边缘区进行Masson染色发现,与假手术大鼠相比,MI大鼠有显著的蓝色胶原沉积,而对MI大鼠进行RDN后,梗死边缘区的胶原沉积明显改善。研究显示,Ⅰ型胶原和Ⅲ型胶原是参与MI修复的主要胶原蛋白[9]。Ⅰ型胶原占整个心肌胶原成分的80%~85%,以粗纤维方式存在,抗拉强度高而利于保持心室壁的强度;Ⅲ型胶原占10%~15%,以细纤维方式存在,具有伸展性和回弹性,与室壁弹性有关[10]。我们对MI大鼠的梗死边缘区进行免疫组化染色发现,与假手术大鼠相比,MI大鼠有显著的Ⅰ型胶原和Ⅲ型胶原沉积。对MI大鼠进行双侧肾交感神经切除后,梗死边缘区的Ⅰ型胶原和Ⅲ型胶原表达显著下降。据此,我们推测RDN对梗死边缘区胶原蛋白沉积的影响可能是改善MI后心室重构的重要机制之一。
心肌缺血除了激活全身交感神经和循环RAAS,也会影响到局部心肌的RAAS[11]。MI后机体交感神经兴奋、肾素分泌增加,激活循环RAAS,继而增加室壁应力导致心肌局部RAAS激活;MI后左室收缩功能下降、心室腔残留血液增多使室壁张力增加,也会激活心脏RAAS。血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)是RAAS的主要效应物质,是MI后胶原沉积和心室重构的重要启动因素[12]。Danser等[13]发现心衰患者心脏局部转化Ang Ⅱ生成的肾素来源于循环血。因此,心肌局部RAAS激活可能依赖于循环中的RAAS水平。TGF-β1是一种重要的致心肌纤维化因子,心肌缺血后高表达可以触发细胞间质的胶原沉积和肌成纤维细胞对梗死区域的修复[14]。Ang Ⅱ 1型受体(angiotensin Ⅱ type Ⅰ receptor,AT1R)介导了Ang Ⅱ的大部分病理生理作用,Ang Ⅱ与其结合后可以上调TGF-β1的表达和活性[15]。Ju等[16]对MI大鼠进行AT1R阻断治疗后,梗死边缘区的TGF-β1和Ⅰ型胶原表达显著下降。我们通过免疫组化染色证实了MI大鼠梗死边缘区胶原蛋白和TGF-β1表达显著增加,而进行RDN的MI大鼠TGF-β1表达明显降低,且与Ⅰ型胶原和Ⅲ型胶原的下调表达一致。因此,我们推测RDN可能通过抑制交感神经兴奋和循环中RAAS激活,发挥对心肌局部Ang Ⅱ的抑制作用并下调TGF-β1表达,进而抑制梗死边缘区的胶原沉积,最终改善MI后心室重构并提高心脏功能。
本研究通过建立左冠状动脉前降支结扎的MI大鼠模型,观察了双侧肾交感神经切除对MI后心室重构和心脏功能的影响。我们发现对MI大鼠进行RDN治疗可以显著减轻心室重构并提高左心收缩功能,其作用机制除了直接抑制交感神经兴奋和循环RAAS激活外,可能与局部下调心肌TGF-β1表达进而减少Ⅰ型胶原和Ⅲ型胶原沉积相关。在接下来的研究中,我们将对RDN治疗的MI大鼠进行循环和心肌中Ang Ⅱ、去甲肾上腺素的浓度监测,进一步深入地探讨RDN改善MI后心室重构的作用机制。在动物实验的基础上,我们希望能扩大经导管射频消融RDN的适应证,在未来能够通过微创手术改善心室重构并提高MI患者的预后。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Rouleau J L, de Champlain J, Klein M, Bichet D, Moyé L, Packer M, et al.Activation of neurohumoral systems in postinfarction left ventricular dysfunction[J].J Am Coll Cardiol, 1993, 22:390-398. |
| [2] | Unger T. Neurohormonal modulation in cardiovascular disease[J].Am Heart J, 2000, 139(1 Pt 2):S2-S8. |
| [3] | Symplicity HTN-2 Investigators;Esler M D, Krum H, Sobotka P A, Schlaich M P, Schmieder R E, BLöhm M.Renal sympathetic denervation in patients with treatment-resistant hypertension (The Symplicity HTN-2 Trial):a randomised controlled trial[J].Lancet, 2010, 376:1903-1909. |
| [4] | Brandt M C, Mahfoud F, Reda S, Schirmer S H, Erdmann E, BLöhm M, et al.Renal sympathetic denervation reduces left ventricular hypertrophy and improves cardiac function in patients with resistant hypertension[J].J Am Coll Cardiol, 2012, 59:901-909. |
| [5] | Hu J, Ji M, Niu C, Aini A, Zhou Q, Zhang L, et al.Effects of renal sympathetic denervation on post-myocardial infarction cardiac remodeling in rats[J].PLoS One, 2012, 7:e45986. |
| [6] | Zhang Y, Elsik M, Edgley A J, Cox A J, Kompa A R, Wang B, et al.A new anti-fibrotic drug attenuates cardiac remodeling and systolic dysfunction following experimental myocardial infarction[J].Int J Cardiol, 2013, 168:1174-1185. |
| [7] | Kong P, Christia P, Frangogiannis N G.The pathogenesis of cardiac fibrosis[J].Cell Mol Life Sci, 2014, 71:549-574. |
| [8] | Chen W, Frangogiannis N G.Fibroblasts in post-infarction inflammation and cardiac repair[J].Biochim Biophys Acta, 2013, 1833:945-953. |
| [9] | Weber K T, Sun Y, Bhattacharya S K, Ahokas R A, Gerling I C.Myofibroblast-mediated mechanisms of pathological remodelling of the heart[J].Nat Rev Cardiol, 2013, 10:15-26. |
| [10] | Chapman D, Weber K T, Eghbali M.Regulation of fibrillar collagen types Ⅰ and Ⅲ and basement membrane type Ⅳ collagen gene expression in pressure overloaded rat myocardium[J].Circ Res, 1990, 67:787-794. |
| [11] | Hirsch A T, Talsness C E, Schunkert H, Paul M, Dzau V J.Tissue-specific activation of cardiac angiotensin converting enzyme in experimental heart failure[J].Circ Res, 1991, 69:475-482. |
| [12] | Sun Y, Weber K T.Infarct scar:a dynamic tissue[J].Cardiovasc Res, 2000, 46:250-256. |
| [13] | Danser A H, van Kesteren C A, Bax W A, Tavenier M, Derkx F H, Saxena P R, et al.Prorenin, renin, angiotensinogen, and angiotensin-converting enzyme in normal and failing human hearts.Evidence for renin binding[J].Circulation, 1997, 96:220-226. |
| [14] | Sutton M G, Sharpe N.Left ventricular remodeling after myocardial infarction:pathophysiology and therapy[J].Circulation, 2000, 101:2981-2988. |
| [15] | Rosenkranz S.TGF-beta1 and angiotensin networking in cardiac remodeling[J].Cardiovasc Res, 2004, 63:423-432. |
| [16] | Ju H, Zhao S, Jassal D S, Dixon I M.Effect of AT1 receptor blockade on cardiac collagen remodeling after myocardial infarction[J].Cardiovasc Res, 1997, 35:223-232. |
 2014, Vol. 35
2014, Vol. 35


