2. 北京大学深圳医院感染科, 深圳 518036;
3. 北京大学深圳医院中医科, 深圳 518036;
4. 江西省胸科医院感染科, 南昌 330006;
5. 河北省赵县人民医院病理科, 石家庄 051530
2. Department of Infectious Diseases, Peking University Shenzhen Hospital, Shenzhen 518036, Guangdong, China;
3. Department of Traditional Chinese Medicine, Peking University Shenzhen Hospital, Shenzhen 518036, Guangdong, China;
4. Department of Infectious Diseases, Jiangxi Provincial Chest Hospital, Nanchang 330006, Jiangxi, China;
5. Department of Pathology, People's Hospital of Zhaoxian, Shijiazhuang 051530, Hebei, China
肝纤维化(hepatic fibrosis, HF)是肝脏对各种原因所致肝损伤的“创伤愈合”反应, 是组织发生修复反应时细胞外基质(extracellular matrix,ECM)合成、降解与沉积不平衡而引起的病理过程, 它是各种肝病导致肝硬化的共同途径[1,2], 目前临床仍然缺乏治疗该疾病的合适药物。 我们在前期细胞实验中研究了羟基喜树碱(hydroxycamptothecin,HCPT)对肝星状细胞(hepatic stellate cells,HSCs)的调控作用, 系统地探讨了HCPT对HSCs活化、增殖、凋亡、胶原合成的影响,发现HCPT具有抑制HSCs活化、增殖以及Ⅰ型胶原蛋白及基因表达的作用[3,4,5]。本研究在前述研究基础上进行动物体内实验, 观察HCPT对四氯化碳(CCl4)诱导的肝纤维化大鼠肝脏组织Bax、Bcl-2基因和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)表达及纤维化的影响。 1 材料和方法 1.1 材料
清洁级成年SD大鼠, 体质量200~220 g, 64只, 雌雄各半[实验动物许可证号:SCXK(赣)2005-0001], HCPT粉针(黄石时珍药业集团), α-SMA兔多克隆抗体、DAB显色试剂盒(武汉博士德生物工程有限公司),DeadEnd TUNEL比色法检测系统(Promega公司),分析纯CCl4(天津第四化学试剂厂), RT-PCR试剂盒(北京全式金生物技术有限公司)。引物合成由上海生工生物工程技术服务有限公司完成。 1.2 大鼠肝纤维化模型的制备[6]及处理
大鼠在实验室适应性饲养1 周, 随机分为5组: 正常组(13只)、模型组(13只)、低剂量HCPT治疗组(13只)、中剂量HCPT治疗组(13只)和高剂量HCPT治疗组(12只)。按0.2 mL/100 g给予大鼠腹腔注射40%CCl4花生油溶液(纯40 mL CCl4加花生油至100 mL配成40% CCl4 花生油溶液), 2次/周,共8周,诱导大鼠肝纤维化。正常组用等体积生理盐水腹腔注射, 3次/周; 模型组仅给予CCl4 诱导肝纤维化模型; 低、中、高剂量HCPT治疗组在造模同时分别给予HCPT 0.25、0.5、1.0 mg/kg腹腔注射, 均为3次/周,HCPT浓度均为0.1 mg/mL。实验结束时正常组、模型组及各HCPT治疗组均有10只大鼠存活。 1.3 实验方法
第8周末用戊巴比妥钠(5 mg/100 g)腹腔注射麻醉后处死大鼠, 切取肝脏, 拍照记录, 取肝脏相同部位用于石蜡切片, 分别进行H-E染色、Masson胶原染色,观察大鼠肝组织病理学改变;剪下肝脏左叶50~100 mg大小组织若干块置于冻存管中, 标号后立即置于液氮中保存, 用RT-PCR检测肝组织中Bax、Bcl-2 mRNA表达;其余标本立即置于冷10%中性甲醛中固定, 用免疫组化染色检测肝组织中α-SMA蛋白表达,用TUNEL染色观察细胞凋亡情况。 1.3.1 大鼠肝脏组织病理学观察
用10%甲醛溶液固定,石蜡包埋进行常规H-E染色及Masson染色。肝纤维化病理分期参考中华肝脏病学会肝纤维化学组《肝纤维化诊断及疗效评估共识》[7] 。 1.3.2 RT-PCR检测大鼠肝脏组织中Bax、Bcl-2 mRNA表达
用TRIzol提取肝脏组织总RNA,按试剂盒说明书反转录成cDNA并进行PCR扩增,引物序列: Bax上游 5′-acg cat cca cca aga agc-3′, 下游 5′-gaa gtc cag agt cca gcc-3′,扩增片段长度为272 bp; Bcl-2上游 5′-cct ggc atc ttc tcc ttc-3′, 下游 5′-tgc tga cct cac ttg tgg-3′,扩增片段长度为584 bp;β-actin上游 5′-tca ggt cat cac tat cgg caa t-3′, 下游 5′-aaa gaa agg gtg taa aac gca-3′,扩增片段长度为405 bp。反应条件: 预变性94℃ 4 min,变性 94℃ 30 s,退火 55℃ 30 s,延伸 72℃ 30 s,总延伸 72℃ 5 min,共30个循环。RT-PCR产物经1%琼脂糖凝胶电泳后,用凝胶成像系统照相并用 Bandscan 5.0软件计算基因相对表达量。实验均重复3次取平均值。目的基因相对表达量=(目的基因条带面积×条带强度)/ (β-actin基因条带面积×条带强度)。 1.3.3 免疫组化染色检测大鼠肝脏组织α-SMA蛋白表达
对石蜡切片进行常规烤片、脱蜡水化等处理后滴加α-SMA一抗(稀释为1100),4℃孵育过夜,滴加聚合HRP标记抗兔IgG,37℃孵育30 min,使用DAB显色试剂盒(武汉博士德生物工程有限公司)显色。每张切片分别观察5个不同的显色较好的高倍镜视野, 分别记录染色强度和染色范围。 染色强度分为弱(+)、中(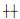 )、强(
)、强( ),较强(
),较强( ), 染色范围占高倍视野<1/4时记录为(+)、1/4至2/4为(
), 染色范围占高倍视野<1/4时记录为(+)、1/4至2/4为(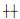 )、>2/4至3/4为(
)、>2/4至3/4为( )、>3/4为(
)、>3/4为( )。 将染色强度和范围换算成染色指数, 即染色指数=染色强度×染色范围(+、
)。 将染色强度和范围换算成染色指数, 即染色指数=染色强度×染色范围(+、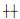 、
、 、
、 分别记为1、2、3、4分), 最后以5个视野染色指数的平均值作为蛋白表达的最终染色指数[8,9]。
1.3.4 大鼠肝脏组织TUNEL染色
分别记为1、2、3、4分), 最后以5个视野染色指数的平均值作为蛋白表达的最终染色指数[8,9]。
1.3.4 大鼠肝脏组织TUNEL染色
按照试剂盒说明书要求配置相关试剂并处理石蜡切片,用DAB试剂盒染色。染色结果判定: 凋亡阳性细胞细胞核染色为浅棕色。 1.4 统计学处理
应用SPSS 13.0软件进行统计学分析, 所有计量资料以 ±s表示, 多样本均数的比较采用单因素方差分析(one-way ANOVA), 组间两两比较采用t检验,等级资料用非参数统计的秩和检验。检验水准(α)为0.05。 2 结 果 2.1 各组大鼠肝脏组织病理学改变
大鼠肝脏组织大体观察: 正常组肝脏色泽红润, 表面光滑, 边缘锐利, 质地柔软; 模型组肝脏明显缩小, 肝脏色泽灰暗, 表面凹凸不平, 边缘粗顿, 质地较硬; 各HCPT治疗组肝脏色泽灰黄, 表面欠光滑,有不同程度颗粒感, 边缘稍粗顿, 质地柔软。 H-E及Masson染色镜下观察:正常组肝脏小叶结构正常, 肝索排列规则有序, 未见有炎症细胞浸润, Masson染色未见异常纤维增生(图 1A、1F); 模型组肝脏小叶结构紊乱, 近汇管区有较多肝细胞脂肪变性, 小叶被纤维分割包绕, 可见假小叶形成, 小叶内大量炎症细胞浸润,Masson染色可见大量纤维增生(图 1B、1G); 各HCPT治疗组肝脏小叶结构紊乱, 有部分小叶纤维间隔形成, 无明显假小叶形成, Masson染色可见程度不等的纤维增生, 随给药剂量增大逐渐减少 (图 1C~1E、1H~1J)。 各组大鼠肝纤维化组织病理学分期比较见表 1, 模型组大鼠出现明显的肝纤维化,各HCPT治疗组的肝纤维化程度较模型组减轻,差异有统计学意义(P均<0.05), 提示HCPT可以减轻大鼠肝纤维化程度。
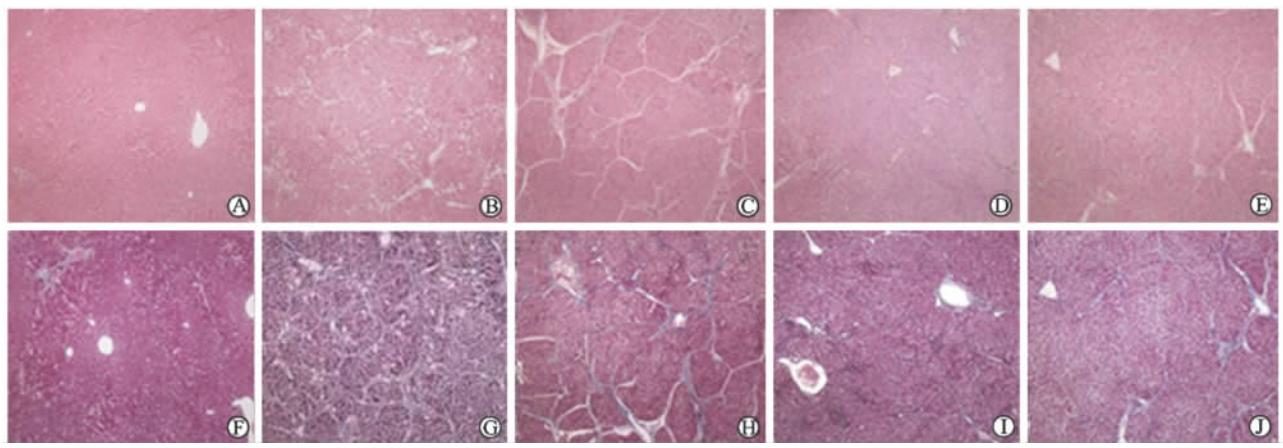 | 图 1 各组大鼠肝脏组织H-E染色(A-E)及Masson染色(F-J) Fig 1 H-E staining (A-E) and Masson staining (F-J) of rat liver tissues in each group A, F: Normal control group; B, G: Model group; C, H: Low-dose hydroxycamptothecin (HCPT) group; D, I: Intermediate-dose HCPT group; E, J: High-dose HCPT group. Original magnification: ×100 |
| 表 1 各组大鼠肝纤维化组织病理学分期 Tab 1 Histopathological findings of rat hepatic fibrosis tissues |
结果如图 2所示, 模型组Bax、Bcl-2 mRNA的表达与 其余各组比较差异均有统计学意义(P均<0.05); HCPT中剂量治疗组Bax、Bcl-2 mRNA的表达与高、低剂量组比较差异均有统计学意义(P均<0.05)。与模型组比较,其余各组Bax/Bcl-2 mRNA比值差异均有统计学意义(P均<0.05);HCPT中剂量治疗组Bax/Bcl-2 mRNA比值与高、低剂量组比较差异均有统计学意义(P均<0.05)。 结果提示HCPT可以影响Bax、Bcl-2 mRNA的表达, 并调节Bax/Bcl-2 mRNA比值。
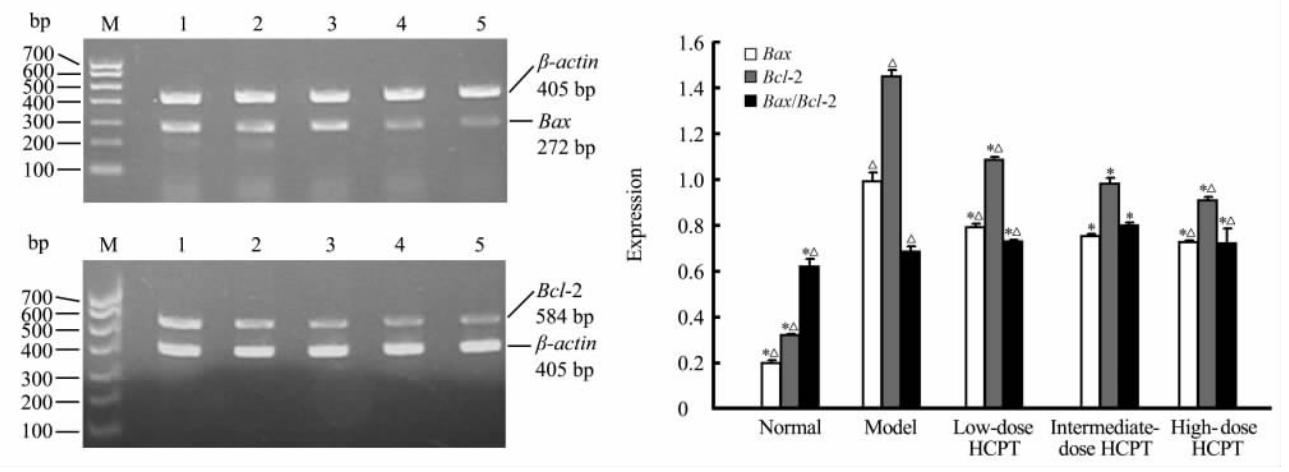 | 图 2 各组大鼠肝组织Bax、Bcl-2 mRNA表达 Fig 2 Expression of Bax and Bcl-2 mRNA in rat liver tissues of each group M: 100 bp marker; 1: Model group; 2: Low-dose hydroxycamptothecin (HCPT) group; 3: Intermediate-dose HCPT group; 4: High-dose HCPT group; 5: Normal control group. *P<0.05 vs model group; △P<0.05 vs intermediate-dose HCPT group. n=10, ±s |
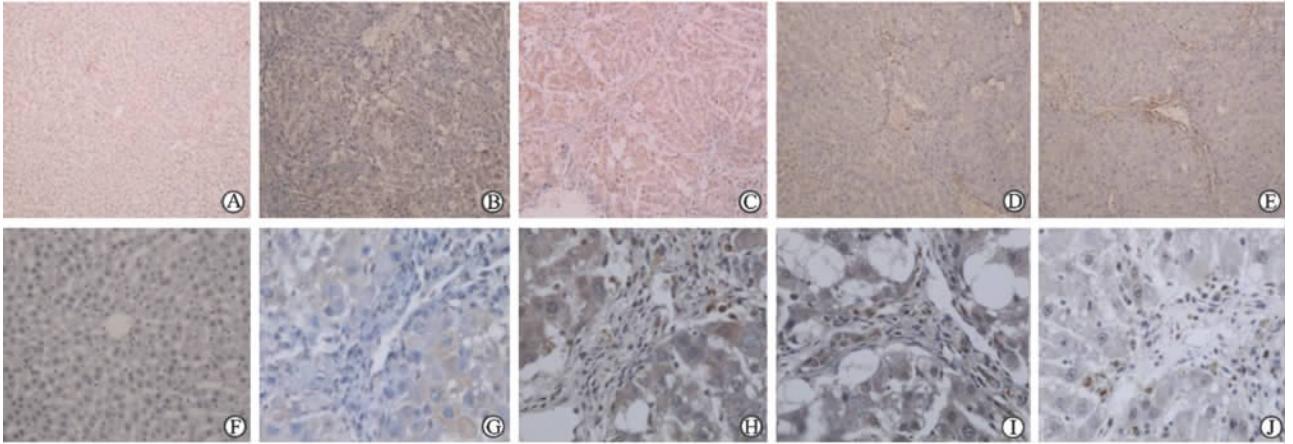
免疫组化染色结果显示,正常组大鼠的肝组织未见有明显α-SMA蛋白表达(图 3A); 模型组大鼠肝组织有α-SMA蛋白大量表达, 主要集中于肝脏组织汇管区, 以纤维间隔中最为明显(图 3B); 各HCPT治疗组大鼠肝组织α-SMA蛋白有较少表达, 主要集中于肝脏组织汇管区, 以纤维间隔中为主(图 3C~3E)。
 | 图 3 各组大鼠肝组织中α-SMA蛋白表达 Fig 3 Expression of α-SMA protein in rat liver tissues of each group α-SMA: α-Smooth muscle actin; HCPT: Hydroxycamptothecin. A-E: Immunohistochemical staining of α-SMA protein (original magnification: ×100); F: Quantitative analysis of α-SMA protein expression. *P<0.05 vs model group; △P<0.05 vs intermediate-dose HCPT group. n=10, ±s |
定量分析结果(图 3F)显示,除HCPT低剂量组外,模型组肝组织α-SMA蛋白表达与其余各组比较差异均有统计学意义(P均<0.05)。HCPT低、中剂量组间α-SMA蛋白表达差异有统计学意义(P<0.05), 而中、高剂量组间差异无统计学意义。 2.4 各组大鼠肝脏组织TUNEL染色
TUNEL染色结果(图 4)显示,正常组、模型组均未见明显阳性染色,各HCPT治疗组可见较多阳性染色;TUNEL阳性染色细胞主要集中于肝脏组织汇管区,以纤维间隔中最为明显(图 4A~4E);高倍镜下可见细胞核染色为浅棕色的凋亡细胞,形态主要为梭形(图 4F~4J)。
 | 图 4 各组大鼠肝组织TUNEL染色 Fig 4 TUNEL staining of rat liver tissues in each group A, F: Normal control group; B, G: Model group; C, H: Low-dose hydroxycamptothecin (HCPT) group; D, I: Intermediate-dose HCPT group; E, J: High-dose HCPT group. Original magnification: ×100 (A-E); ×400 (F-J ) |
HCPT目前主要用于抗肿瘤的治疗, 近几年来关于HCPT除抗肿瘤外的应用研究取得了一些进展。 已有的研究表明HCPT具有抑制细胞增殖、诱导细胞凋亡、干扰细胞信号转导通路、抑制血管生成活性等作用[10,11,12,13,14,15,16], 我们已经在前期的体外实验[3 ,4,5]中发现HCPT可以影响HSCs的活化增殖及胶原合成,因而其可能在肝纤维化的防治研究中存在前景。 本研究采用经过改良的大鼠肝纤维化造模方法, 进行HCPT体内实验以进一步观察该药在动物实验中对肝纤维化的影响。
HSCs的活化是肝纤维化发生发展的核心环节[17 ,18,19,20,21],并且在肝损伤修复过程中也发挥作用[21,22], 抑制HSCs增殖、诱导其凋亡, 从而减少ECM生成是治疗肝纤维化的重点, 寻找能够以HSCs为作用靶点, 进而影响其生物学行为的药物可能成为治疗肝纤维化的新途径。
α-SMA蛋白主要存在于平滑肌细胞与肌成纤维细胞中, 肝脏组织中只有活化的HSCs才能表达,因此α-SMA蛋白的表达被视为HSCs活化的标记,通过观察α-SMA蛋白的表达可以评估HSCs活化增殖情况。 前期实验证实在体外环境下经HCPT干预后HSCs的α-SMA蛋白表达明显降低[5], 本研究通过HCPT体内干预, 发现可以降低大鼠肝脏α-SMA蛋白的表达,与体外细胞实验结果相符, 说明HCPT在动物实验中仍然可以减少HSCs的活化增殖。
目前的研究证实细胞凋亡的调控主要依赖于两个保守的信号转导途径: 死亡受体通路和线粒体通路,Bcl-2家族蛋白则参与了后者的调节。 Bcl-2和Bax是该家族中最具代表性的抑制和促进凋亡基因。 Novo等[23]认为活化的HSCs产生凋亡抗性的主要原因是Bcl-2的过度表达。 因此下调Bcl-2的表达、上调Bax的表达, 改变二者比值可以促进HSCs的凋亡[24]。本研究发现HCPT可以升高Bax/Bcl-2 mRNA比值, 因此有理由认为HCPT可能通过改变Bcl-2家族成员间的动态平衡诱导HSCs凋亡, 并由此削弱HSCs自身所具有的正反馈环路效应[25 ,26],促进活化的HSCs凋亡。本研究还通过设置多个不同给药剂量进行观察,发现中剂量组(0.5 mg/kg)与高(1.0 mg/kg)、低剂量(0.25 mg/kg)组相比,Bax/Bcl-2 mRNA比值差异有统计学意义(P<0.05);但α-SMA蛋白表达在中、高剂量组间差异无统计学意义,因此HCPT给药剂量是否存在最佳剂量值尚难以定论。TUNEL染色在细胞凋亡的研究中应用较广,本研究对肝组织切片的TUNEL染色发现阳性着色细胞主要集中于肝脏组织汇管区,以纤维间隔中最为明显,其分布情况与α-SMA蛋白免疫组化染色区域一致。由此我们可以推断TUNEL染色阳性细胞多为凋亡的HSCs,同时我们还发现各HCPT治疗组中肝细胞未见明显染色,提示本研究中HCPT的剂量没有产生对肝细胞的直接影响。
本研究对各组大鼠肝脏病理的比较分析也验证了通过在肝纤维化过程中使用HCPT进行干预可以明显减轻大鼠肝纤维化的程度,这对应了前期体外细胞实验[3,4,5]及上述分析的结果。 然而我们目前的研究尚十分浅显, HCPT对肝纤维化进程的影响还有待更加深入的研究。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Schuppan D, Krebs A, Bauer M, Hahn E G.Hepatitis C and liver fibrosis[J].Cell Death Differ, 2003, 10(Suppl 1):S59-S67. |
| [2] | Fujiwara A, Sakaguchi K, Fujioka S, Iwasaki Y, Senoh T, Nishimura M, et al.Fibrosis progression rates between chronic hepatitis B and C patients with elevated alanine aminotransferase levels[J].J Gastroenterol, 2008, 43:484-491. |
| [3] | 邓 群, 张 一, 胡国信, 袁 铿, 袁 芳, 黄艳琴.羟基喜树碱对大鼠肝星状细胞增殖抑制的最佳浓度[J].世界华人消化杂志, 2009, 17:554-559. |
| [4] | 张 一, 邓 群, 胡国信, 袁 铿, 袁 芳, 黄艳琴.羟基喜树碱对HSC-T6细胞增殖与凋亡的影响[J].中华肝脏病杂志, 2010, 18:230-234. |
| [5] | 胡国信, 万赞燕, 邵佳亮, 张 一, 张伦理, 龚作炯.羟基喜树碱对大鼠肝星状细胞转化生长因子β1、α-平滑肌肌动蛋白和Ⅰ型胶原表达的影响[J].中华肝脏病杂志, 2012, 20:453-457. |
| [6] | 邵佳亮, 万赞燕, 胡国信.四氯化碳诱导大鼠肝纤维化模型改良的研究[J].南昌大学学报:医学版, 2011, 51:40-42. |
| [7] | 中华肝脏病学会肝纤维化学组.肝纤维化诊断及疗效评估共识[J].药品评价, 2007, 4:265-266. |
| [8] | 徐列明, 刘 平, 吕 刚, 刘 成, 薛惠明, 朱剑亮.Ⅰ、Ⅳ型胶原及板层素在肝纤维化大鼠肝窦周围的变化[J].中华消化杂志, 1995, 15:146-148. |
| [9] | 黄思敏, 汤绍辉, 杨冬华, 段雪辉.姜黄素对肝纤维化大鼠肝组织中α-SMA, PDGF-BB和TGF-β1表达的影响[J].广东医学, 2008, 29:929-931. |
| [10] | Shao R G, Cao C X, Nieves-Neira W, Dimanche-Boitrel M T, Solary E, Pommier Y.Activation of the Fas pathway independently of Fas ligand during apoptosis induced by camptothecin in p53 mutant human colon carcinoma cells[J].Oncogene, 2001, 20:1852-1859. |
| [11] | Lee S, Lee H S, Baek M, Lee D Y, Bang Y J, Cho H N, et al.MAPK signaling is involved in camptothecin-induced cell death[J].Mol Cells, 2002, 14:348-354. |
| [12] | 林景荣, 刘晓明, 包永明, 张振颖, 安利佳, 林熙然.喜树碱抑制HaCaT细胞增殖、诱导凋亡及对端粒酶活性的影响[J].中国皮肤性病学杂志, 2006, 20:586-588. |
| [13] | 赵 婕, 朱桂芝, 宋文荣, 肖春玲.喜树碱软膏治疗银屑病47例[J].中华皮肤科杂志, 1999, 32:134-135. |
| [14] | Czuwara-Ladykowska J, Makiela B, Smith E A, Trojanowska M, Rudnicka L.The inhibitory effects of camptothecin, a topoisomerase Ⅰ inhibitor, on collagen synthesis in fibroblasts from patients with systemic sclerosis[J].Arthritis Res, 2001, 3:311-318. |
| [15] | 莫春柏, 石炳毅, 蔡 明, 钱叶勇, 周文强, 王 燕.10-羟基喜树碱对异基因大鼠心脏移植物急性排斥反应的抑制作用[J].中华器官移植杂志, 2002, 23:347-349. |
| [16] | 叶 孟, 林 蕾, 方 勇, 潘宏铭, 吴金民.羟基喜树碱通过激活NF-κB诱导人乳腺癌Bcap-37细胞凋亡[J].中国病理生理杂志, 2007, 23:146-150. |
| [17] | 陆伦根, 胡俊杰.2012年肝纤维化领域的研究进展[J].中华肝脏病杂志, 2013, 21:84-86. |
| [18] | Iredale J.Defining therapeutic targets for liver fibrosis:exploiting the biology of inflammation and repair[J].Pharmacol Res, 2008, 58:129-136. |
| [19] | Gbele E, MLühlbauer M, Dorn C, Weiss T S, Froh M, Schnabl B, et al.Role of TLR9 in hepatic stellate cells and experimental liver fibrosis[J].Biochem Biophys Res Commun, 2008, 376:271-276. |
| [20] | Soon R K Jr, Yee H F Jr.Stellate cell contraction:role, regulation, and potential therapeutic target[J].Clin Liver Dis, 2008, 12:791-803. |
| [21] | Friedman S L.Hepatic fibrosis-overview[J].Toxicology, 2008, 254:120-129. |
| [22] | 刘 昊, 梁廷波.肝星状细胞在肝再生中的作用[J].中华消化外科杂志, 2011, 10:398-400. |
| [23] | Novo E, Marra F, Zamara E, Valfrè di Bonzo L, Monitillo L, Cannito S, et al.Overexpression of Bcl-2 by activated human hepatic stellate cells:resistance to apoptosis as a mechanism of progressive hepatic fibrogenesis in humans[J].Gut, 2006, 55:1174-1182. |
| [24] | Parajuli D R, Park E J, Che X H, Jiang W Y, Kim Y C, Sohn D H, et al.PF2401-SF, standardized fraction of Salvia miltiorrhiza, induces apoptosis of activated hepatic stellate cells in vitro and in vivo[J].Molecules, 2013, 18:2122-2134. |
| [25] | 张 晶, 李定国, 刘清华, 尤汉宁, 宗春华, 陆汉明.大鼠肝星状细胞表达肾素-血管紧张素-醛固酮系统及其自反馈调节作用[J].肝脏, 2005, 10:86-88. |
| [26] | 张 敏, 吴万春.肝组织肾素-血管紧张素-醛固酮系统与肝纤维化的关系[J].国际消化病杂志, 2009, 29:39-41. |
 2014, Vol. 35
2014, Vol. 35


