2. 重庆市食品药品检验所, 重庆 401121
2. Chongqing Institute for Food and Drug Control, Chongqing 401121, China
阿奇霉素(azithromycin,AM)作为新一代氮杂内酯类抗生素,临床主要用于呼吸道、皮肤和软组织感染[ 1 ]。但是其口服治疗往往伴有胃肠道的各种不良反应,如腹部绞痛、腹泻、恶心、呕吐[ 2 ]等。鉴于此, 将AM制备成了泡囊(niosomes,NS),NS作为药物的载体具有与脂质体相似的性质如组织相容性、细胞亲和性、缓释性等,但却比脂质体不易泄露药物,比磷脂不易氧化和降解,能够降低药物毒副作用[ 3 ],同时也能够促进药物口服生物利用度[ 4,5 ],大大提高药物疗效。本研究采用薄膜分散法制备了AM-NS,所得的AM-NS的粒径为907.4 nm、zeta电位为+14.6 mV以及药物包封率为80.46%。口服给药是最易为患者所接受的常用给药途径之一,适合于各类型的疾病和人群,在各种给药途径中占主导地位[ 3 ]。因此在研究药物口服吸收情况时,有必要研究药物在肠道的吸收情况。在体法具有不损坏研究部位的淋巴和血液循环系统的特点,明显优于离体法。其中单向灌流模型因吸收速率稳定、与人体有良好的相关性而被广泛应用。因此我们采用单向灌流法研究AM-NS在大鼠各个肠段的吸收情况,以此为AM-NS找到准确控制释药部位,同时为提高其生物利用度提供理论依据,并为临床药物动力学与药效学的深入研究奠定基础。
1 材料 1.1 仪器
安捷伦1100型高效液相色谱仪(美国Agilent公司);HL-1恒流泵(上海青浦沪西仪器厂);HHS-4S电子恒温不锈钢水浴锅(上海康路仪器设备有限公司);DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司)。
1.2 药品与试剂AM-NS(自制);AM(含量≥99%,批号: 20101126,上海现代制药股份有限公司);Krebs-Ringer缓冲液(K-R缓冲液,自配);甲醇、乙腈、异丙醇(色谱纯,韩国SK Chemical公司);磷酸氢二钠(分析纯,重庆川东化工有限公司化学试剂厂);其余试剂为分析纯。
1.3 实验动物清洁级SD大鼠,雄性,体质量(230±20) g,实验前未使用过其他药物(重庆医科大学实验动物中心提供)。动物合格证号: SCXK(渝)2011-0001。
2 方法和结果 2.1 HPLC分析方法的建立 2.1.1 色谱条件色谱柱: 伊利特 C18(250 mm×4.6 mm,5 μm);柱温为35℃;流动相为乙腈异丙醇0.002 mol/L磷酸氢二钠溶液=602515(V/V/V),流速为1 mL/min;检测波长215 nm,进样量100 μL。
2.1.2 样品处理方法精密量取适量待测液加入适量甲醇涡旋混合5 min,12 750×g离心10 min,取上清液待测。
2.2 方法学实验 2.2.1 方法专属性实验在选定的色谱条件下,参照2.1.2项下样品的处理方法进行处理,进样。药物的保留时间为6.5 min左右,药物和辅料在2.1.1项色谱条件下能达到有效的分离,且辅料在该色谱条件下对药物的测定无干扰,该方法能够用于AM药浓度的测定。
2.2.2 标准曲线的制备与线性范围的考察精密称取AM对照品100.0 mg,置100 mL容量瓶中,用无水乙醇稀释至刻度。精密吸取上述溶液适量,用无水乙醇稀释成含AM浓度分别为5.0、25.0、50.0、100.0、200.0、500.0、1 000.0 μg/mL的一系列标准溶液。在2.1.1项色谱条件下量取以上溶液各100 μL进样,记录色谱图。以AM峰面积(A)对浓度(C)进行线性回归,得回归方程: A=4.791 5C-14.257,r=0.999 9,在5.0~1 000.0 μg/mL范围内浓度与面积呈良好线性关系。分别配置标准曲线范围内低、中和高3种不同浓度药物溶液(25、50、500 μg/mL),测得回收率均大于98%。日内精密度分别为1.91%、0.23%、0.1%(n=3),日间精密度分别为2.2%、0.49%、0.22%(n=3),符合方法学要求。
2.3 大鼠在体肠灌流实验[6, 7, 8, 9]将6只SD大鼠实验前禁食12 h,不禁水,随机平均分成2组,一组用K-R缓冲液稀释后的AM-NS行在体肠灌流,另一组用含有0.2%羧甲基纤维素钠K-R缓冲液的AM溶液行在体肠灌流。腹腔注射3.5%水合氯醛(10 mL/kg),麻醉并固定,沿腹中线打开腹腔。自幽门以下2 cm处向下取10 cm为十二指肠段;幽门以下15 cm处向下取10 cm为空肠段;盲肠上端2 cm处向上取10 cm为回肠段;盲肠以下10 cm为结肠段。在各肠段始端和末端插管,结扎。用预热至37℃的生理盐水将肠内容物冲洗干净,伤口处用浸有生理盐水的脱脂棉覆盖保湿,红外灯下保温。接恒流泵,以0.4 mL/min的流速,用空白K-R缓冲液饱和整个管道15 min后,排空液体。接含药灌流液开始单向灌流实验,流速0.2 mL/min,计时1 h。四段出口处分别用25 mL的容量瓶接流出液体。实验后取下容量瓶用K-R缓冲液稀释至刻度。剪下肠段,测量其长度(l)和内径(r)。
2.4 数据处理药物吸收速率常数(Ka)和有效渗透率(Peff)的计算[ 5 ]: Ka=(X0-Xt )/C0 t、Peff=Q*ln (Xin/Xout) / 2πrl,式中,X0 和Xt分别表示药物初始量和灌流液中剩余药物量,C0表示药物初始浓度,t为灌流时间,Q代表流速,Xin 和Xout 分别表示流入和流出的药物量,r和l分别表示灌流肠段的内径和长度。数据采用Excel 2003软件进行单因素方差分析。
2.5 测定结果根据测得的AM含量,计算得到AM和AM-NS的Ka和Peff,结果见图 1。
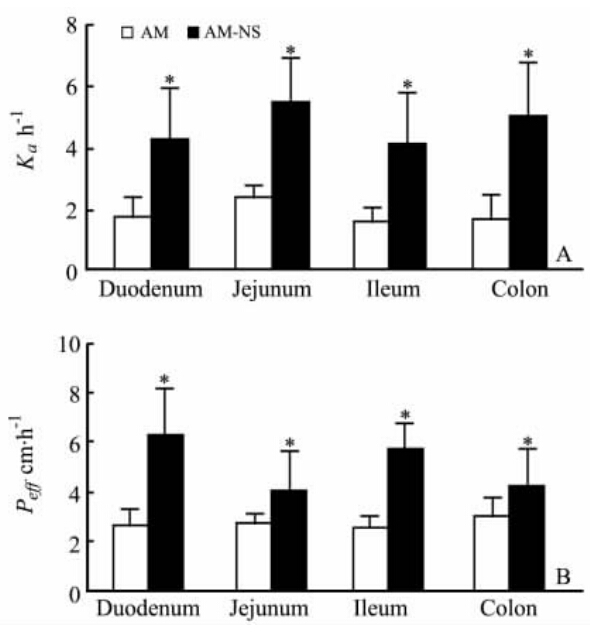 | 图 1 大鼠各肠段吸收速率常数Ka(A)和有效渗透率Peff(B)Fig 1 Absorption rate constant (Ka,A) and apparent permeability coefficients (Peff,B) for four different intestinal segments of ratsAM: Azithromycin; AM-NS: Azithromycin niosomes. *P<0.05 vs AM group. n=3, ±s |
结果表明,AM-NS十二指肠、空肠、回肠、结肠4个肠段的Ka和Peff比AM都有明显的提高,其中Ka分别是原料药的2.41、2.35、2.54、2.95倍,Peff分别是原料药的2.34、1.47、2.20、1.40倍。AM-NS在大鼠各肠段净累积吸收量均高于AM(P<0.05),说明将AM制备成NS有助于AM的口服吸收。
3 讨 论常用的研究药物肠道吸收的生物学方法大体上可分为3种: 离体实验模型、原位实验模型和细胞培养模型-人类结肠癌细胞系[ 10 ]。本实验用原位实验模型中的大鼠单向灌流对AM在大鼠各肠段吸收进行研究。单向灌流法是以一种较低流速对一定肠段进行灌流,可避免在体循环法以较高流速长时间回流供试液所造成的肠黏膜损伤和药物的吸收增大,结果使测得值与真实值产生较大偏离[ 11 ]。该方法既保证了肠道神经、内分泌输入的完好性,也保证了血液及淋巴液的供应。但由于肠道对水分有少量吸收,因此需要对灌流液体积的变化进行校正,文献报道采用不被肠吸收的酚红为“标示物”以标示灌流液体积的变化[ 12,13 ],但酚红也有一定的肠吸收并干扰某些药物的肠道转运和分析测定。因此本研究对灌流后收集的液体进行体积定量及数据处理。单向灌流法的灌流速度在一定程度上代表了肠道蠕动的生理状态,通常随着灌流速度的增加,肠道的吸收速率常数明显增加。文献报道健康志愿者体内肠灌流速度多选用2~3 mL/min[ 14 ],由于大鼠肠道的直径约为人体肠道的1/10,因而本研究选择灌流速度为0.2 mL/min,这样更接近人体空腹状态的实际情况。
由实验结果可知,AM-NS的Ka和Peff都较AM明显提高,原因可能为AM-NS的双层结构与生物膜相似,具有良好的组织相容性和细胞亲和力,促进药物通过细胞膜,从而提高药物的Ka和Peff。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Escudero E, Fernández-Varón E, Marín P, Espuny A, Nájera M D, Cárceles C M.Pharmacokinetics and tissue tolerance of azithromycin after intramuscular administration to rabbits[J].Res Vet Sci, 2006, 81:366-372. |
| [2] | Dunn C J, Barradell L B.Azithromycin.A review of its pharmacological properties and use as 3-day therapy in respiratory tract infection[J].Drug, 1996, 51:483-505. |
| [3] | 崔福德.药剂学[M].6版.北京:人民卫生出版社, 2008:454-456. |
| [4] | Hong M, Zhu S, Jiang Y, Tang G, Pei Y.Efficient tumor targeting of hydroxycamptothecin loaded PEGylated niosomes modifed with transferring[J].J Contr Rel, 2009, 133:96-102. |
| [5] | Mokhtar M, Sammour O A, Hammad M A, Megrab N A.Effect of some formulation parameters on flurbiprofen encapsulation and release rates of niosomes prepared from proniosomes[J].Int J Pharm, 2008, 361(1-2):104-111. |
| [6] | Li H, Zhao X, Ma Y, Zhai G, Li L, Lou H.Enhancement of gastrointestinal absorption of quercetin by solid lipid nanoparticles[J].J Contr Rel, 2009, 133:238-244. |
| [7] | Peng Q, Zhang Z R, Sun X, Zuo J, Zhao D, Gong T.Mechanisms of phospholipid complex loaded nanoparticles enhancing the oral bioavailability[J].Mol Pharm, 2010, 7:565-575. |
| [8] | Kim J S, Mitchell S, Kijek P, Tsume Y, Hilfinger J, Amidon G L.The suitability of an in situ perfusion model for permeability determinations:utility for BCS classlbiowaiver requests[J].Mol Pharm, 2006, 3:686-694. |
| [9] | Dahan A, West B T, Amidon G L.Segmental-dependent membrane permeability along the intestine following oral drug administration:evaluation of a triple single-pass intestinal perfusion (TSPIP) approach in the rat[J].Eur J Pharm Sci, 2009, 36(2-3):320-329. |
| [10] | 李 高, 方 超.药物肠道吸收的生物学研究方法[J].中国药学杂志, 2002, 37:726-729. |
| [11] | Zhang T, Chen J, Zhang Y, Shen Q, Pan W.Characterization and evaluation of nanostructured lipid carrier as a vehicle for oral delivery of etoposide[J].Eur J Pharmaceut Sci, 2011, 43:174-179. |
| [12] | 胡霓霓, 杨 林, 滕永真, 黄开顺, 张景勍.美斯地浓磷脂复合物的制备及其对大鼠在体肠吸收的促进作用[J].第二军医大学学报, 2013, 34:53-57. Hu N N, Yang L, Teng Y Z, Huang K S, Zhang J Q.Preparation of mestinon-phospholipid complex and its promoting effect on intestinal absorption in rats[J].Acad J Sec Mil Med Univ, 2013, 34:53-57. |
| [13] | 李草草, 张振海, 张银龙, 吕慧侠, 周建平.穿膜肽修饰紫杉醇固体脂质纳米粒的大鼠在体肠吸收研究[J].药学学报, 2013, 48:131-137. |
| [14] | Stewart B H, Chan O H, Lu R H, Reyner E L, Schmid H L, Hamilton H W, et al.Comparison of intestinal permeabilities determined in multiple in vitro and in situ models:relationship to absorption in humans[J].Pharm Res, 1995, 12:693-699. |
 2014, Vol. 35
2014, Vol. 35


