2. 重庆医科大学附属儿童医院骨科, 重庆 400014;
3. 重庆医科大学附属儿童医院儿科研究所干细胞实验室, 重庆 400014
2. Department of Orthopedics, Children's Hospital of Chongqing Medical University, Chongqing 400014, China;
3. Stem Cell Laboratory, Pediatric Institute, Children's Hospital of Chongqing Medical University, Chongqing 400014, China
近年来纳米技术研究成为一个迅速兴起的领域,其中超顺磁性四氧化三铁纳米粒子(superparamagnetic iron oxide nanoparticles,SPIONs)由于其所具有的超顺磁性而受到人们广泛的关注[1,2]。所谓的超顺磁性是指将材料置于磁场中可显示磁性,而当磁场消失后,材料的磁性也随之消失[3],当四氧化三铁纳米粒子的粒径≤30 nm时,颗粒间的热振动能足以克服磁吸引力,从而呈现超顺磁性[4]。SPIONs是目前唯一经批准用于临床的磁性纳米粒子[5],现已被应用于核磁共振成像[6]、药物[7]和基因[8]的靶向传递、高热治疗肿瘤[9]等方面,但是它的生物相容性仍然是人们关注的问题。
SPIONs的生物相容性决定了其使用范围和应用前景,受到包括粒径大小、表面电荷、稳定性等众多因素的影响,对SPIONs进行表面修饰是改变其生物相容性的重要措施[10,11]。本研究选用壳聚糖和油酸钠修饰的SPIONs,使其作用于体外培养的人肺腺癌细胞A549,探讨2种SPIONs对A549细胞的生物效应,从而评价其细胞毒性。
1 材料和方法 1.1 材料及试剂A549细胞(重庆医科大学附属第一医院肿瘤实验室提供),壳聚糖和油酸钠修饰的SPIONs(重庆医科大学附属儿童医院生物材料实验室制备,制备方法参照文献[12, 13])。RPMI 1640培养基、胎牛血清(美国Hyclone公司),胰蛋白酶、四甲基偶氮唑盐(MTT,碧云天生物技术研究所),二甲亚砜(DMSO,北京索莱宝科技有限公司),乳酸脱氢酶(lactic dehydrogenase,LDH)试剂盒(南京建成生物工程研究所),4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI,美国Sigma公司),亚铁氰化钾(成都科龙化工试剂厂),其他化学试剂均为分析纯。
1.2 2种SPIONs悬液的制备及其形态观察应用电子天平精确称量壳聚糖和油酸钠修饰的SPIONs各5 mg,加入5 mL含10%胎牛血清的RPMI 1640培养液,配制成质量浓度为1.0 mg/mL的母液,采用旋涡振荡器初步混悬后置于超声波破碎仪 (Scientz-IID,宁波新芝生物科技股份有限公司)中超声处理30 s(每次6 s,间隔10 s,重复5次),应用透射电子显微镜(Hitachi-600,日本日立公司)观察壳聚糖SPIONs和油酸钠SPIONs的形态。染毒实验设立5个剂量组,以含10%胎牛血清的RPMI 1640培养液对母液进行不同比例的稀释,各组终浓度分别为 0、25、50、100和200 μg/mL,采用同样的方法进行混悬和超声处理后立即用于细胞染毒。
1.3 普鲁士蓝染色法观察2种SPIONs在A549细胞内的分布将对数生长期的A549细胞按1×105/孔均匀接种至6孔培养板,用10 μg/mL 壳聚糖SPIONs和油酸钠SPIONs悬液处理A549细胞4 h后进行检测。吸弃培养液,用预冷磷酸盐缓冲液(PBS)洗细胞3遍,4%多聚甲醛室温固定20 min,吸弃多聚甲醛,PBS洗细胞3遍,每孔加入2%亚铁氰化钾和2%盐酸等体积混合液2 mL,孵育25 min后PBS洗细胞3遍,倒置荧光显微镜(Eclipse Ti-S,Nikon公司)下观察细胞颜色变化。
1.4 MTT法检测A549细胞活性
将5×103/孔A549细胞均匀接种至96孔培养板,分别加入0、25、50、100和200 μg/mL的壳聚糖SPIONs和油酸钠SPIONs悬液,各组均设6个复孔,分别于24、48、72 h进行检测。吸弃培养液,加入180 μL新鲜培养液和20 μL MTT液(5 mg/mL),继续培养4 h后吸弃上清,加入150 μL DMSO,置于摇床上摇10 min,酶联免疫检测仪(MK3,芬兰Thermo公司)570 nm波长处检测各孔光密度(D)值,计算细胞的相对生存率。相对生存率=(实验组D值-对照组D值)/对照组D值。
1.5 细胞培养液上清液中LDH活性检测收集1.4项下壳聚糖SPIONs和油酸钠SPIONs悬液染毒处理A549细胞48 h时培养液上清,按照LDH试剂盒使用说明进行操作,检测LDH活性。
1.6 DAPI染色法检测A549细胞凋亡情况A549细胞按1×105/ 孔均匀接种至6孔培养板,200 μg/mL 壳聚糖SPIONs和油酸钠SPIONs悬液染毒处理A549细胞48 h时,吸弃培养液,用预冷PBS洗细胞3遍,4%多聚甲醛室温固定20 min,吸弃多聚甲醛,PBS洗细胞3遍,每孔加入2 μg/mL DAPI 0.5 mL,37℃避光孵育10 min,PBS洗细胞3遍,倒置荧光显微镜观察。每个样本随机选取5个非重复视野,每个视野随机计数100 个细胞,以含有浓缩、聚集染色质或碎裂细胞核的细胞计为凋亡细胞。凋亡率(%)=凋亡细胞数/计数细胞数×100%。
1.7 统计学处理
应用SPSS 19.0软件进行分析,计量数据以 ±s表示,组间经方差齐性分析为齐性后采用方差分析,组间两两比较采用LSD-t检验。检验水准(α)为0.05。
2 结 果 2.1 2种SPIONs的形态学表征透射电子显微镜下可见 壳聚糖SPIONs和油酸钠SPIONs均为类球形结晶,表面光滑且形状规则,粒径为20~30 nm,此时四氧化三铁纳米粒子之间的热振动能足以克服磁吸引力而呈现超顺磁性。见图 1。
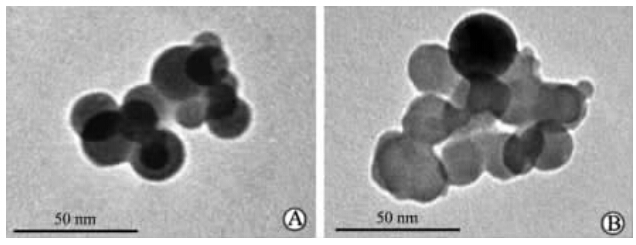 | 图 1 壳聚糖SPIONs(A)和油酸钠SPIONs(B)透射电子显微镜照片Fig 1 Transmission electron micrographs of chitosan-SPIONs(A) and sodium oleate-SPIONs(B) SPIONs: Superparamagnetic iron oxide nanoparticles |
结果如图 2所示,A549细胞在经10 μg/mL的壳聚糖SPIONs和油酸钠SPIONs孵育4 h后,可见细胞内均有蓝色沉着,说明壳聚糖SPIONs和油酸钠SPIONs均能进入细胞,并且大部分分布于细胞核周围的胞质内。
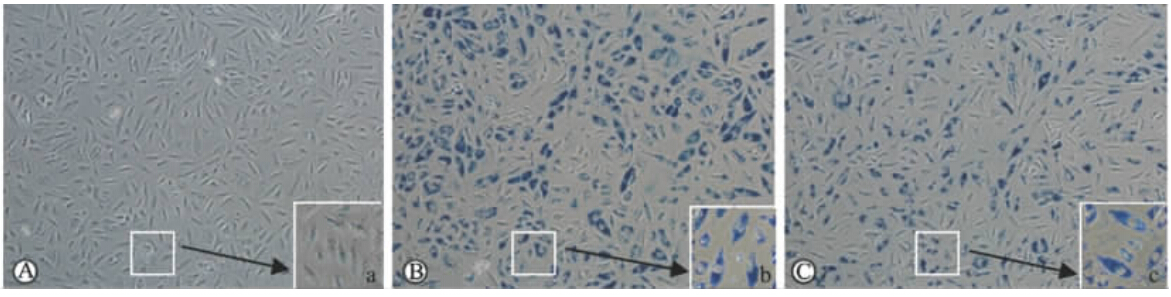 | 图 2 普鲁士蓝染色示壳聚糖SPIONs和 油酸钠SPIONs在A549细胞内的分布情况Fig 2 Prussian blue staining showed intracellular distribution of chitosan-SPIONs and sodium oleate-SPIONs in A549 cells SPIONs: Superparamagnetic iron oxide nanoparticles. A: Control group (not modified SPIONs); B: Chitosan-SPIONs group; C: Sodium oleate-SPION group. Original magnification: ×100(A-C); ×200(a-c) |
结果如图 3所示,壳聚糖SPIONs几乎不影响细胞的生长活性,在200 μg/mL浓度时,细胞仍然有80%的生存率(P<0.05,图 3A);而油酸钠SPIONs染毒的A549细胞在油酸钠SPIONs浓度大于50 μg/mL时生存率在不同时间点均随着其浓度的增大而降低,当油酸钠SPIONs浓度为100 μg/mL时,细胞生存率已较对照组低(P<0.05),当浓度达到200 μg/mL时,48 h时仅有不到60%的细胞存活(图 3B)。当壳聚糖SPIONs和油酸钠SPIONs浓度为200 μg/mL时,油酸钠SPIONs染毒A549细胞后的细胞生存率明显低于壳聚糖SPIONs染毒的细胞,说明一定浓度范围内油酸钠SPIONs对细胞的生存率影响较壳聚糖SPIONs大。
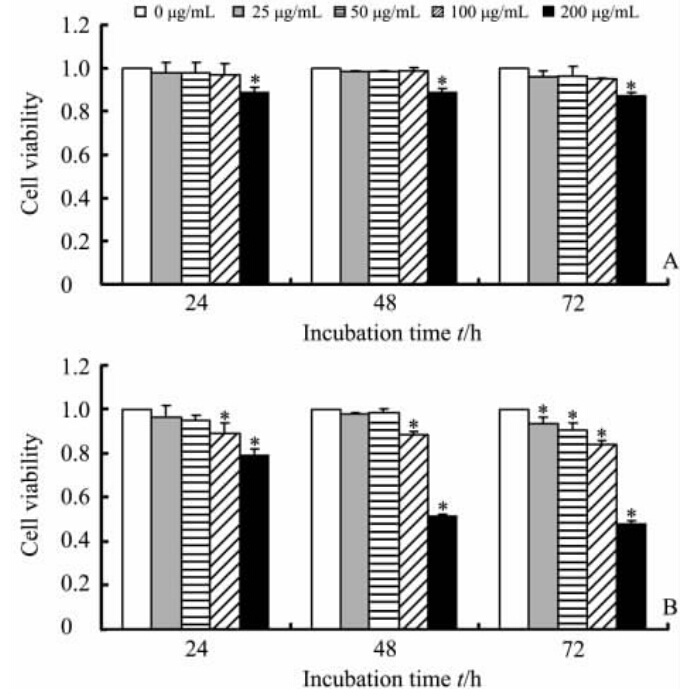 | 图 3 不同浓度的壳聚糖SPIONs(A)和油酸钠SPIONs(B)对A549细胞活性的影响Fig 3 Influence of different concentrations of chitosan-SPIONs(A) or sodium oleate-SPIONs(B) on A549 cell viability SPIONs: Superparamagnetic iron oxide nanoparticles. *P<0.05 vs control group (0 μg/mL). n=6, ±s |
A549细胞经不同浓度的壳聚糖SPIONs和油酸钠SPIONs悬液染毒处理48 h,其上清液中LDH活性变化情况如图 4所示。壳聚糖SPIONs染毒组LDH活性与对照组相比有轻度增高,仅200 μg/mL 浓度时差异具有统计学意义(P<0.05);100 μg/mL和200 μg/mL油酸钠 SPIONs 染毒组LDH活性高于对照组 (P<0.05),同时也高于同浓度壳聚糖 SPIONs 染毒组 (P<0.05),说明高浓度油酸钠 SPIONs 能够使细胞释放更多的LDH至培养液中。
2.5 2种SPIONs对细胞凋亡的影响结果如图 5所示。荧光显微镜下可见对照组和200 μg/mL壳聚糖SPIONs染毒处理48 h时的细胞胞核完整,呈椭圆形,核仁清晰可见,胞核内染色质密度均匀一致,凋亡率差异无统计学意义(P>0.05),而200 μg/mL油酸钠SPIONs 悬液处理48 h时的A549细胞可见部分胞核皱缩及胞核碎裂,呈典型的凋亡形态,其凋亡率高于对照组及壳聚糖SPIONs染毒组,差异具有统计学意义(P<0.05),提示油酸钠SPIONs可能通过影响细胞凋亡发挥细胞毒性作用。
 | 图 4 不同浓度的壳聚糖SPIONs和油酸钠SPIONs悬液染毒A549细胞后上清液中LDH活性Fig 4 LDH activity in supernatant of A549 cells treated with different concentrations of chitosan-SPIONs or sodium oleate-SPION SPIONs: Superparamagnetic iron oxide nanoparticles. *P<0.05 vs control group (no modified SPIONs); △P<0.05 vs chitosan-SPIONs group. n=6, ±s |
SPIONs具有粒径小、比表面积大、磁效应等特性,尤其是它所具有的超顺磁性使其能在交变磁场中产生热量[14]或者是在外加磁场作用下被靶向到特定的组织或器官[15],这使其在将来的生物医学领域有着广泛的应用前景。SPIONs的生物相容性是关系到其应用的重要因素,而修饰材料是影响其生物相容性的一个关键因素[16]。本实验研究了壳聚糖和油酸钠修饰的SPIONs的体外细胞毒性,为其将来的临床应用提供实验依据。
壳聚糖是由甲壳素经脱乙酰化处理后得到的阳离子聚合物,是一种可降解吸收的天然高分子生物材料,生产成本低且具有良好的生物相容性,近年来已用于生物制药和药物释放领域[17]。油酸钠作为一种阴离子表面活性剂[18],水溶性较好,具有较高的稳定性,常作为稳定剂使用[19]。壳聚糖和油酸钠是2种常用的表面修饰材料。本研究是为后期的肺部药物靶向研究做准备,因此我们选用了人肺腺癌A549细胞作为研究对象。A549细胞作为一种肺上皮细胞,易于培养,对外加因子较敏感,因此常被用于纳米材料的毒性实验中[20,21]。
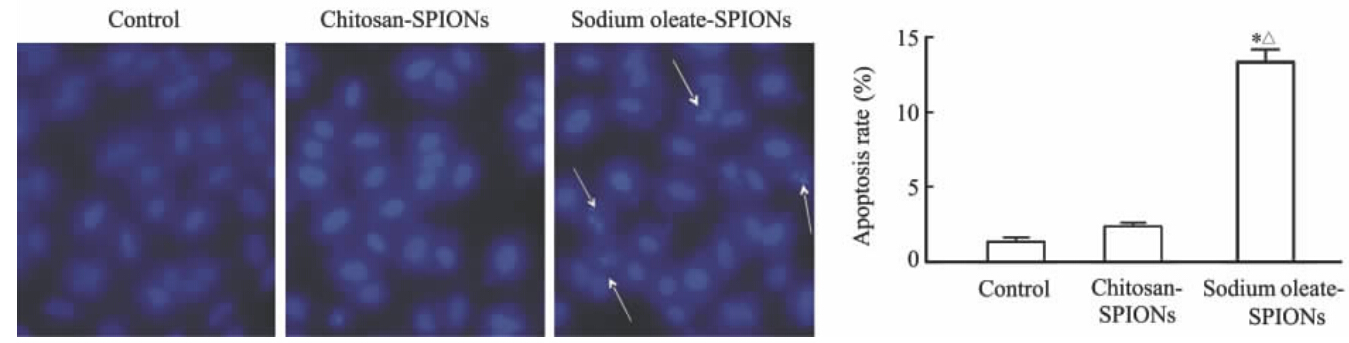 | 图 5 DAPI 染色显示壳聚糖SPIONs和油酸钠SPIONs处理48 h对A549细胞凋亡的影响Fig 5 DAPI dye showed apoptosis of A549 cells after 48 h exposure to chitosan-SPIONs or sodium oleate-SPIONs SPIONs: Superparamagnetic iron oxide nanoparticles. DAPI: 4’,6-diamidino-2-phenylindole. Arrows indicate apoptotic cells. Original magnification: ×400. *P<0.05 vs control group (no modified SPIONs); △P<0.05 vs chitosan-SPIONs group. n=5, ±s |
本研究中普鲁士蓝染色结果显示壳聚糖SPIONs和油酸钠SPIONs均能进入A549细胞内,且主要分布在细胞周围的胞质内,相同浓度下细胞的载铁能力基本无差异。MTT检测结果显示在200 μg/mL 浓度范围内壳聚糖SPIONs组细胞的生存率高于油酸钠SPIONs组。LDH是一种可溶性细胞质酶,当细胞凋亡或坏死时细胞膜受损或通透性增加,LDH可漏出至细胞外,故细胞培养液上清中LDH 活性大小可反映细胞膜的受损和细胞的凋亡程度[22]。本实验中LDH活性检测结果显示,高浓度壳聚糖SPIONs和高浓度油酸钠SPIONs染毒的细胞上清液中的LDH活性均有所升高,且高浓度油酸钠SPIONs组的LDH活性升高较显著,表明高浓度油酸钠SPIONs对细胞膜的损伤较重,而壳聚糖SPIONs组细胞膜的破坏不是很严重,这与MTT实验结果相似。Watanabe等[23]用Toda Kogyo公司生产的SPIONs作用于A549细胞,Alamar-Blue(阿尔玛蓝)法检测细胞活性,结果当SPIONs的浓度为100 μg/mL 时细胞的生存率降低,与正常对照组 间差异有统计学意义,且上清液中的LDH活性显著增高,接近正常对照组的2.5倍。Hong 等[24]用化学共沉淀法分别合成各种材料包覆的SPIONs作用于L-929成纤维细胞,检测上清液中的LDH活性,在1 000 μg/mL 时也仅是正常对照组的108%,但是细胞活性检测发现,当SPIONs浓度为400 μg/mL 时,细胞生存率已经开始明显下降,推测SPIONs对细胞的急性毒性作用不是由于对细胞膜的物理损伤造成的。因此,不同细胞对SPIONs毒性的耐受能力不等,不同材料包覆的SPIONs的细胞毒性有很大差异且产生毒性的原因不尽相同。
细胞凋亡是细胞受外来或内源性刺激后的一种主动死亡形式。Naqvi 等[25]用500 μg/mL Tween 80修饰的SPIONs作用于小鼠巨噬细胞系J774,Hoechst-PI双染可见细胞核呈碎块状致密浓染,表明Tween 80修饰的SPIONs引发了细胞凋亡,这与检测到的细胞内的活性氧的结果相似,因此推测可能是SPIONs引起细胞内的氧化应激反应导致活性氧含量增高从而引发细胞凋亡。本研究也观察到高浓度油酸钠SPIONs引起细胞核破碎,凋亡细胞数目明显增多,而高浓度壳聚糖SPIONs组细胞仅有少量凋亡。有研究报道了当用油酸钠对红细胞进行体外染毒时,随着油酸钠浓度的增高,红细胞内谷胱甘肽的含量降低,说明油酸钠诱使红细胞发生氧化应激反应,这也可能是油酸钠SPIONs产生细胞凋亡的一个原因[26],下一步我们将对其影响细胞凋亡可能的分子生物学机制进行探讨。
综上所述,高浓度的壳聚糖SPIONs相对于油酸钠SPIONs的细胞毒性要小。本研究为将来应用于药物靶向实验SPIONs的选择提供了实验依据。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Tran P H, Tran T T, Vo T V, Lee B J. Promising iron oxide-based magnetic nanoparticles in biomedical engineering[J].Arch Pharm Res, 2012, 35:2045-2061. |
| [2] | Xu C, Sun S. New forms of superparamagnetic nanoparticles for biomedical applications[J].Adv Drug Deliv Rev, 2013, 65:732-743. |
| [3] | 李 黎, 马 力. Fe3O4磁性微粒的制备及表征[J].中国组织工程研究与临床康复, 2011, 15:6385-6387. |
| [4] | 罗 聪, 安 洪, 蒋电明, 杨晓兰, 朱照静, 赖国旗. 振荡磁场下超顺磁性链霉素PELA微球体外药物释放特征探索[J].中国抗生素杂志, 2008, 33:101-105. |
| [5] | Mahmoudi M, Simchi A, Milani A S, Stroeve P. Cell toxicity of superparamagnetic iron oxide nanoparticles[J].J Colloid Interface Sci, 2009, 336:510-518. |
| [6] | Ito A, Shinkai M, Honda H, Kobayashi T. Medical application of functionalized magnetic nanoparticles[J].J Biosci Bioeng, 2005, 100:1-11. |
| [7] | Gupta A K, Gupta M. Synthesis and surface engineering of iron oxide nanoparticles for biomedical applications[J].Biomaterials, 2005, 26:3995-4021. |
| [8] | Veiseh O, Gunn J W, Kievit F M, Sun C, Fang C, Lee J S, et al. Inhibition of tumor-cell invasion with chlorotoxin-bound superparamagnetic nanoparticles[J].Small, 2009, 5:256-264. |
| [9] | Johannsen M, Thiesen B, Wust P, Jordan A. Magnetic nanoparticle hyperthermia for prostate cancer[J].Int J Hyperthermia, 2010, 26:790-795. |
| [10] | Sun Z, Yathindranath V, Worden M, Thliveris J A, Chu S, Parkinson F E, et al. Characterization of cellular uptake and toxicity of aminosilane-coated iron oxide nanoparticles with different charges in central nervous system-relevant cell culture models[J].Int J Nanomedicine, 2013, 8:961-970. |
| [11] | Murray A R, Kisin E, Inman A, Young S H, Muhammed M, Burks T, et al. Oxidative stress and dermal toxicity of iron oxide nanoparticles in vitro[J].Cell Biochem Biophys, 2013, 67:461-476. |
| [12] | 郭利锋, 黄 华, 罗 聪, 杨学恒. 超顺磁性四氧化三铁壳聚糖纳米粒的制备和结构表征[J].重庆医科大学学报, 2010, 35:1690-1692. |
| [13] | 张玉坤, 罗 聪, 朱朝敏. 超顺磁性Fe3O4纳米粒的制备及其对小鼠的急性毒性作用[J].第三军医大学学报, 2011, 33:1224-1227. |
| [14] | Williams J P, Southern P, Lissina A, Christian H C, Sewell A K, Phillips R, et al. Application of magnetic field hyperthermia and superparamagnetic iron oxide nanoparticles to HIV-1-specific T-cell cytotoxicity[J].Int J Nanomedicine, 2013, 8:2543-2554. |
| [15] | Rudolph C, Gleich B, Flemmer A W. Magnetic aerosol targeting of nanoparticles to cancer: nanomagnetosols[J].Methods Mol Biol, 2010, 624:267-280. |
| [16] | Singh N, Jenkins G J, Asadi R, Doak S H. Potential toxicity of superparamagnetic iron oxide nanoparticles (SPION)[J].Nano Rev, 2010, 1:5358-5400. |
| [17] | Wang A H, Chen X G, Liu C S, Meng X H, Yu L J, Wang H. Preparation and characteristics of chitosan microspheres in different acetylation as drug carrier system[J].J Microencapsul, 2009, 26:593-602. |
| [18] | 张银燕, 尹衍升, 张金升, 马来鹏. 纳米Fe3O4磁性液体稳定性的研究[J].化学物理学报, 2004, 17:83-86. |
| [19] | 陈延明, 聂晓波, 李凤红, 马启朋. 油酸钠为稳定剂合成CdS_CdSe纳米粒子及表征[J].沈阳工业大学学报, 2013, 4:1-5. |
| [20] | Casey A, Herzog E, Lyng F M, Byrne H J, Chambers G, Davoren M. Single walled carbon nanotubes induce indirect cytotoxicity by medium depletion in A549 lung cells[J].Toxicol Lett, 2008, 179:78-84. |
| [21] | Sun T, Yan Y, Zhao Y, Guo F, Jiang C. Copper oxide nanoparticles induce autophagic cell death in A549 cells[J].PLoS One, 2012, 7:e43442. |
| [22] | 杨 辉, 杨丹凤, 张华山, 张 伟, 刘焕亮, 刘 超, 等. 4种典型纳米材料对小鼠胚胎成纤维细胞毒性的初步研究[J].生态毒理学报, 2007, 2:427-434. |
| [23] | Watanabe M, Yoneda M, Morohashi A, Hori Y, Okamoto D, Sato A, et al. Effects of Fe3O4 magnetic nanoparticles on A549 cells[J].Int J Mol Sci, 2013, 14:15546-15560. |
| [24] | Hong S C, Lee J H, Lee J, Kim H Y, Park J Y, Cho J, et al. Subtle cytotoxicity and genotoxicity differences in superparamagnetic iron oxide nanoparticles coated with various functional groups[J].Int J Nanomedicine, 2011, 6:3219-3231. |
| [25] | Naqvi S, Samim M, Abdin M, Ahmed F J, Maitra A, Prashant C, et al. Concentration-dependent toxicity of iron oxide nanoparticles mediated by increased oxidative stress[J].Int J Nanomedicine, 2010, 5:983-989. |
| [26] | 房晓燕. 从BSA、胰蛋白酶和红细胞角度评价油酸钠的生物毒性和机理[D].济南:山东大学环境科学与工程学院, 2012. |
 2014, Vol. 35
2014, Vol. 35


