2. 第三军医大学军事预防医学院全军复合伤研究所, 创伤、烧伤与复合伤国家重点实验室, 重庆 400038;
3. 解放军441医院防疫科, 福鼎 355200;
4. 第三军医大学军事预防医学院毒理学研究所, 重庆 400038
2. State Key Laboratory of Trauma, Burns and Combined Injury, Institute of Combined Injury of PLA, College of Preventive Medicine, Third Military Medical University, Chongqing 400038, China;
3. Department of Epidemic Prevention, No. 441 Hospital of PLA, Fuding 355200, Fujian, China;
4. Institute of Toxicology, College of Preventive Medicine, Third Military Medical University, Chongqing 400038, China
随着人类基因组计划及越来越多真核生物基因组的完成,生物医学研究已进入后基因组时代,研究的热点从基因测序转移到基因的功能研究[1]。探明基因功能常用的方法是基因突变,包括自发突变、理化诱导突变、基因打靶及基因捕获等。自发突变频率较低,且只有出现表型可见才能被研究。X射线或化学诱导等理化因素诱导的突变常引起染色体重排而影响多个基因或产生点突变,但却无基因克隆的标记[2]。基因打靶需要其定点突变的基因序列明确,且比较耗时、耗力,对“多效”、“多余”的基因则力不从心[3]。基因捕获结合报告基因和筛选基因,能够追踪基因的时空表达模式,可以分离出“多效”、“多余”的基因[4];基因捕获载体插入还可使基因失活,达到“基因敲除”的效果[5],适合于检测短暂表达或表达水平较低的基因[6]、多效基因[4],还可能发现新基因[7]。目前,它已被广泛应用于胚胎发育[5]、细胞分化[8]及恶性转化[9]等重要生命过程相关基因的研究。本课题组前期利用基因捕获技术建立了小鼠胚胎间充质干细胞C3H/10T1/2(简称10T1/2细胞)基因捕获阳性克隆库[10],并分离获得一个新基因mgt-16[11]。本实验旨在构建小鼠新基因mgt-16的反转录病毒载体, 并观察其在10T1/2细胞中的表达,为进一步研究新基因mgt-16在间充质干细胞中的功能奠定基础。
1 材料和方法
1.1 材料
大肠杆菌E.coli.DH5α、质粒pEGFP-N1、含小鼠新基因(mgt-16)的DNA序列由本实验室保存。反转录病毒载体pLEGFP-N1由第三军医大学解剖教研室惠赠。反转录病毒包装细胞Phoenix由第三军医大学生化教研室惠赠。小鼠间充质干细胞株C3H/10T1/2购自ATCC细胞库。DMEM高糖培养基购自HyClone公司,胎牛血清(FBS)购自Gibco公司,胰酶购自Amersco公司。质粒提取试剂盒、胶回收试剂盒购自Omega公司。限制性内切酶BglⅡ、PstⅠ、NotⅠ、Sal Ⅰ以及T4连接酶购自New England公司。Taq聚合酶、DNA Marker、高保真PrimeSTAR HS DNA 多聚酶购自TaKaRa公司。G418购自Calbiochem公司。Lipofectamine 2000 购自Invitrogen 公司。聚凝胺(polybrene)购自Chemicon公司。PCR引物及基因测序均由上海Invitrogen公司完成。 氨苄青霉素(Amp)、卡那霉素(Kan)购自华北制药集团有限责任公司。二甲亚砜(DMSO)购自成都科龙化工厂。 1.2 PCR法获取目的基因片段
以本实验室保存的小鼠新基因(mgt-16)的DNA序列为模板,使用primer premier 5.0设计含BglⅡ酶切位点的上游引物 5′-GAA GAT CTG TCA TGG CCT CCG TCA AC-3′及含PstⅠ酶切位点的下游引物 5′-AAC TGC AGC CCC AGT AAA ATC TCA TCT G-3′,使用高保真PrimeSTAR HS DNA 多聚酶进行PCR扩增 ,1%琼脂糖凝胶电泳分析PCR扩增结果。 1.3 T-A克隆及PCR法鉴定
取含mgt-16基因编码序列的PCR产物20 μL加入0.1 μL普通Taq酶混匀,PCR仪上72℃延伸10 min,4℃维持10 min 进行PCR产物末端加A反应后取1 μL T-A克隆。反应体系如下: pMD18T vector 1 μL,加A PCR产物1 μL,SolutionⅠ5 μL,Milli-Q H2O 3 μL,共10 μL。16℃ 恒温仪连接1 h后,进行转化、涂100 μg/mL Amp+ LB平板培养过夜。挑取5个LB平板上分隔良好的单克隆菌落,于100 μg/mL Amp+ LB培养液,37℃ 950 r/min过夜摇菌,取菌液各1 μL为模板进行PCR反应。1%琼脂糖凝胶电泳分析PCR扩增结果。选择3个可疑阳性克隆菌株,委托上海Invitrogen公司进行测序。 1.4 pEGFP-N1-16载体的构建及鉴定
将含pEGFP-N1或测序正确的菌落(命名为pMD18T-16),37℃过夜摇菌,按试剂盒说明书提取质粒。pMD18T-16和pEGFP-N1质粒均用BglⅡ 和PstⅠ双酶切10管 。酶切产物经1%琼脂糖凝胶电泳,按胶回收试剂盒说明书切胶回收。根据载体与目的片段摩尔数比为1(3~10)的原则进行连接反应。取3管DH5α感受态菌液各50 μL,第1管加入连接反应产物,第2管加入载体DNA作为阳性对照,第3管不加外源DNA作为阴性对照。将DNA与感受态菌液混匀进行电击转化。然后立即加入1 mL LB培养液混匀并移入EP管内,37℃,950 r/min,培养1 h。各管离心,10 000×g 1 min。吸弃约900 μL上清后混匀沉淀,各取100 μL涂布50 μg/mL Kan+ LB平板,37℃孵箱培养16 h。挑取转化平板上阳性菌落接种50 μg/mL Kan+ LB培养液中,37℃,950 r/min,培养16 h。提取质粒DNA、进行菌液PCR鉴定。同时,对PCR鉴定初步筛选为阳性重组子的pEGFP-N1-16质粒进行BglⅡ 和NotⅠ双酶切鉴定。将鉴定获得的可疑阳性克隆菌株送上海Invitrogen公司进行测序。 1.5 pLEGFP-N1-16载体的构建及酶切鉴定
将反转录病毒载体pLEGFP-N1用BglⅡ 和NotⅠ双酶切,酶切产物经1%琼脂糖凝胶电泳。将经测序正确连接的pEGFP-N1-16、酶切鉴定正确的pLEGFP-N1转化的菌液,37℃,950 r/min振荡过夜,提取质粒、用BglⅡ 和NotⅠ双酶切、切胶回收、连接及转化,挑取转化平板上阳性菌落,接种100 μg/mL Amp+ LB培养液中,37℃,950 r/min,培养过夜。重组质粒pLEGFP-N1-16以BglⅡ 和Sal Ⅰ双酶切鉴定。将获得的可疑阳性克隆菌株送上海Invitrogen公司进行测序。 1.6 反转录病毒的包装及滴度测定
取生长状态良好的Phoenix培养于DMEM高糖培养液(含10%FBS),以9×105/孔接种于6孔板2孔,置37℃、5% CO2培养箱培养18~24 h;待细胞贴壁生长达80%融合时,以Lipofectamine 2000转染pLEGFP-N1、pLEGFP-N1-16各1孔, 24 h后荧光显微镜下观察绿色荧光。72 h后收集病毒上清,1 500 r/min离心3 min,取上清-70℃保存。10T1/2细胞的培养参考文献[12]。取生长状态良好的10T1/2细胞以1×104/孔接种于24孔板,细胞贴壁后加入含终浓度8 μg/mL polybrene的病毒上清125 μL感染10T1/2,24 h后用新鲜培养液取代感染培养液,继续培养48 h后荧光显微镜下观察结果。 1.7 10T1/2细胞的感染及mgt-16基因的分布
取生长状态良好的10T1/2细胞以3×104/孔接种于24孔板, 细胞贴壁后加入1 000 μL/孔病毒上清感染10T1/2细胞,并加入polybrene至终浓度为8 μg/mL,24 h后用新鲜培养液取代感染培养液,继续培养48 h后加入400 μg/mL G418筛选并扩大培养。荧光显微镜下观察结果。 2 结 果 2.1 目的基因mgt-16 PCR扩增产物电泳结果
以含mgt-16基因的DNA序列为模板,用高保真Taq聚合酶进行PCR扩增,产物琼脂糖凝胶电泳后出现约300 bp条带,片段大小与预期值一致,表明目的基因克隆成功。 2.2 pEGFP-N1-16载体的构建及鉴定
将含mgt-16基因编码序列的PCR产物T-A克隆后取5个菌落菌液PCR鉴定获得4个阳性菌落。将测序正确的pMD18T-16菌落与pEGFP-N1质粒均用BglⅡ 和PstⅠ双酶切后电泳,pMD18T-16出现大小为2 702 bp和291 bp条带,pEGFP-N1出现大小为4 704 bp和29 bp条带。胶回收pEGFP-N1酶切后的 4 704 bp片段为骨架,pMD18T-16酶切后的 291 bp片段为目的片段,用T4连接酶连接,转化,摇菌后取5个菌落菌液PCR电泳,均出现约300 bp目的条带,对PCR鉴定初步筛选为阳性重组子的pEGFP-N1-16质粒用BglⅡ和NotⅠ双酶切后琼脂糖凝胶电泳,出现了3 941 bp和1 055 bp两条目的条带,再次证实pEGFP-N1-16重组子构建成功。 2.3 pLEGFP-N1-16载体的构建及鉴定
反转录病毒载体pLEGFP-N1用BglⅡ和NotⅠ双酶切后琼脂糖凝胶电泳,出现了6 099 bp和792 bp两条带,与预期结果一致(图 1A)。胶回收pLEGFP-N1双酶切后的6 099 bp片段,以此为基础骨架,将pEGFP-N1-16载体BglⅡ和NotⅠ双酶切,胶回收含mgt-16与增强型绿色荧光蛋白(EGFP)片段的条带,以含mgt-16与EGFP的条带为外源片段亚克隆至pLEGFP-N1载体,构建重组质粒pLEGFP-N1-16,以BglⅡ和Sal Ⅰ双酶切鉴定、琼脂糖凝胶电泳,出现了6 861 bp和293 bp两条带,与预期结果一致(图 1B)。经测序验证pLEGFP-N1-16构建成功。
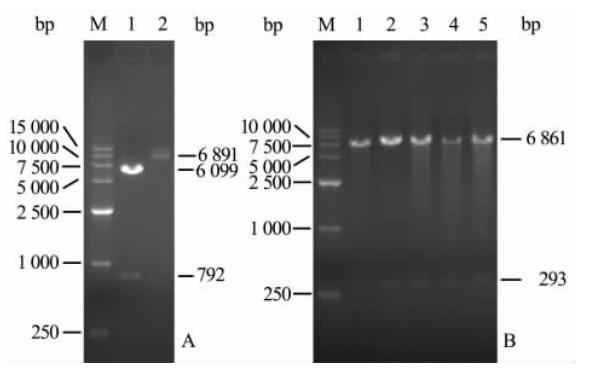 | 图 1 pLEGFP-N1和pLEGFP-N1-16双酶切鉴定结果 M: DNA标记物; A: 1为pLEGFP-N1双酶切产物; 2为pLEGFP-N1; B: 1-5为pLEGFP-N1-16双酶切产物 |
将对照组pLEGFP-N1和构建的 mgt-16融合EGFP的重组载体pLEGFP-N1-16转染包装细胞Phoenix 24 h,荧光显微镜下观察,可见对照组pLEGFP-N1转染的Phoenix细胞绿色荧光呈泛细胞表达(图 2A),而pLEGFP-N1-16转染的Phoenix细胞绿色荧光明显呈胞质表达,局部有聚集现象(图 2B)。加入含终浓度8 μg/mL polybrene 125 μL病毒上清感染10T1/2,24 h后换成新鲜培养液,继续培养48 h后观察细胞的荧光效率,以此判断病毒的滴度为2.98×104 CFU/mL。收集病毒上清感染10T1/2细胞, 400 μg/mL G418筛选14 d建立了稳定表达克隆,对照组pLEGFP-N1感染的10T1/2细胞绿色荧光还是呈泛细胞表达(图 2C),而重组载体pLEGFP-N1-16感染的10T1/2细胞绿色荧光还是呈胞质表达,核周表达水平较高(图 2D)。
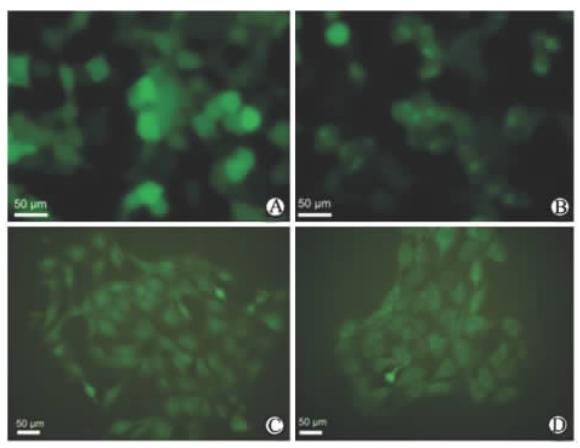 | 图 2 荧光显微镜检测mgt-16在包装细胞Phoenix和间充质干细胞10T1/2中的表达 A,B: pLEGFP-N1和过表达mgt-16 pLEGFP-N1-16转染的Phoenix; C,D: pLEGFP-N1和过表达mgt-16 pLEGFP-N1-16感染的10T1/2细胞 |
研究基因功能常见的策略是基因过表达,基本过程是通过载体将目的基因转入某一特定细胞使其
过表达,观察过表达该基因后细胞生物学行为的变化,从而了解该基因的功能[1, 13]。
目前常用的方法有病毒法和非病毒法两种。非病毒法操作简便,但转染效率和整合效率较低而难以达到预期效果;病毒法利用病毒RNA能整合到宿主细胞基因组的特性,通过辅助系统将目的基因传递到受体细胞[14]。本研究所用载体pLEGFP-N1为反转录病毒载体,可以高效地将外源基因整合入分裂期靶细胞的基因组中,从而长期、稳定地表达外源基因。研究表明,利用pLEGFP-N1反转录病毒载体转染包装细胞,提取病毒上清,感染骨髓间充质干细胞,可获得稳定表达绿色荧光蛋白(green fluorescent protein, GFP)的间充质干细胞,且其生物学特性无明显改变[15]。
本研究通过高保真PCR、T-A克隆、PCR鉴定及测序分析获得了mgt-16编码序列,构建了mgt-16融合EGFP的pEGFP-N1-16真核表达载体,但此载体转染细胞存在表达目的基因时间短的缺点,因此,通过BglⅡ和NotⅠ双酶切后将含mgt-16与EGFP的片段克隆至反转录病毒载体pLEGFP-N1上,构建了重组反转录病毒载体pLEGFP-N1-16,经酶切鉴定和测序分析,说明重组的反转录病毒载体pLEGFP-N1-16构建成功。此外,除获得只能短暂表达但无需病毒包装的pEGFP-N1-16真核表达质粒及可稳定表达但需病毒包装的pLEGFP-N1-16反转录病毒载体外,我们还将pLEGFP-N1和pIRES2-EGFP两种质粒酶切构建了带内核糖体插入序列(internal ribosome entry site, IRES)的pL-IRES-EGFP-N1及pL-IRES-EGFP-16反转录病毒载体(另文报道),为方便同时构建pLEGFP-N1-16、pL-IRES-EGFP-N1及pL-IRES-EGFP-16反转录病毒载体,也需要先构建pEGFP-N1-16真核表达质粒。用pLEGFP-N1及构建的pLEGFP-N1-16反转录病毒载体转染包装细胞Phoenix 24 h后,荧光显微镜下可见对照组Phoenix细胞绿色荧光呈泛细胞表达,而重组载体pLEGFP-N1-16转染的Phoenix细胞绿色荧光明显呈胞质表达,且在局部有聚集。收集病毒上清感染10T1/2细胞,400 μg/mL G418筛选14 d建立了稳定表达克隆,对照组pLEGFP-N1感染的10T1/2细胞绿色荧光仍呈泛细胞表达,而mgt-16融合EGFP的重组载体pLEGFP-N1-16感染的10T1/2细胞绿色荧光也依旧呈胞质表达。由于在反转录病毒载体pLEGFP-N1-16中,EGFP和mgt-16的编码区是在一个表达框里,表达的是EGFP-MGT-16融合蛋白,而MGT-16蛋白的表达水平可以通过荧光强弱直观观察到,并且MGT-16蛋白在细胞内的分布定位可以通过EGFP融合蛋白的定位来指示。本研究通过荧光显微镜观察发现新基因mgt-16为胞质表达基因,MGT-16蛋白在核周分布较高。
综上所述,重组的反转录病毒载体pLEGFP-N1-16成功构建,并在小鼠间充质干细胞表达,这为进一步研究新基因mgt-16对间充质干细胞增殖、迁移、分化等生物学特性的影响及下一步开展体内研究奠定了实验基础。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | 字友梅, 王少元.新基因功能的研究策略[J].医学综述, 2011, 17:1478-1481. |
| [2] | Fedorov L M.[Discovery of genes active in embryogenesis by gene trapping][J].Ontogenez, 2004, 35:307-313. |
| [3] | Stanford W L, Cohn J B, Cordes S P.Gene-trap mutagenesis:past, present and beyond[J].Nat Rev Genet, 2001, 2:756-768. |
| [4] | 黄小乐.面向后基因组研究的基因陷阱技术[J].中山大学研究生学刊:自然科学与医学版, 2003, 24:6-15. |
| [5] | Yoo S, Kim Y, Lee H, Park S, Park S.A gene trap knockout of the Tiam-1 protein results in malformation of the early embryonic brain[J].Mol Cells, 2012, 34:103-108. |
| [6] | Springer P S.Gene traps:tools for plant development and genomics[J].Plant Cell, 2000, 12:1007-1020. |
| [7] | Cecconi F, Meyer B I.Gene trap:a way to identify novel genes and unravel their biological function[J].FEBS Lett, 2000, 480:63-71. |
| [8] | Dauffy J, Mouchiroud G, Bourette R P.The interferon-inducible gene, Ifi204, is transcriptionally activated in response to M-CSF, and its expression favors macrophage differentiation in myeloid progenitor cells[J].J Leukoc Biol, 2006, 79:173-183. |
| [9] | Yamamura K, Araki K.Gene trap mutagenesis in mice:new perspectives and tools in cancer research[J].Cancer Sci, 2008, 99:1-6. |
| [10] | 王明科, 邹仲敏, 罗成基, 粟永萍.多用途基因捕获C3H/10T1/2细胞阳性克隆库的构建及鉴定[J].第四军医大学学报, 2008, 29:508-512. |
| [11] | 王明科, 姜 帆, 孙慧勤, 叶 枫, 程 晋, 粟永萍, 等.基因捕获筛选TGF-β1诱导间充质干细胞C3H/10T1/2平滑肌分化的差异表达基因[J].第三军医大学学报, 2014, 36:92-97. |
| [12] | 王明科, 邹仲敏, 粟永萍, 罗成基, 王军平, 冉新泽, 等.小鼠胚胎间充质干细胞系C3H/10T1/2的多向分化潜能研究[J].第三军医大学学报, 2008, 30:2029-2033. |
| [13] | Prelich G.Gene overexpression:uses, mechanisms, and interpretation[J].Genetics, 2012, 190:841-854. |
| [14] | 梁 洋, 杜文敬, 苏 畅, 安铁洙.逆转录病毒载体的研究进展[J].黑龙江畜牧兽医, 2010, 9:26-28. |
| [15] | 洪小伟, 曾以周, 宋晓萌.逆转录病毒介导EGFP基因转染骨髓间充质干细胞及对其生物学特性的影响[J].口腔生物医学, 2010, 1:29-33. |
 2014, Vol. 35
2014, Vol. 35


