人类婆罗双树样基因4(SALL4)是新发现的一种原癌基因,近年研究发现,SALL4与许多恶性肿瘤的发生有关,如造血系统恶性肿瘤[1]、生殖细胞肿瘤[2]、恶性横纹肌肉瘤[3]、乳腺癌[4]中,均存在SALL4基因的高表达。但SALL4在食管鳞癌中的表达情况尚未见相关报道。有研究表明Bmi-1是 SALL4作用的靶基因之一[5],而Bmi-1在胃癌[6,7]、肝癌[8]、胰腺癌[9]等多种消化系统肿瘤中高表达。另外SALL4转录还可有效激活经典的Wnt信号转导通路[10],而β-catenin作为该通路的关键成员,已发现其在结直肠癌[11]、胃癌[12]、肝癌[13]、子宫内膜癌[14]中异常表达。本研究通过检测 SALL4、Bmi-1和β-catenin蛋白在食管鳞癌中的表达,旨在探讨三者与食管鳞癌的发生、发展及预后的关系,为食管鳞癌的防治提供理论依据。
1 材料和方法 1.1 病例资料2010年7月至2012年9月在本院接受手术的123例食管鳞癌患者进入本研究。123例患者中,男性79例,女性44例;年龄38~78岁,中位年龄57岁;病变长度≤5 cm 者71例,>5 cm者52例。所有入选病例术前均未经过化疗或放疗等抗肿瘤治疗。病理类型: 高分化鳞癌11例,中分化鳞癌69例,低分化鳞癌43例;临床分期: 依据2009年国际抗癌联盟(UICC) TNM分期标准,Ⅰ期6例,ⅡA期41例,ⅡB期17例,Ⅲ期54例,Ⅳ期5例。留取手术切除癌组织标本,同时留取食管鳞癌标本相应的癌旁黏膜(距离癌灶≤2 cm),从中筛选出具有不同程度异型增生的癌旁黏膜70例(轻度异型增生32例,中度异型增生20例,重度异型增生18例),并选取70例切缘正常黏膜(距离癌灶≥5 cm)作为对照。所有标本均经病理确诊。
1.2 免疫组化染色检测SALL4、Bmi-1和β-catenin的表达所有标本均经10%中性甲醛固定,石蜡包埋,4 μm厚度连续切片,分别进行H-E染色和免疫组化染色。鼠抗人SALL4单克隆抗体(1150)购自美国Abcam公司,鼠抗人Bmi-1单克隆抗体(1100)购自美国 Upstate公司,鼠抗人β-catenin单克隆抗体 (1100)购自美国Santa Cruz生物技术公司。即用型SP免疫组织化学试剂盒和DAB酶底物显色试剂盒均购自北京中杉金桥生物技术有限公司。免疫组化染色按SP试剂盒提供的说明书进行,阳性对照由试剂公司提供,以PBS代替一抗作为阴性对照。
SALL4和Bmi-1蛋白的阳性表达均定位于细胞核。染色结果按阳性细胞着色强度和阳性细胞百分率分别评分。阳性细胞着色强度: 无着色计0分,淡棕色计1分,棕黄色计2分,棕褐色计3分;阳性细胞百分率由两位病理医师采用双盲法判定并取平均值,高倍镜下(×400)随机取4个不同视野,计数细胞总数及核阳性细胞数,按阳性细胞百分率计分:阳性细胞百分率<5%计0分,5%~35%计1分,36%~70%计2分,>70%计3分。结果以阳性细胞着色程度评分和阳性细胞百分率评分两项乘积表示,0~1分为阴性(-),≥2为阳性(+)。β-catenin正常阳性表达定位于细胞膜,每张切片随机选取10个高倍视野,每个视野计数100个细胞,计数阳性细胞百分率。无着色和膜阳性细胞数≤90%为表达降低,>90%为表达正常; >10%细胞出现胞质和(或)核表达定为异位表达。表达降低和异位表达皆归为异常表达[15]。
1.3 统计学处理应用SPSS 16.0统计软件进行数据分析。计数资料采用χ2检验和Fisher确切概率法,关联分析采用Spearman相关分析。检验水准(α)为0.05。
2 结 果 2.1 SALL4蛋白在正常食管黏膜、异型增生黏膜和食管鳞癌中的表达SALL4蛋白免疫组化阳性表达定位于细胞核,呈棕黄色或棕褐色颗粒状(图 1A~1C)。SALL4蛋白在正常食管黏膜、异型增生黏膜和食管鳞癌中的阳性表达率为别为15.7%、54.3%和67.5%,异型增生黏膜组和食管鳞癌组的阳性表达率均明显高于正常食管黏膜组(P<0.01),而异型增生黏膜组和食管鳞癌组的阳性表达率差异无统计学意义(P>0.05,表 1)。异型增生黏膜组中,轻度、中度、重度增生SALL4蛋白阳性表达率分别为46.9%、60.0%和61.1%,差异无统计学意义(表 2)。
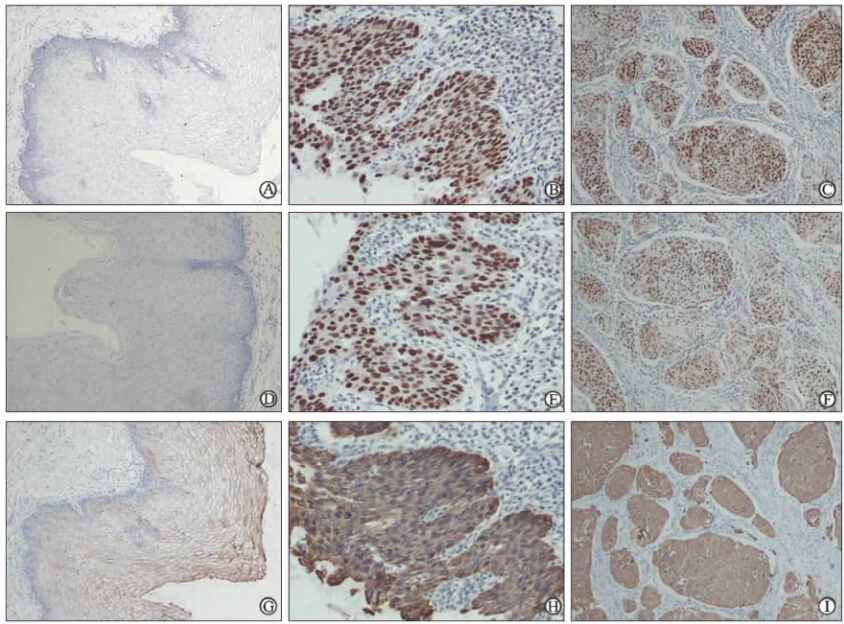 | 图 1 正常食管黏膜、癌旁黏膜伴重度异型增生及食管鳞癌组织中SALL4、Bim-1和β-catenin蛋白的表达 (SP法)Fig 1 SALL4,Bmi-1 and β-catenin expression in normal esophageal mucosa,dysplasia mucosa and ESCC tissues (SP)ESCC: Esophageal squamous cell carcinoma. A: SALL4 in normal esophageal mucosa; B: SALL4 in dysplasia mucosa; C: SALL4 in ESCC; D: Bmi-1 in normal esophageal mucosa; E: Bmi-1 in dysplasia mucosa; F: Bmi-1 in ESCC; G: β-catenin in normal esophageal mucosa; H: β-catenin in dysplasia mucosa; I: β-catenin in ESCC. Original magnification: ×200 |
| 表 1 70例正常食管黏膜、70例异型增生黏膜和123例食管鳞癌中SALL4、Bmi-1和β-catenin蛋白的表达Tab 1 Expression of SALL4,Bmi-1 and β-catenin protein in 70 normal esophageal mucosa,70 dysplasia mucosa and 123 ESCC specimens |
| 表 2 不同程度异型增生黏膜组织中SALL4、Bmi-1和β-catenin蛋白的不同表达Tab 2 Different expressions of SALL4,Bmi-1 and β-catenin protein in dysplasia mucosa tissues of different degrees |
Bmi-1蛋白免疫组化阳性表达定位于细胞核,呈棕黄色或棕褐色颗粒状(图 1D~1F),也有少量为胞质内呈现棕黄色。Bmi-1蛋白在正常食管黏膜、异型增生黏膜和食管鳞癌中的阳性表达率为别为21.4%、37.1%和63.4%,异型增生黏膜组和食管鳞癌组的阳性表达率均明显高于正常食管黏膜组(P<0.01),且食管鳞癌组阳性表达率高于异型增生黏膜组(P<0.01,表 1)。异型增生黏膜轻度、中度、重度组Bmi-1蛋白阳性表达率分别为21.9%、30.0%和72.2%,其阳性表达率随异型增生程度的增高而增高(P<0.01,表 2)。
2.3 β-catenin蛋白在正常食管黏膜、异型增生黏膜和食管鳞癌中的表达β-catenin蛋白在正常食管黏膜阳性表达位于细胞膜(图 1G),若细胞核或细胞质出现棕黄色着色则视为β-catenin异常表达。而在食管鳞癌中β-catenin异常表达主要定位于细胞质,呈棕黄色颗粒状(图 1I),也有少数胞核内着色,β-catenin蛋白在正常食管黏膜、异型增生黏膜和食管鳞癌中的异常表达率分别为7.1%、27.1%和57.7%,异型增生黏膜组和食管鳞癌组的异常表达率均明显高于正常食管黏膜组(P<0.01),且食管鳞癌组异常表达率高于异型增生黏膜组(P<0.01,表 1)。异型增生黏膜轻度、中度、重度组β-catenin蛋白异常表达率分别为18.7%、30.0%和38.9%,组间差异无统计学意义(表 2)。
2.4 SALL4、Bmi-1和β-catenin蛋白表达的相互关系从正常食管黏膜、异型增生黏膜至食管鳞癌组织,SALL4和Bmi-1蛋白共同阳性表达率分别为14.3%(10/70)、34.3%(24/70)和63.4%(78/123),食管鳞癌组明显高于异型增生黏膜组和正常食管黏膜组(均P<0.05);SALL4和β-catenin蛋白共同阳性(异常)表达率分别为7.1%(5/70)、25.7%(18/70)和52.8%(65/123),食管鳞癌组明显高于异型增生黏膜组和正常食管黏膜组(均P<0.05);Bmi-1和β-catenin蛋白共同阳性(异常)表达率分别为5.7%(4/70)、22.8%(16/70)和56.9%(70/123),逐渐递增,组间差异有统计学意义(P<0.05)。123例食管鳞癌组织中,SALL4、Bmi-1和 β-catenin蛋白表达两两正相关(SALL4和Bmi-1: r=0.373,P<0.01; SALL4和β-catenin: r=0.214,P<0.05;Bmi-1和β-catenin:r=0.204,P<0.05)。
2.5 SALL4、Bmi-1和β-catenin蛋白在食管鳞癌中的表达与临床病理特征的关系食管鳞癌的各临床病理因素与SALL4、Bmi-1和β-catenin蛋白表达的关系如表 3所示,Crosstabs分析及χ2检验分析得出: 食管鳞癌组织中SALL4蛋白的表达与临床分期(P<0.05)、淋巴结转移(P<0.01)有关,而与患者性别、年龄、肿瘤大小、分化程度、浸润深度和远处转移等因素均无关(均P>0.05);Bmi-1和β-catenin蛋白的表达均与浸润深度、分化程度、淋巴结转移相关(均P<0.05),而与患者性别、年龄、肿瘤大小、临床分期、远处转移均无关(均P>0.05)。
| 表 3 SALL4、Bmi-1和β-catenin蛋白的表达与食管鳞癌患者临床病理特征的关系Tab 3 Correlation of SALL4,Bmi-1 and β-catenin expression with clinicopathological characteristics of ESCC patients n |
SALL与参与果蝇多种器官发育的果蝇婆罗双树基因Spalt为同源基因[16]。 SALL家族共4个成员,即SALL1~SALL4,SALL4位于人类20号染色体长臂13区[17]。 SALL4是一种新发现的原癌基因,对维持胚胎干细胞的多能性和自我更新具有重要作用。本研究中,我们观察了SALL4在蛋白水平的表达情况,发现从正常食管黏膜、异型增生黏膜到食管鳞癌组织,SALL4蛋白的阳性表达率明显增高,这与Kobayashi等[4]在乳腺癌中得出的结论基本一致,异型增生黏膜组和食管鳞癌组的阳性表达率均明显高于正常食管黏膜组,且 SALL4蛋白的表达与临床分期、淋巴结转移有关,提示SALL4可能参与了食管鳞癌的发生和发展,对食管鳞癌的预后评估有一定的参考价值。
Bmi-1基因是PcG(Polycomb group,PcG)家族核心成员之一,属于一种原癌基因。人类Bmi-1基因定位于10号染色体短臂13区,其cDNA长3 202 bp,开放的阅读框编码一个含326个氨基酸的蛋白质,该蛋白质含有一个位于N末端的环指结构域(ring finger domain,RF)和位于中心保守DNA结合模序螺旋-转角-螺旋-转角(DNA banding helix-turn-helix-turn motif,HTHT)结构域[18],正是这两个区域对细胞转化和肿瘤形成具有重要作用[19]。Tateishi等[6]研究发现Bmi-l在胃癌中高表达,并首次提出高表达的Bmi-1与胃癌临床病理特征有一定相关性。本研究结果显示,在异型增生黏膜组,随异型增生程度的加重,Bmi-1的阳性表达率逐渐增高。异型增生黏膜组和食管鳞癌组Bmi-1的阳性表达率均明显高于正常食管黏膜组,表明在食管的癌变过程中,Bmi-1的阳性表达率呈升高趋势,提示Bmi-1高表达在食管的癌变过程中起一定作用。黄开红等[7]研究发现Bmi-1过表达与肿瘤大小、临床分期、浸润深度、淋巴结转移有关,此结果反映了肿瘤局部生长、浸润及淋巴转移的能力,即 Bmi-1过度表达的恶性肿瘤具有更强的侵袭、转移能力。本研究亦显示,食管鳞癌组织中Bmi-1阳性表达率与肿瘤的浸润深度、分化程度、淋巴结转移相关,提示Bmi-1可能在食管鳞癌发展、浸润转移过程中起重要作用。
Wnt信号通路是调控细胞生长增殖的重要途径之一,其异常激活与肿瘤的发生和发展有密切关系。β-catenin是一个多功能蛋白,除作为该信号通路中的关键成员参与调节该通路外,还与钙黏蛋白(E-cadherin)结合介导同型细胞间相互黏附。正常细胞中,大部分β-catenin通过与E-cadherin的胞质区连接而定位于细胞膜,少量游离的β-catenin被APC/GSK-3β/Axin复合物磷酸化而降解,使其在胞质中的含量保持在较低水平。正如本实验所示:正常食管黏膜中,β-catenin主要表达在细胞膜,胞质不表达或弱表达。但当 Wnt通路异常激活时,β-catenin的降解受抑制,使其在胞质中异常蓄积,进而转位入胞核与DNA亲和蛋白TCF/LEF(T cell factor/lymphoid enhancer factor)结合,激活Wnt通路的靶基因,导致细胞的增殖,参与肿瘤的形成。本研究显示: 异型增生黏膜组和食管鳞癌组β-catenin的阳性表达率均明显高于正常食管黏膜组,食管鳞癌组阳性表达率高于异型增生黏膜组,β-catenin蛋白的表达与浸润深度、分化程度、淋巴结转移相关,提示β-catenin的异常表达参与了食管鳞癌的发生,其在胞质的异常蓄积很可能与食管鳞癌进展晚期的淋巴结转移有关。这与杨勇等[11]通过蛋白质印迹分析得出“β-catenin在结肠癌组织中均高表达,明显高于癌旁正常组织,且在有淋巴结转移组的表达明显高于无淋巴结转移组”的结论基本一致,而本研究发现 β-catenin蛋白与临床分期无关,这又与杨勇等[11]得出的“β-catenin蛋白在结肠癌Dukes C+D期中的表达明显高于A+B期”不同, 说明β-catenin在不同肿瘤中的表达情况可能有差异,也有可能跟标本量、试验方法不同有关。
Yang等[5]研究发现SALL4能与Bmi-1基因的启动子结合启动转录,影响内源性Bmi-1基因的表达水平,且该反应存在剂量依赖性,并且认为Bmi-1是SALL4的直接靶基因之一。随后张卫平等[20]发现SALL4/Bmi-1基因在骨髓瘤中呈高表达,且杨华强等[21]也发现SALL4和Bmi-1在弥漫大B细胞淋巴瘤中高表达且呈正相关,这与本研究结果基本一致,同时也印证了Yang等[5]的观点。另外SALL4转录可有效激活经典的Wnt信号转导通路[10],进而影响其靶基因c-myc、cyclinD1的表达,导致肿瘤的发生。本研究结果显示,从正常食管黏膜、异型增生黏膜至食管鳞癌组织,SALL4、Bmi-1的阳性表达率和β-catenin的异常表达率均逐渐升高;在食管鳞癌中,三者两两正相关,均与淋巴结转移有关,提示三者可能参与了食管鳞癌的发生发展,并在浸润转移过程中起一定作用,可作为判断食管鳞癌预后的有效指标。由此我们推测在食管鳞癌中SALL4作为枢纽,影响Bmi-1和β-catenin的表达,而Bmi-1和β-catenin之间是否存在直接关系以及三者在基因水平的表达有待进一步深入研究。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | 林 江, 纪润璧, 钱 军.转录因子婆罗双树样基因4(SALL4)研究进展[J].中国实验血液学杂志, 2011, 19: 820-823. |
| [2] | Bai S, Wei S, Ziober A, Yao Y, Bing Z.SALL4 and SF-1 are sensitive and specific markers for distinguishing granulosa cell tumors from yolk sac tumors[J].Int J Surg Pathol, 2013, 21:121-125. |
| [3] | Deisch J, Raisanen J, Rakheja D.Immunohistochemical expression of embryonic stem cell markers in malignant rhabdoid tumors[J].Pediatr Dev Pathol, 2011, 14:353-359. |
| [4] | Kobayashi D, Kuribayshi K, Tanaka M, Watanabe N.SALL4 is essential for cancer cell proliferation and is overexpressed at early clinical steges in breast cancer[J].Int J Oncol, 2011, 38:933-939. |
| [5] | Yang J, Chai L, Liu F, Fink L M, Lin P, Silberstein L E, et al.Bmi-1 is a target gene for SALL4 in hematopoietic and leukemic cells[J].Proc Natl Acad Sci USA, 2007, 104:10494-10499. |
| [6] | Tateishi K, Ohta M, Kanai F, Guleng B, Tanaka Y, Asaoka Y, et al.Dysregulated expression of stem cell factor Bmi1 in precancerous lesions of the gastrointestinal tract[J].Clin Cancer Res, 2006, 12:6960-6966. |
| [7] | 黄开红, 刘建化, 李学先, 宋立兵, 曾木圣, 郭宝红.Bmi-1在胃癌中的表达及其意义[J].中华消化杂志, 2007, 27:525-528. |
| [8] | 党 政, 宋文杰, 胡小军, 窦科峰.Bmi1在肝癌组织中的表达及其与细胞增殖和凋亡的关系[J].现代生物医学进展, 2011, 11:1484-1488. |
| [9] | Song W, Tao K, Li H, Jin C, Song Z, Li J, et al.Bmi-1 is related to proliferation, survival and poor prognosis in pancreatic cancer[J].Cancer Sci, 2010, 101:1754-1760. |
| [10] | BLöhm J, Sustmann C, Wilhelm C, Kohlhase J.SALL4 is directively actived by TCF/LEF in the canonical Wnt signaling pathway[J].Biochem Biophys Res Commun, 2006, 348:898-907. |
| [11] | 杨 勇, 朱明才, 段 亮, 周 兰.结肠癌中S100A2的表达及其与Wnt/β-catenin通路的相关性[J].第三军医大学学报, 2012, 34:1576-1579. |
| [12] | Cong N, Du P, Zhang A, Shen F, Su J, Pu P, et al.Downregulated microRNA-200a promotes EMT and tumor growth through the wnt/β-catenin pathway by targeting the E-cadherin repressors ZEB1/ZEB2 in gastric adenocarcinoma[J].Oncol Rep, 2013, 29:1579-1587. |
| [13] | Evason K J, Grenert J P, Ferrell L D, Kakar S.A typical hepatocellular adenoma-like neoplasms with β-catenin activation show cytogenetic alterations similar to well-differentiated hepatocellular carcinomas[J].Hum Pathol, 2013, 44:750-758. |
| [14] | van der Zee M, Jia Y, Wang Y, Heijmans-Antonissen C, Ewing P C, Franken P, et al.Alterations in Wnt-β-catenin and Pten signalling play distinct roles in endometrial cancer initiation and progression[J].J Pathol, 2013, 230:48-58. |
| [15] | Pirinen R T, Hirvikoski P, Johansson R T, Hollmén S, Kosma V M.Reduced expression of alpha-catenin, beta-catenin, and gamma-catenin is associated with high cell proliferative activity and poor differentiation in non-small cell lung cancer[J].J Clin Pathol, 2001, 54:391-395. |
| [16] | de Celis J F, Barrio R.Regulation and function of Splat proteins during animal development[J].Int J Dev Biol, 2009, 53(8-10):1385-1398. |
| [17] | Kohlhase J, Schubert L, Liebers M, Rauch A, Becker K, Mohammed S N, et al.Mutations at the SALL4 locus on chromosome 20 result in a range of clinically overlapping phenotypes, including Okihiro syndrome, Holt-Oram syndrome, acro-renal-ocular syndrome, and patients previously reported to represent thalidomide embryopathy[J].J Med Genet, 2003, 40:473-478. |
| [18] | 刘卫红, 孟秀香, 刘丹丹, 单路娟, 赵心宇.反义Bmi-1对Jurkat细胞的抑制作用[J].中华血液学杂志, 2005, 26:554-556. |
| [19] | Gould A.Functions of mammalian polycomb group and trithorax group related genes[J].Curr Opin Genet Dev, 1997, 7:488-494. |
| [20] | 张卫平, 姚航平, 童向民.SALL4/BMI-1基因在骨髓瘤的表达及临床意义[J].中国卫生检验杂志, 2011, 21: 290-292. |
| [21] | 杨华强, 张荣环, 宋 斌, 张 巍, 张 萍.SALL4和BMI-1在弥漫大B细胞淋巴瘤中的表达及临床意义[J].四川医学, 2010, 31:288-291. |
 2014, Vol. 35
2014, Vol. 35


