2. 上海交通大学医学院附属新华医院妇产科, 上海 200092;
3. 环境与儿童健康教育部和上海市重点实验室, 上海 200092
2. Department of Obstetrics and Gynecology, Xinhua Hospital, Shanghai Jiaotong University School of Medicine, Shanghai 200092, China;
3. MOE-Shanghai Key Laboratory of Children's Environmental Health, Shanghai 200092, China
重金属汞作为一种对人体和高等生物具有很强毒性的污染物,可以甲基汞形式通过食物摄入人体[ 1 ]。研究表明,甲基汞污染与异常妊娠的发生有关[ 2 ],脐血和胎粪中汞含量高于母血中的含量[ 3 ],提示孕妇摄入的少量汞可以通过胎盘进入胎儿体内,对胎儿的生长发育造成损害。因此,妊娠期保健中注意对孕妇进行汞污染的防护具有积极的优生学意义。近年来,锌元素对汞毒性的拮抗作用受到关注[ 4,5,6 ],其机制涉及抗氧化应激及调控细胞增殖/凋亡相关蛋白的表达[ 4,5 ]。目前关于孕期补锌与拮抗汞毒性关系的研究多为动物实验[ 5,6 ],为此,本研究尝试在临床上对高汞暴露的孕妇进行锌制剂补充,观察孕期补锌对母儿汞毒性的拮抗作用,并初步探讨其作用机制。
1 资料和方法 1.1 研究对象及分组研究对象为2011年7月1日至2013年8月31日在上海交通大学医学院附属新华医院妇产科分娩的产妇,入选标准: 妊娠孕12周后定期在新华医院产前检查,单胎妊娠,孕16~42周,产式和胎次不做要求,排除妊娠合并疾病。根据产检时血汞水平确定正常和高汞暴露者(Hg≥5.8 μg/L),对高汞暴露者随机分配后进行干预或不干预,直至分娩。共90例一般情况匹配的产妇入选,分为3组,每组30例,其中对照组和病例组分别为妊娠16周产检及分娩时2次血汞均正常和均升高(≥5.8 μg/L)者;治疗组为妊娠16周产检时提示血汞升高(≥5.8 μg/L),随后接受干预治疗,根据药物使用说明,每日饭后服用葡萄糖酸锌口服液(哈药集团三精制药股份有限公司,生产批号:B04001067,每100 mL中含锌35.3 mg),每日3次,每次1支(10 mL),相当于每日摄入锌元素10.6 mg,直至分娩。本研究经医院伦理委员会审核并批准,所有受试者在参加课题研究前均被告知研究的具体内容并签署知情同意书。
1.2 标本采集和制备留取各组孕产妇外周静脉血4 mL,各取2 mL注入抗凝管及非抗凝管,其中非抗凝采血管在560×g的转速下离心15 min,用玻璃移液管吸出上层血清,转移至经过400℃烘烤4 h的玻璃试管中,均置于 -20℃条件下保存。胎盘自然娩出或剖宫产术取出后,以脐带附着处为中心,在胎盘母面脐带周围剪一小块2 cm×2 cm×1 cm的组织,避开钙化、机化或出血灶,冷生理盐水漂洗后去掉血液、水分,剪成4份,立即放入冻存管中,-80℃条件下保存。
1.3 元素汞、锌测定采用DMA-80自动测汞仪(意大利Milestone公司)测定全血中血汞、胎盘汞含量; 采用Agilent 7500 CE电感耦合等离子体质谱分析仪(美国Agilent公司)测定血清中血锌、胎盘锌含量,测定胎盘锌含量前经过微波消解。实验中进行严格的质量控制,所用器皿均以40%硝酸浸泡过夜,用超纯水反复冲洗干净备用。
1.4 原位末端标记法(TUNEL)检测胎盘组织的细胞凋亡情况取胎盘组织固定,石蜡包埋、切片,用蛋白酶 K工作液处理组织15~30 min (21~37℃),滴加50 μL TUNEL反应混合液(细胞凋亡检测试剂盒购自Roche公司,产品货号11684817910),37℃孵育60 min,滴加50 μL 转化剂过氧化物酶(POD),37℃孵育60 min,滴加50~100 μL辣根过氧化物酶(DAB)显色试剂底物,15~25℃孵育10 min; 加1滴磷酸盐缓冲液(PBS)或甘油在视野下,用光学显微镜观察凋亡细胞,凋亡细胞胞核呈棕黄色。每片选上、下、左、右、中5个视野,在显微镜下(×400)观察,每个视野计数100个细胞,计算凋亡细胞比例,并拍照。
1.5 蛋白质印迹法检测胎盘组织Bcl-2、Bax的表达取出适量的组织在液氮中迅速研磨成粉末,将研磨好的粉末转移到含有蛋白酶和磷酸酶抑制剂的裂解液的离心管中,4℃,3 360×g离心15 min,取上清,进行蛋白质定量分析,应用分光光度计测定蛋白浓度。配制聚丙烯酰胺并进行凝胶电泳,电泳条件:浓缩胶 80 V 20 min,分离胶120 V 60 min。根据说明书加入稀释为1 150的Bcl-2、Bax抗体(Bcl-2、Bax多克隆抗体由美国Santa Cruz 公司提供),室温孵育2 h。随后加入12 000稀释的HRP标记的二抗,37℃孵育1 h。配制ECL发光液,显色30~60 s,浸入显影液中1~2 min,再放入定影液中1 min,以GAPDH为内参,观察显影结果。
1.6 统计学处理 使用SPSS 13.0软件对数据进行统计学分析,各组数据(母血汞、锌水平,胎盘Bcl-2、Bax表达水平,凋亡细胞阳性率)经Kolmogorov-Smirnov方法检验符合正态分布,方差齐性检验显示方差齐性后,使用x±s描述连续性变量,采用t检验比较妊娠中、晚期母血汞和血锌水平;采用ANOVA 方差分析比较多组间均数差异,再用Tukey法进行两两比较。 分类变量的单因素分析用χ2检验或Fisher精确检验。检验水准(α)为0.05。 2 结 果 2.1 各组孕妇一般情况比较对照、病例及治疗组孕妇年龄分别为(29.1±2.9)、(28.0±3.8)、(29.0±3.0)岁,身高分别为(161.0±2.4)、(161.0±3.1)、(161.3±2.3) cm,分娩前体质量分别为(72.7±4.9)、(71.8±4.3)、(72.3±4.7) kg,方差分析结果提示差异均无统计学意义(F值分别为0.91、0.09、0.29,P均>0.05)
2.2 各组孕妇妊娠中、晚期母血汞、锌水平比较对照、病例及治疗组孕妇妊娠中、晚期母血汞及锌检测结果见表1,可见妊娠中期病例组、治疗组母血汞水平均高于对照组,同时母血锌水平均低于对照组,差异有统计学意义(P均<0.05),而病例组与治疗组之间母血汞、锌水平差异均无统计学意义(P均>0.05)。至妊娠晚期,治疗组母血汞水平较病例组明显下降,但仍高于对照组; 与此同时,母血锌水平较病例组明显升高,但仍低于对照组(P<0.05)。
| 表 1 各组孕中、晚期母血汞、锌水平比较Tab 1 Levels of maternal blood mercury and zinc at middle and late pregnancy in three groups n=30,x±s,ρB/(μg·L-1) |
结果见表2。治疗组和对照组妊娠结局差异无统计学意义(P>0.05);病例组除胎儿窘迫、羊水过少、出生缺陷、新生儿窒息发生率与对照组差异无统计学意义(P>0.05)外,其早产、胎膜早破、小于胎龄儿的发生率均高于治疗组(P<0.05)和对照组 (P<0.05)。
| 表 2 三组孕妇妊娠结局比较Tab 2 Pregnancy outcomes in three groups N=30,n(%) |
各组孕妇胎盘组织凋亡细胞的TUNEL检测结果见图1,凋亡相关蛋白Bcl-2和Bax蛋白质印迹分析结果见图2。结果表明,病例组胎盘凋亡细胞阳性率高于治疗组和对照组(P<0.05),但治疗组和对照组之间差异无统计学意义(P>0.05)。病例组胎盘组织凋亡抑制蛋白Bcl-2的表达水平低于治疗组和对照组(P<0.05),促凋亡蛋白Bax的表达水平则高于治疗组和对照组(P<0.05); 但Bcl-2及Bax表达水平在治疗组和对照组之间差异均无统计学意义(P>0.05)。
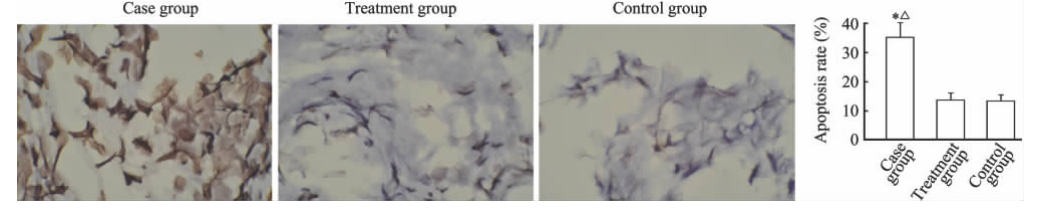 | 图 1 原位末端标记法检测3组胎盘凋亡细胞阳性率Fig 1 Cell apoptosis in placenta of three groups as detected by TUNEL assay Original magnification: ×400.*P<0.05 vs control group; △P<0.05 vs treatment group. n=30,x±s |
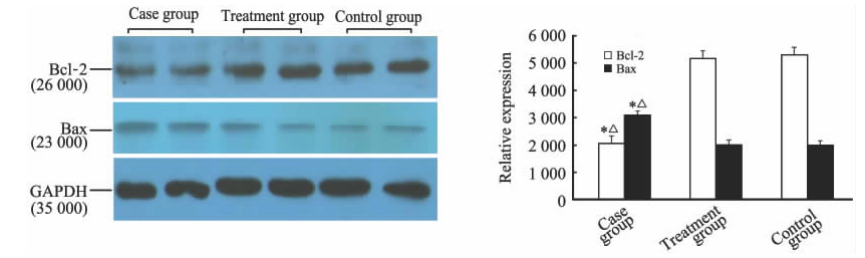 | 图 2 蛋白质印迹法定量分析3组胎盘Bcl-2、Bax表达水平Fig 2 Expression of Bcl-2 and Bax protein in placenta of three groups as detected by Western blotting analysis*P<0.05 vs control group; △P<0.05 vs treatment group. n=30,x±s |
目前环境汞污染日益严重,孕妇和胎儿是最容易受危害的群体[ 7 ]。Kim等[ 8 ]研究发现孕期汞暴露与新生儿体质量呈负相关,本研究结果也表明,高汞暴露(病例组)孕妇不良妊娠结局(早产、胎膜早破、小于胎龄儿)的发生率较对照组升高。因此,如何防治汞的胚胎毒性,对优生优育具有重要指导意义。
本研究发现,高汞暴露孕妇自妊娠中期开始接受每日口服补锌(10.6 mg)干预后(治疗组),至妊娠晚期,其血汞含量较未接受补锌干预者(病例组)明显下降(接近正常组水平),且不良妊娠结局(早产、胎膜早破、小于胎龄儿)的发生率也相应减少,提示孕期补锌可一定程度降低血汞水平及汞对母儿的毒性作用。研究表明,甲基汞可以通过激活ASK1/JNK信号通路引起细胞凋亡[ 9 ]。本研究也同时发现治疗组胎盘组织的细胞凋亡率、促凋亡蛋白Bax的表达均较病例组下降,而凋亡抑制蛋白Bcl-2的表达则较病例组升高,提示锌可能通过调控凋亡相关蛋白Bcl-2/Bax的表达而抑制细胞凋亡,从而拮抗汞对孕妇及胎儿的毒性作用。
锌和汞同属ⅡB族元素,两者化学性质有一定相似性,能互相竞争抑制而相互置换。成人血清锌的正常水平为750~1 200 μg/L,孕期锌内稳态对正常妊娠及胎儿的生长发育极为重要,且孕妇对锌的需求量较正常妇女更多[ 10 ]。世界卫生组织(WHO)推荐的孕妇每日锌供给量标准为20 mg。经调查,我国孕妇孕期膳食锌摄入量平均为6.8~8.0 mg/d,30%的孕妇锌摄入量少于6.5 mg/d[ 11 ],提示我国孕妇缺锌程度较高且普遍。本研究中高汞暴露(病例组)孕妇妊娠中、晚期母血锌值均低于对照组,且不良妊娠结局(早产、胎膜早破、小于胎龄儿)的发生率也高于对照组,提示锌缺乏也可能对母儿产生不良影响。
然而大剂量补锌易引起恶心、呕吐等胃肠不适; 此外,锌、铜、铁等二价元素之间会产生互相的拮抗作用。基于上述原因并结合葡萄糖酸锌口服液的使用说明,本研究给予治疗组孕妇每天补充10.6 mg元素锌。结果表明,治疗组孕妇妊娠晚期母血锌值较妊娠中期明显升高,且接近对照组水平,提示适当剂量锌制剂的补充能显著提高母血锌含量,并与体内汞相互拮抗,从而有效降低母血汞含量。
总之,本研究结果表明适当剂量锌制剂的补充能降低妊娠不良结局(如早产、胎膜早破、小于胎龄儿)的发生率,其机制可能与上调凋亡抑制蛋白Bcl-2的表达并下调促凋亡蛋白Bax的表达相关。但锌的确切保护机制、临床应用的锌的合适剂量和种类等尚需进一步大样本的临床论证。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Clarkson T W, Magos L.The toxicology of mereury and its chemical compounds[J].Crit Rev Toxicol, 2006, 36:609-662. |
| [2] | Itai Y, Fujino T, Ueno K, Motomastu Y.An epidemiological study of the incidence of abnormal pregnancy in areas heavily contaminated with methylmercury[J].Environ Sci, 2004, 11:83-97. |
| [3] | Unuvar E, Ahmodav H, Kiziler A R, Aydemir B, Toprak S, Ulker V, et al.Mercury levels in cord blood and meconium of healthy newborns and venous blood of their mothers:clinical, prospective cohort study[J].Sci Total Environ, 2007, 374:60-70. |
| [4] | Blanco-Alvarez V M, Lopez-Moreno P, Soto-Rodriguez G, Martinez-Fong D, Rubio H, Gonzalez-Barrios J A, et al.Subacute zinc administration and L-NAME caused an increase of NO, zinc, lipoperoxidation, and caspase-3 during a cerebral hypoxia-ischemia process in the rat[J].Oxid Med Cell Longev, 2013, 7:240-250. |
| [5] | Deepmala J, Deepak M, Srivastav S, Sanqeeta S, Kumar S A, Kumar S S.Protective effect of combined therapy with dithiothreitol, zinc and selenium protects acute mercury induced oxidative injury in rats[J].J Trace Elem Med Biol, 2013, 27:249-256. |
| [6] | Franciscato C, Moraes-Silva L, Duarte F A, Oliveira C S, Ineu R P, Flores E M, et al.Delayed biochemical changes induced by mercury intoxication are prevented by zinc pre-exposure[J].Ecotoxicol Environ Saf, 2011, 74:480-486. |
| [7] | Hightower J M, O'Hare A, Hernandez G T.Blood mercury reporting in NHANES:identifying Asian, Pacific Islander, Native American, and multiracial groups[J]. Environ Health Perspect, 2006, 114:173-175. |
| [8] | Kim B M, Lee B E, Hong Y C, Park H, Ha M, Kim Y J, et al.Mercury levels in maternal and cord blood and attained weight through the 24 months of life[J].Sci Total Environ, 2011, 410-411:26-33. |
| [9] | Usuki F, Fujita E, Sasagawa N.Methylmercury activates ASK1/JNK signaling pathways, leading to apoptosis due to both mitochondria-and endoplasmic reticulum(ER)-generated processes in myogenic cell lines[J].Neurotoxicology, 2008, 29:22-30. |
| [10] | Roohani N, Hurrell R, Kelishadi R, Schulin R.Zinc and its importance for human health:an integrative review[J].J Res Med Sci, 2013, 18:144-157. |
| [11] | 中国营养学会妇幼分会.中国孕期哺乳期妇女和0-6岁儿童膳食指南(2007)[M].北京:人民卫生出版社, 2008:89-91. |
 2014, Vol. 35
2014, Vol. 35


