前列腺癌已成为世界男性第二大恶性肿瘤,在我国的发病率仅次于膀胱癌和肾癌,高居泌尿系统恶性肿瘤的第3位,其发病年龄具有年轻化趋势[ 1 ],严重危害着男性的健康。香芹酚(carvacrol)是一种单萜酚,普遍存在于多种天然植物的挥发油中[ 2,3 ]。近年来有研究表明香芹酚能够抑制肺癌细胞[ 4 ]、肝癌细胞[ 5 ]、乳腺癌细胞[ 6 ]、宫颈癌细胞[ 7 ]等肿瘤细胞的增殖并诱导其凋亡,但其作用机制仍未被清晰阐明,迄今为止尚未见其对前列腺癌作用的报道。因此,本研究将香芹酚作用于前列腺癌细胞,观察其对前列腺癌的影响,并从丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路探讨其可能的作用机制,以期为前列腺癌的治疗提供新的思路。
香芹酚(纯度98%)购自Sigma公司;人前列腺癌细胞株DU145购自ATCC;胎牛血清购自HyClone公司;RPMI 1640培养基购自Gibco公司;CCK-8试剂盒购自碧云天生物技术研究所;细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司;Transwell孔板购自Corning公司;基质胶购自BD公司;基质金属蛋白酶9(MMP-9)抗体、细胞外信号调节激酶(ERK)抗体、p-ERK抗体、p38抗体、p-p38抗体均购自Santa Cruz公司; TIMP-1(MMP-9抑制剂)抗体、聚腺苷二磷酸核糖聚合酶(PARP)抗体、半胱天冬氨酸蛋白酶9(caspase-9)抗体购自北京博奥森生物技术有限公司;总RNA提取试剂盒、cDNA 第一链合成试剂盒、2×Taq PCR Master Mix购自北京天根生化科技有限公司,其他药品为国产分析纯。
DU145细胞接种于含10%胎牛血清的RPMI 1640培养液中,置于37℃、5%CO2的细胞培养箱中培养,每2~3 d消化传代一次,选择处于对数生长期的细胞进行实验。实验分为香芹酚组(待细胞贴壁后加入80 μmol/L的香芹酚作用细胞)和阴性对照组(不加香芹酚的细胞)。
调整细胞密度,按照每孔3×104个细胞接种于96孔板,每组5个复孔。结束细胞培养前加入10 μL CCK-8试剂培养4 h,于细胞培养的0、1、2、3、4、5 d收集细胞,测定每孔在450 nm处的光密度值(D值),绘制细胞生长曲线。
调整细胞密度,按照每孔2×105个细胞接种于6孔板,待细胞贴壁后加入浓度为80 μmol/L的香芹酚,分别于24 h和48 h收集细胞,加入预冷的PBS洗涤2次,用195 μL AnnexinⅤ-FITC结合液重悬细胞后加入5 μL Annexin Ⅴ-FITC,轻轻混匀,室温避光孵育10 min。离心收集细胞,用190 μL Annexin Ⅴ-FITC结合液重悬细胞,加入10 μL碘化丙啶染色液,轻轻混匀后冰浴避光孵育10 min,随即上流式细胞仪(美国BD公司)检测。
4℃解冻基质胶,加入细胞培养液20 μL进行稀释并包被于Transwell上室内膜上。用无血清细胞培养液调整DU145细胞密度,按照每孔2×105个细胞接种至上室,同时加入终浓度为80 μmol/L的香芹酚,下室加入含有10%胎牛血清的RPMI 1640培养液,置于细胞培养箱中培养。分别于24 h和48 h后取出上室,于40 mL/L的甲醛中固定15 min,晾干后于苏木精染液中染色3 min,蒸馏水冲洗。倒置显微镜下计数侵袭细胞个数。
用总RNA提取试剂盒提取两组细胞RNA,按照cDNA第一链合成试剂盒说明书反转录成cDNA。MMP-9引物序列: 上游5′-GCT ACG TGA CCT ATG ACA TCC T-3′, 下游5′-TCC TCC AGA ACA GAA TAC CAG T-3′,扩增片段长度144 bp。TIMP-1引物序列: 上游5′-CCT GTT GTT GCT GTG GCT GAT-3′, 下游5′-ATC CCC TAA GGC TTG GAA CC-3′,扩增片段长度199 bp。β-actin引物序列: 上游5′-CTT AGT TGC GTT ACA CCC TTT CTT G-3′, 下游5′-CTG TCA CCT TCA CCG TTC CAG TTT-3′,扩增片段长度156 bp。PCR反应体系20 μL,其中cDNA 1 μL、上下游引物各1 μL、2×Taq PCR Master Mix 10 μL、ddH2O 7 μL。PCR反应程序: 95℃ 5 min;95℃ 20 s、58℃ 20 s、72℃ 30 s,30个循环;72℃ 5 min 结束反应。反应产物于1%琼脂糖凝胶上进行电泳。
收集两组细胞,加入RIPA裂解液提取总蛋白,BCA法进行蛋白定量并调平。取各组总蛋白40 μg进行SDS-PAGE,电泳结束后电转印至PVDF膜上。加入5%脱脂奶粉室温封闭1 h,加入稀释的一抗[MMP-9 (1:500)、TIMP-1(1:500)、PARP(1:400)、caspase-9(1:800)、ERK(1:400)、p-ERK(1:400)、p38(1:400)、p-p38(1:400)],4℃孵育过夜。加入1:5 000稀释的二抗,37℃孵育1 h,ECL法进行底物发光,曝光成像后扫描入电脑进行灰度分析。
应用SPSS 16.0软件进行统计分析,数据以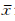 ±s表示,组间比较采用t检验,检验水准(α)为0.05。
±s表示,组间比较采用t检验,检验水准(α)为0.05。
CCK-8法检测结果(图1)显示,经80 μmol/L香芹酚作用后前列腺癌细胞DU145增殖明显受到抑制,自香芹酚作用的第3天开始细胞增殖能力低于阴性对照组,差异具有统计学意义(P<0.05,P<0.01)。

|
图 1 香芹酚(80 μmol/L)对前列腺癌DU145细胞增殖的抑制作用
Fig 1 Inhibitory effect of 80 μmol/L carvacrol on proliferation of prostate cancer cells DU145
*P<0.05,**P<0.01 vs negative control group.
n=5,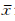 ±s ±s
|
流式细胞术检测细胞凋亡结果(图2)显示,80 μmol/L香芹酚作用DU145细胞24 h和48 h,细胞凋亡率分别为(24.98±2.41)%、(64.20±2.11)%,均高于阴性对 照组[24 h: (8.59±0.95)%;48 h: (12.18±1.50)%],差异有统计学意义(P<0.05)。

|
图 2 香芹酚(80 μmol/L)对前列腺癌DU145细胞凋亡的影响 Fig 2 Effect of 80 μmol/L carvacrol on apoptosis of prostate cancer cells DU145 A: Negative control group (24 h); B: Carvacrol group (24 h); C: Negative control group (48 h); D: Carvacrol group (48 h) |
Transwell细胞侵袭实验结果见图3。由计数结果可知,80 μmol/L香芹酚作用DU145细胞24 h和48 h后,侵袭细胞数分别为(36.00±3.61)个、(19.67±1.53)个,均低于阴性对照组[24 h: (88.33±2.52)个;48 h: (106.33±4.73)个],差异有统计学意义(P<0.01)。

|
图 3 香芹酚(80 μmol/L)对前列腺癌DU145细胞侵袭能力的影响 Fig 3 Effect of 80 μmol/L carvacrol on invasion ability of prostate cancer cells DU145 A: Negative control group (24 h); B: Carvacrol group (24 h); C: Negative control group (48 h); D: Carvacrol group (48 h). Original magnification: ×100 |
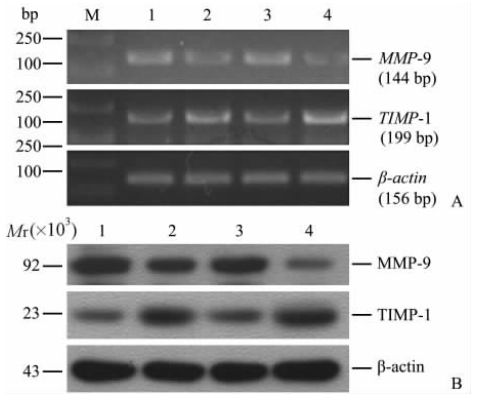
RT-PCR以及蛋白质印迹分析检测MMP-9、TIMP-1的 mRNA以及蛋白表达结果见图4。经80 μmol/L香芹酚作用DU145细胞24 h和48 h后,MMP-9的表达明显降低,而TIMP-1的表达明显升高。
|
图 4 香芹酚(80 μmol/L)对前列腺癌DU145细胞MMP-9、TIMP-1表达的影响 Fig 4 Effect of 80 μmol/L carvacrol on expression of MMP-9 and TIMP-1 in prostate cancer cells DU145 A: mRNA expression; B: Protein expression. 1: Negative control group (24 h); 2: Carvacrol group (24 h); 3: Negative control group (48 h); 4: Carvacrol group (48 h) |
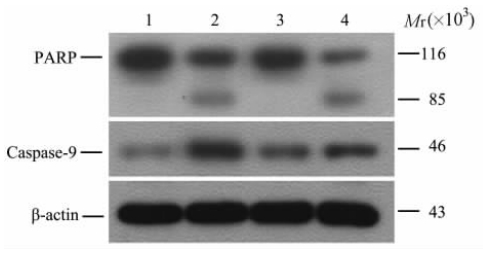
蛋白质印迹分析(图5)结果显示,经80 μmol/L香芹酚作用DU145细胞24 h和48 h后,细胞均出现相对分子质量为85 000的PARP裂解片段,而阴性对照组仅检测到相对分子质量为116 000的PARP蛋白;与阴性对照组相比,80 μmol/L香芹酚组caspase-9的表达升高。
|
图 5 香芹酚(80 μmol/L)对前列腺癌DU145细胞PARP、caspase-9蛋白表达的影响 Fig 5 Effect of 80 μmol/L carvacrol on protein expression of PARP and caspase-9 in prostate cancer cells DU145 1: Negative control group (24 h); 2: Carvacrol group (24 h); 3: Negative control group (48 h); 4: Carvacrol group (48 h) |
蛋白质印迹分析结果(图6)显示,两组细胞总ERK以及总p38的表达无明显变化,80 μmol/L香芹酚作用后p-ERK表达有所降低,而p-p38的表达有所升高,表明香芹酚抑制了ERK的激活,同时促进了p38的激活。

|
图 6 香芹酚(80 μmol/L)对MAPK信号通路蛋白表达的影响 Fig 6 Effect of 80 μmol/L carvacrol on expression of proteins related to MAPK signaling pathway in prostate cancer cells DU145 1: Negative control group (24 h); 2: Carvacrol group (24 h); 3: Negative control group (48 h); 4: Carvacrol group (48 h) |
香芹酚化学名称5-异丙基-2-甲基苯酚,又名异麝香草酚,是牛至油以及百里香油的主要成分,是一种安全的食品添加剂,常应用于糖果、饮料和口香糖的生产中[ 8 ]。研究表明,香芹酚有着广泛的生物活性,包括抗炎[ 9 ]、抗氧化[ 10 ]以及抗肿瘤[ 4,5,6,7 ]等。Mehdi等[ 7 ]将香芹酚作用于宫颈癌HeLa细胞和SiHa细胞,结果显示细胞增殖能力呈剂量依赖性降低,同时DNA断裂,出现细胞凋亡,证明香芹酚在宫颈癌 细胞中的细胞毒性作用。Yin等[ 5 ]将不同浓度的香 芹酚作用于肝癌细胞株HepG2,同样检测到细胞增 殖的抑制以及凋亡的增加。本实验室前期采用不同浓度的香芹酚作用于DU145细胞,MTT法确定了其最适用浓度为80 μmol/L。本研究采用最适浓度的香芹酚作用于前列腺癌细胞,结果显示细胞活性明显受到抑制,自作用的第3天起细胞增殖能力显著低于阴性对照组,同时在其作用的24 h即检测到细胞凋亡的增加,表明香芹酚也具有一定的抗前列腺癌作用。
细胞内的一系列凋亡级联反应中均有半胱天冬酶caspase的参与,其中caspase-9为下游重要的效应酶。PRAP在维持DNA完整性上发挥着重要作用并被作为细胞凋亡的标志。若PRAP发生降解则失去对DNA完整性的保护作用,使核酸内切酶活性增高,裂解核小体间的DNA,从而引发细胞凋亡[ 11 ]。本研究中香芹酚作用后前列腺癌细胞中PRAP出现了相对分子质量为85 000的片段,同时caspase-9表达升高,而阴性对照组未发生明显变化,进一步表明香芹酚具有诱导肿瘤细胞凋亡的作用。
MAPK信号通路主要包括ERK、p38以及JNK 3条通路,在细胞增殖、凋亡以及分化过程中发挥着重要作用[ 12,13 ]。研究表明,肿瘤组织中ERK通路常处于异常的激活状态[ 14,15 ],p38信号则参与多种细胞凋亡途径,p38的激活能够诱导c-Myc、p53以及Fas/FasL等多种凋亡相关蛋白的表达,从而诱导凋亡[ 16,17 ]。ERK通路的激活能够抑制细胞的凋亡,而抑制ERK信号通路能够诱导细胞凋亡。有学者将香芹酚作用于肝癌细胞,检测到p-ERK的表达显著降低,同时p-p38显著升高,而JNK未发生明显变化[ 5 ]。本研究中香芹酚作用后同样检测到ERK活性的降低,p38活性的升高,表明香芹酚诱导前列癌细胞凋亡的过程可能与ERK以及p38信号通路密切相关。
前列腺癌极易发生转移且目前尚无有效的治疗手段。肿瘤细胞侵袭转移为一个多步骤的生物学过程,其中细胞外基质和基底膜的降解是肿瘤转移的重要环节,基质金属蛋白酶(MMPs)及其抑制剂(TIMPs)在此过程中发挥着关键作用[ 18,19 ]。本研究将香芹酚作用于侵袭能力较强的雄激素非依赖性前列腺癌细胞株DU145,结果香芹酚组细胞侵袭能力显著降低,同时MMP-9表达受到抑制而TIMP-1表达升高,提示香芹酚在抑制前列腺癌细胞侵袭的过程中也发挥着一定的作用。ERK信号转导通路参与MMPs表达的调节,抑制ERK的激活能够阻碍肿瘤的侵袭[ 20 ],据此推测香芹酚抑制前列腺癌侵袭的作用可能与ERK通路的抑制有关,但此过程是否还有其他通路的参与及其详细的作用机制还有待于进一步研究。
所有作者声明本文不涉及任何利益冲突。
| [1] | Jemal A, Bray F, Center M M, Ferlay J, Ward E, Forman D.Global cancer statistics[J].CA Cancer J Clin, 2011, 61:69-90. |
| [2] | Kisk G, Roller S.Carvacrol and p-cymene inactivate Escherichia coli O157:H7 in apple juice[J].BMC Microbiol, 2005, 5:36. |
| [3] | Baser K H.Biological and pharmacological activities of carvacrol and carvacrol bearing essential oils[J].Curr Pharm Des, 2008, 14:3106-3119. |
| [4] | Koparal A T, Zeytinoglu M.Effects of carvacrol on a human non-small cell lung cancer (NSCLC) cell line, A549[J].Cytotechnology, 2003, 43(1-3):149-154. |
| [5] | Yin Q H, Yan F X, Zu X Y, Wu Y H, Wu X P, Liao M C, et al.Anti-proliferative and pro-apoptotic effect of carvacrol on human hepatocellular carcinoma cell line HepG-2[J].Cytotechnology, 2012, 64:43-51. |
| [6] | Arunasree K M.Anti-proliferative effects of carvacrol on a human metastatic breast cancer cell line, MDA-MB 231[J].Phytomedicine, 2010, 17:581-588. |
| [7] | Mehdi S J, Ahmad A, Irshad M, Manzoor N, Rizvi M M A.Cytotoxic effect of carvacrol on human cervical cancer cells[J].Biol Med, 2011, 3:307-312. |
| [8] | Lampronti I, Saab A M, Gambari R.Antiproliferative activity of essential oils derived from plants belonging to the Magnoliophyta division[J].Int J Oncol, 2006, 29:989-995. |
| [9] | Guimarāes A G, Xavier M A, de Santana M T, Camargo E A, Santos C A, Brito F A, et al.Carvacrol attenuates mechanical hypernociception and inflammatory response[J].Naunyn Schmiedebergs Arch Pharmacol, 2012, 385:253-263. |
| [10] | Yu W, Liu Q, Zhu S.Carvacrol protects against acute myocardial infarction of rats via anti-oxidative and anti-apoptotic pathways[J].Biol Pharm Bull, 2013, 36:579-584. |
| [11] | Kuranaga E.Beyond apoptosis:caspase regulatory mechanisms and functions in vivo[J].Genes Cells, 2012, 17:83-97. |
| [12] | Fecher L A, Amaravadi R K, Flaherty K T.The MAPK pathway in melanoma[J].Curr Opin Oncol, 2008, 20:183-189. |
| [13] | Junttila M R, Li S P, Westermarck J.Phosphatase-mediated crosstalk between MAPK signaling pathways in the regulation of cell survival[J].FASEB J, 2008, 22:954-965. |
| [14] | Boucher M J, Morisset J, Vachon P H, Reed J C, Lain J, Rivard N.MEK/ERK signaling pathway regulates the expression of Bcl-2, Bcl-XL, and Mcl-1 and promotes survival of human pancreatic cancer cells[J].J Cell Biochem, 2000, 79:355-369. |
| [15] | Kohno M, Pouyssegur J.Targeting the ERK signaling pathway in cancer therapy[J].Ann Med, 2006, 38:200-211. |
| [16] | Gan L, Wang J, Xu H, Yang X.Resistance to docetaxel-induced apoptosis in prostate cancer cells by p38/p53/p21 signaling[J].Prostate, 2011, 71:1158-1166. |
| [17] | Wang W Z, Li L, Liu M Y, Jin X B, Mao J W, Pu Q H, et al.Curcumin induces FasL-related apoptosis through p38 activation in human hepatocellular carcinoma Huh7 cells[J].Life Sci, 2013, 92(6-7):352-358. |
| [18] | Aalinkeel R, Nair B B, Reynolds J L, Sykes D E, Mahajan S D, Chadha K C, et al.Overexpression of MMP-9 contributes to invasiveness of prostate cancer cell line LNCaP[J].Immunol Invest, 2011, 40:447-464. |
| [19] | Jayasooriya R G, Lee Y G, Kang C H, Lee K T, Choi Y H, Park S Y, et al.Piceatannol inhibits MMP-9-dependent invasion of tumor necrosis factor-α-stimulated DU145 cells by suppressing the Akt-mediated nuclear factor-κB pathway[J].Oncol Lett, 2013, 5:341-347. |
| [20] | Kinkade C W, Castillo-Martin M, Puzio-Kuter A, Yan J, Foster T H, Gao H, et al.Targeting AKT/mTOR and ERK MAPK signaling inhibits hormone-refractory prostate cancer in a preclinical mouse model[J].J Clin Invest, 2008, 118:3051-3064. |
 2014, Vol. 35
2014, Vol. 35


