脑缺血导致中枢神经系统损伤后,机体功能恢复十分困难,这主要是神经轴突再生受到抑制。目前已知的轴突生长抑制因子有Nogo-A、髓鞘相关糖蛋白(myelin-associated glycoprotein,MAG)、少突胶质细胞髓鞘糖蛋白(oligodendrosyte-myelin glycoprotein,OMGP),它们通过与细胞表面的Nogo受体结合,激活RhoA/Rho激酶(Rho-associated kinase,ROCK)信号通路,使肌动蛋白骨架解聚,介导生长锥的塌陷,抑制轴突延伸,从而抑制轴突的生长[ 1,2 ]。 研究表明,针刺内关穴和足三里穴能改善脑梗死大鼠神经功能,对大鼠神经细胞具有保护作用[ 3,4 ]。 作为细胞内髓鞘抑制信号的主要效应分子,ROCK以两种同源异构体形式存在,即ROCK1和ROCK2,在调节神经轴突再生中发挥重要作用。本研究通过建立局灶性脑梗死大鼠模型,利用免疫组织化学法和免疫印迹法观察梗死灶周围皮质ROCK1、ROCK2蛋白的表达以及电针刺激相关穴位对其表达的影响,初步探讨电针刺激对缺血脑组织保护方面的作用机制。
清洁级成年健康雄性SD大鼠40只,体质量为280~300 g,由重庆医科大学实验动物中心提供,实验动物生产许可证号:SCXK(渝)2007-0001,使用许可证号:SYXK(渝)2007-0001。将动物随机分为4组:正常组、假手术组、模型组和电针穴位组,每组10只。
ROCK1、ROCK2抗体购自北京博奥森生物技术有限公司,二抗(兔抗山羊)购自北京中杉金桥生物公司,免疫印迹分析相关试剂购自上海碧云天生物技术有限公司,SABC免疫组化试剂盒和DAB显色试剂盒购自武汉博士德生物工程有限公司。Olympus光学显微镜,上海医疗仪器厂G6805电针仪,“华佗牌”30号1寸毫针。
参照Longa等[ 5 ]方法并加以改造,制备大鼠大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型。以10%水合氯醛(0.35 mL/100 g)腹腔注射麻醉大鼠,取其颈部正中偏右位置作一长约 1.5 cm皮肤切口, 找到颈总动脉后分离出颈外动脉和颈内动脉。在动脉分叉处挂线,然后结扎颈外动脉。用大鼠动脉夹夹紧颈总动脉近心端以及颈内动脉,然后用眼科剪在颈总动脉上剪一小口,将线栓经切口插入颈内动脉,当线栓穿过颈总动脉分叉处时将预先挂于颈总动脉的挂线打一单结固定,然后取走颈内动脉上的动脉夹,用细镊缓慢地将线栓向颈内动脉方向推送约 19~21 mm。2 h后进行再灌注处理,最后清创缝合伤口。假手术组处理除不进行线栓阻塞外,其余手术步骤同模型组。
每组大鼠分别在术后1、3、7、14 d进行改良神经功能缺损评分(modified neurological severity score,mNSS), 包括运动、感觉、反射、平衡4项指标,评分范围0~18分, 0分代表未见损伤,得分越高代表神经损伤越严重[ 6 ]。
电针穴位组大鼠在麻醉苏醒后90 min进行电针刺激。应用1寸毫针刺激功能缺失侧,参照《实验针灸学》选取“内关”(PC6)和“足三里”(ST36)穴,用电针仪进行刺激,每天1次,连续14 d。刺激参数选择疏密波,频率80~100 Hz,电流强度1~3 mA,电压1~3 V,留针30 min。强度以保持针刺局部轻微颤抖为度。正常组、假手术组和模型组不做任何治疗。
术后14 d,将各组大鼠(n=5)用10%水合氯醛进行深度麻醉,打开胸腔,暴露心脏,剪开右心耳,经左心室灌注磷酸盐缓冲液(PBS,pH 7.25~7.35)250 mL,然后以4%多聚甲醛PBS 200 mL进行内固定。处死大鼠,取脑组织后放入4%多聚甲醛溶液中固定48 h。 再行脱水处理,石蜡包埋,冠状连续切片,取缺血中心部位(前囟嘴侧0.2~0.8 mm)脑切片染色,最后将切片经脱水、透明、封固,在镜下观察。每只大鼠取相同缺血部位3张切片,每张切片随机取梗死周边区6个不同的视野拍照,利用Image-ProPlus6.0图像分析软件测定梗死周边区免疫反应阳性产物平均光密度值和累计光密度值。
术后14 d取各组大鼠(n=5)大脑,选取缺血侧大脑皮质新鲜组织放入液氮保存备用,避免反复融冻。严格按照 试剂盒说明书提取全蛋白,采用BCA蛋白定量法检测蛋白浓度。取80 μL样品和20 μL样品处理液,混合均匀,封闭后100℃水浴10 min,每孔上样量20 μL。行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),然后转膜至PVDF膜,5%脱脂奶粉封闭30 min;加一抗(稀释浓度为1100) 4℃孵育过夜,37℃复温30 min;TBST漂洗3次;加二抗(稀释浓度为12 500)室温孵育2 h;TBST 漂洗3次;上凝胶成像仪成像。以GAPDH为内参,用Quantity One 4.6图像分析软件(美国Bio-Rad公司)进行结果分析。
运用SPSS 18.0 统计软件进行数据处理,数据以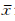 ±s表示,资料进行单因素方差分析,若总体均数不等或不全相等时,进行LSD-t检验,检验水准(α)为0.05。
±s表示,资料进行单因素方差分析,若总体均数不等或不全相等时,进行LSD-t检验,检验水准(α)为0.05。
正常组和假手术组大鼠在术后1、3、7、14 d均未出现神经功能缺损表现。电针穴位组术后1、3 d的mNSS与模型组差异无统计学意义(P>0.05),但术后7、14 d较模型组降低(P<0.05,图1)。
|
图 1 模型组和电针穴位组大鼠各时间点mNSS比较
mNSS: 改良神经功能缺损评分.
*P<0.05与模型组比较.
n=10,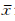 ±s ±s
|
术后14 d免疫组化结果显示大鼠大脑皮质梗死灶周边阳性细胞表现为大小不等的黄褐色颗粒,分布在大脑皮质脑梗死灶的周边区,主要集中在细胞核的周围(图略)。模型组和电针穴位组ROCK1和ROCK2蛋白的表达高于正常组和假手术组(P<0.01);电针穴位组ROCK1和ROCK2蛋白的表达低于模型组(P<0.05,图2A、2B)。
|
图 2 术后14 d各组ROCK1(A)和ROCK2(B)蛋白免疫组化检测定量结果
**P<0.01与正常组和假手术组比较,
△ P<0.05 与模型组比较.
n=5,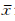 ±s ±s
|
术后14 d免疫印迹分析结果(图3)显示, 模型组和电针穴位组ROCK1和ROCK2蛋白表达高于正常组和假手术组(P<0.01); 电针穴位组ROCK1和ROCK2蛋白表达较模型组减少(P<0.05)。
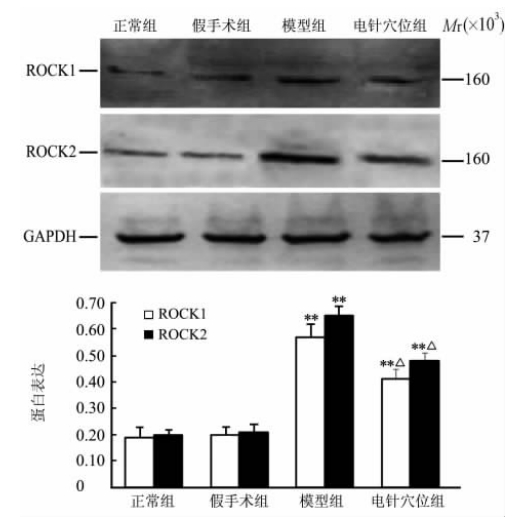
|
图 3 术后14 d时免疫印迹分析检测各组 ROCK1和ROCK2蛋白的表达
**P<0.01与正常组和假手术组比较;
△ P<0.05 与模型组比较.
n=5,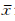 ±s ±s
|
ROCK属于丝氨酸/苏氨酸蛋白激酶家族成员之一,是目前研究得最为清楚的 Rho下游效应分子[ 7 ]。ROCK通过多种途径参与脑缺血损害,如下调内皮源型一氧化氮(eNO)活性增加内皮细胞和血管平滑肌细胞的收缩张力[ 8 ],参与调整内皮细胞纤溶酶原激活物抑制因子1(PAI-1)表达而影响脑缺血[ 9 ],调整参与脑卒中发生的基质金属蛋白酶9(MMP-9)表达和介导炎症反应的多个环节而影响脑缺血前后的炎症反应[ 10 ]。同时 ROCK的激活可以使生长锥塌陷而抑制轴突再生[ 1,2 ],在神经再生中扮演着重要角色。
本研究发现,正常大鼠和假手术组大鼠脑组织中有少量的ROCK1和ROCK2蛋白表达,模型组大鼠脑组织内有ROCK1和ROCK2蛋白大量表达,与正常大鼠相比显著升高,提示这两种蛋白的表达在脑梗死大鼠中可能发挥神经抑制作用。造模14 d后,电针穴位组mNSS低于模型组,电针穴位组ROCK1和ROCK2蛋白的表达也较模型组减少,提示电针刺激 促进MCAO大鼠运动功能恢复可能与抑制梗死区周围抑制因子ROCK1和ROCK2的表达有关。
电针作用与选穴密切相关,本研究针刺选用远端取穴法,选用内关和足三里,内关为心包经络穴,取内关穴可通窍醒神、通血脉行气血,实现对元神的调节作用。足三里为足阳明经合穴,阳明经为多气多血之经,阳明经气血通畅正气得以扶助,才能使机体功能逐渐恢复,故电针足三里可以起到益气养血、行气活血的作用。在临床上内关与足三里两穴相配对脑梗死患者可以起到醒脑开窍、畅通气血的作用。 由于针刺组方缺乏特异性,可能对改善脑缺血后神经再生起到不同作用,本研究证实了内关和足三里在这方面的作用,我们今后的研究应该通过不同的穴位配伍,选取疗效最佳的穴位组合从而提高临床疗效。 另外,电针强度和波形对其作用结果的影响有待考察。
综上,电针刺激对局灶性脑梗死大鼠神经功能的改善作用可能与其下调梗死灶周围皮质ROCK1和ROCK2蛋白表达有关。
所有作者声明本文不涉及任何利益冲突。
| [1] | Kozma R, Sarner S, Ahmed S, Lim L.Rho family GTPases and neuronal growth cone remodelling:relationship between increased complexity induced by Cdc42Hs, Rac1, and acetylcholine and collapse induced by RhoA and lysophosphatidic acid[J].Mol Cell Biol, 1997, 17:1201-1211. |
| [2] | Kranenburg O, Poland M, van Horck F P, Drechsel D, Hall A, Moolenaar W H.Activation of RhoA by lysophosphatidic acid and Galpha12/13 subunits in neuronal cells:induction of neurite retraction[J].Mol Biol Cell, 1999, 10:1851-1857. |
| [3] | 周元成, 吴新贵, 肖贻财.电针刺激"足三里"和"内关"对脑梗死大鼠GAp-43表达的影响[J].中国针灸, 2011, 31:55-58. |
| [4] | 王 舒, 钱宇斐, 樊小农, 张亚男, 魏媛媛, 张 雪, 等.醒脑开窍针刺法主穴内关对脑缺血模型 (MCAO)大鼠脑神经细胞坏死的抑制作用研究[J].山西中医, 2009, 25:41-44. |
| [5] | Longa E Z, Weinstein P R, Carlson S, Cummins R.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke, 1989, 20:84-91. |
| [6] | Chen J, Sanberg P R, Li Y, Wang L, Lu M, Willing A E, et al.Intravenous administration of human umbilical cord blood reduces behavioral deficits after stroke in rats[J].Stroke, 2001, 32:2682-2688. |
| [7] | Tawara S, Shimokawa H.Progress of the study of rho-kinase and future perspective of the inhibitor[J].Yakugaku Zasshi, 2007, 127:501-514. |
| [8] | Rikitake Y, Kim H H, Huang Z, Seto M, Yano K, Asano T, et al.Inhibition of Rho kinase (ROCK) leads to increased cerebral blood flow and stroke protection[J].Stroke, 2005, 36:2251-2257. |
| [9] | Samarakoon R, Higgins S P, Higgins C E, Higgins P J.TGF-beta1-induced plasminogen activator inhibitor-1 expression in vascular smooth muscle cells requires pp60(c-src)/EGFR(Y845) and Rho/ROCK signaling[J].J Mol Cell Cardiol, 2008, 44:527-538. |
| [10] | Wang Q M, Liao J K.ROCKs as immunomodulators of stroke[J].Expert Opin Ther Targets, 2012, 16:1013-1025. |
 2014, Vol. 35
2014, Vol. 35


