白三烯B4 (leukotriene B4,LTB4)是一种强有力的炎性介质和趋化因子,通过与其相应受体结合而发挥生物学效应,在许多疾病中具有重要作用。白三烯B4受体1(leukotriene B4 receptor 1,LTB4-BLT1)是LTB4的高亲和力受体,主要在白细胞尤其是中性粒细胞和巨噬细胞上表达[ 1 ],近年来发现LTB4-BLT1在T细胞[ 2 ]、树突状细胞(dendritic cells,DC)、破骨细胞上都有表达[ 3,4 ]。近年来,关于LTB4通过LTB4-BLT1介导的免疫调控作用逐渐成为研究的热点。文献表明LTB4通过LTB4-BLT1参与支气管哮喘、慢性阻塞性肺疾病、类风湿性关节炎等病理生理过程[ 5,6,7 ]。免疫细胞功能的调控是上述疾病发生发展的关键因素。本研究通过脓毒症动物模型的在体研究,探讨用LTB4-BLT1特异性拮抗剂U75302阻断LTB4-BLT1对脓毒症小鼠免疫功能的影响。
健康雄性C57BL/6小鼠,8~10周龄,体质量20~30 g,由第二军医大学实验动物中心提供。所有动物实验前均在室温维持于20~25℃、湿度20%~30%、LD12/12(12 h light/12 h dark)的环境中饲养1周。LTB4-BLT1拮抗剂U75302(Cayman,100 μg)购于上海麦约尔生物技术有限公司;肿瘤坏死因子α (tumor necrosis factor-α,TNF-α) ELISA试剂盒(Mouse TNF-alpha Quantikine ELISA Kit,Cat: MTA00B)及白介素10(interleukin-10,IL-10) ELISA试剂盒(Mouse IL-10 Quantikine ELISA Kit,Cat:M1000)均购于美国R&D生物技术公司;流式细胞术荧光抗体Anti-Mouse CD3-APC-Cy7购于美国BioLegend公司;流式细胞术荧光抗体Anti-Mouse Gr-1-FITC以及凋亡检测试剂盒(Annexin Ⅴ-FITC Apoptosis Detection Kit)购于美国eBiscience公司。MACS Quant型流式细胞仪购于德国美天旎(Miltenyi Biotec GmbH)生物技术公司。小动物麻醉实验平台由第二军医大学长海医院麻醉科自制。
将18只雄性C57BL/6小鼠随机分为假手术组(sham组,n=6)、盲肠结扎穿孔术(cecal ligation and puncture,CLP)组(n=6)和CLP+腹腔注射U75302组(n=6)。 本实验全部采用CLP术复制脓毒症小鼠模型[ 8 ]。小鼠先持续吸入3%七氟烷进行麻醉,麻醉后将小鼠固定于手术板上,腹部正中区域备皮并消毒。取腹部正中切口并逐层切开,切开腹直肌及腹膜后用无损伤探子寻及并暴露盲肠及其周围邻近肠管。在距离盲肠末端约整个盲肠长度的1/3~1/2处使用3-0号丝线结扎盲肠以及肠系膜血管,再对结扎部分盲肠进行穿刺,穿刺点选取结扎段盲肠肠系膜血管对侧乏血管区,单孔穿刺,不对穿盲肠,轻微挤出少许内容物,确保穿刺孔的通畅。将所有肠管回纳入腹腔,最后缝合手术伤口。术后于背部皮下注射生理盐水0.5 mL,放回鼠笼,暖风机加热,待其自由苏醒。苏醒后小鼠自由摄食及饮水。Sham组动物除不行CLP外,其余手术操作均与CLP致脓毒症组动物的处理相同。
CLP术后1 h时,给予CLP+U75302组腹腔注射LTB4-BLT1拮抗剂U75302 (每只5 μg/100 μL),sham组和CLP组分别腹腔注射无菌生理盐水(每只100 μL)。随后按照术前的饲养条件饲养,自由进食饮水。
实验模型建立24 h时,将各组小鼠给予3%七氟烷吸入麻醉。75%乙醇消毒小鼠腹面,无菌剪刀剪开小鼠剑突下皮肤,用2 mL无菌空针穿刺心脏采血0.8 mL左右,注入无菌肝素抗凝管备用;剪开小鼠腹部皮肤,经腹腔穿刺注入2 mL灭菌生理盐水,冲洗抽吸3次并收集腹腔灌洗液,回收率90%;解剖小鼠,取胸腺。将血液离心后取血浆,利用ELISA试剂盒检测细胞因子TNF-α及IL-10水平。腹腔灌洗液用免疫荧光抗体Anti-Mouse Gr-1-FITC染色后,使用流式细胞仪检测。剪碎胸腺组织并用3 mL注射器针芯捻磨组织,使分散的细胞滤过网筛进入塑料培养皿中,用PBS缓冲液冲洗网筛,收集胸腺细胞。制备好的胸腺细胞悬液用抗体Anti-Mouse CD3-APC-Cy7和凋亡试剂盒免疫荧光染色后,使用流式细胞仪检测。采用MACS流式细胞分析软件统计腹腔灌洗液Gr-1+细胞计数和胸腺CD3+ T淋巴细胞凋亡比例并采集典型的流式细胞散点图。
先采用SPSS 17.0软件进行统计学处理,计量数据以 ±s表示,对数据的正态性以及方差齐性进行检验,符合正态分布及方差齐性的数据再以Prism 5.01软件采用t 检验比较两组间差异;不符合正态分布或方差齐性两者任一条件的数据以Prism 5.01软件采用Mann Whitney非参数检验统计方法比较两组间差异。检验水准(α)为0.05。
与sham组小鼠相比,CLP组小鼠外周血TNF-α及IL-10水平均有升高(P<0.01)。U75302干预后,脓毒症小鼠外周血促炎细胞因子TNF-α水平降低约43% (P<0.05),而抑炎细胞因子IL-10水平升高约88%(P<0.05)。见表1。
| 表1 各组小鼠血浆细胞因子TNF-α及IL-10水平比较 Tab 1 Plasma TNF-α and IL-10 levels among different groups n=6, ±s,ρB/(pg·mL-1) |
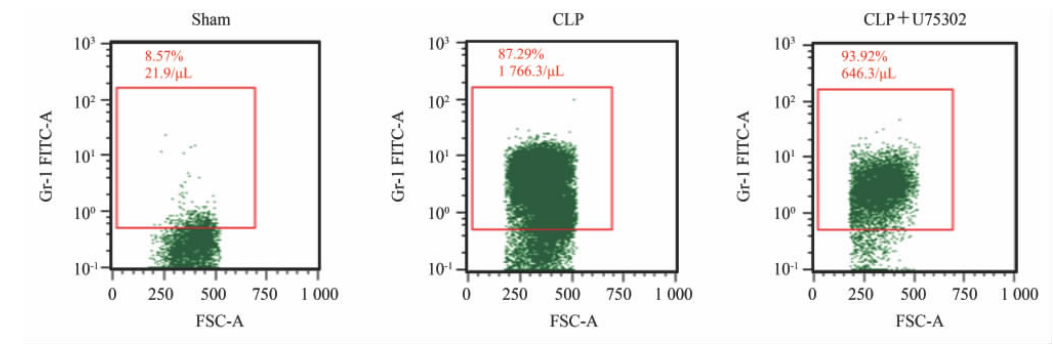
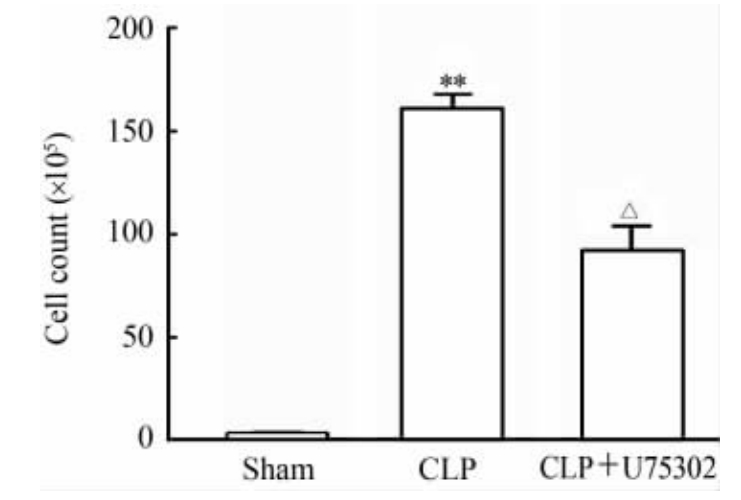
图1是典型的流式细胞散点图。与sham组小鼠相比,CLP组小鼠腹腔灌洗液Gr-1+细胞计数升高(P<0.01);U75302干预后,脓毒症小鼠腹腔灌洗液Gr-1+细胞计数降低(P<0.05),见图2。
|
图 1 各组小鼠腹腔冲洗液Gr-1+细胞流式细胞计数典型图 Fig 1 Typical figures of Gr-1+ cell count in mice peritoneal lavage fluid in each group CLP: Cecal ligation and puncture |
|
图 2 各组小鼠腹腔冲洗液Gr-1+细胞计数比较 Fig 2 Comparison of Gr-1+ cell counts in mouse peritoneal lavage fluid among different groups CLP: Cecal ligation and puncture. **P<0.01 vs sham group; △P<0.05 vs CLP group. n=6, ±s |
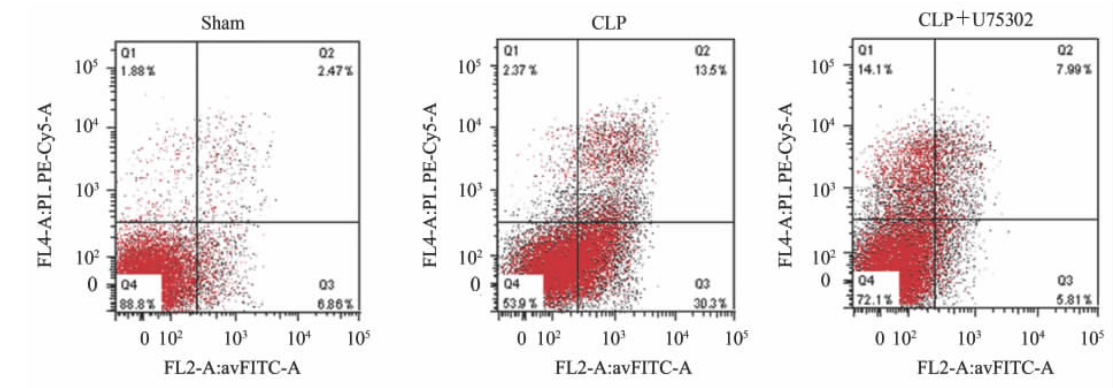
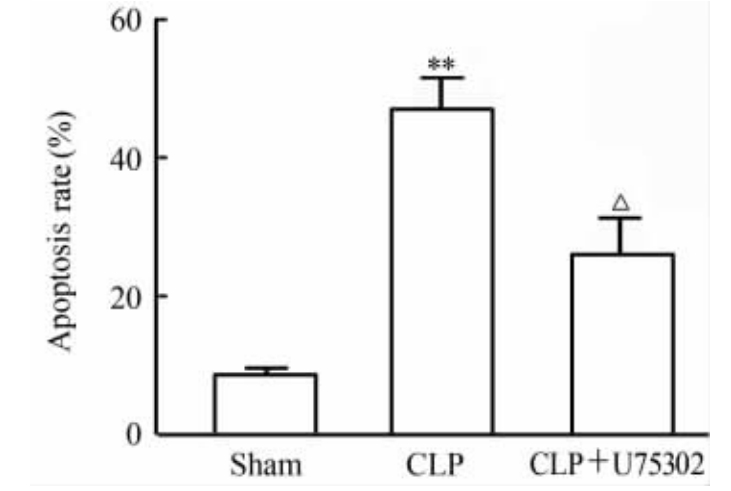
图3是典型的流式细胞散点图。与sham组小鼠相比,CLP组小鼠胸腺CD3+T淋巴细胞凋亡(早期凋亡+晚期凋亡)比例增加(P<0.01);U75302干预后,脓毒症小鼠胸腺CD3+T淋巴细胞凋亡(早期凋亡+晚期凋亡)比例减少(P<0.01,图4)。
|
图 3 各组小鼠胸腺CD3+细胞凋亡情况的流式细胞典型图 Fig 3 Cell apoptosis in mouse thymus of CD3+ T lymphocytes in each group CLP: Cecal ligation and puncture |
|
图 4 各组小鼠胸腺CD3+T淋巴细胞凋亡细胞的比较 Fig 4 Comparison of cell apoptosis in mouse thymus CD3+ T lymphocytes among different groups CLP: Cecal ligation and puncture. **P<0.01 vs sham group; △P<0.05 vs CLP group. n=6, ±s |
脓毒症(sepsis)是一种由感染引起全身性炎症反应的临床综合征[ 9 ],其治疗费用高且预后差。过去对脓毒症的研究一直聚焦于促炎与抗炎、氧化与抗氧化以及凝血与纤溶等系统的研究,虽然发现了一些能调节免疫功能、阻断脂质过氧化以及恢复凝血与纤溶平衡的新药,但临床疗效仍欠佳[ 10,11,12 ]。
目前许多研究认为,脓毒症病程的发生进展,不仅是各类炎症信号异常放大而导致的机体损害,还存在免疫系统的功能紊乱,脓毒症患者的免疫状态与脓毒症的发展和转归密切相关,调节脓毒症患者的免疫功能从而改善脓毒症患者的预后,已成为当前脓毒症研究的热点[ 13 ]。
脓毒症时机体免疫系统受到激发,诱发多种生物级联反应,其特征是早期异常放大的炎症反应。脓毒症时全身炎症反应以TNF-α、IL-6、IL-1和IFN-γ的大量释放最为明显。TNF-α在感染和炎性反应过程中最早释放并起关键始动作用[ 14 ]。TNF-α等的大量增多又导致抗炎因子如IL-10的反应性提高。IL-10不仅能直接抑制炎症细胞的增殖,还能抑制单核细胞的激活、迁移、黏附以及细胞因子的合成释放[ 15 ]。本研究选用TNF-α和IL-10来探讨 LTB4-BLT1特异性拮抗剂 U75302对CLP脓毒症小鼠免疫功能的影响。结果表明,给予 U75302后,脓毒症小鼠外周血促炎细胞因子TNF-α水平下降,而抑炎细胞因子IL-10水平上升,提示脓毒症小鼠异常放大的炎症反应得以缓解,这对于避免后续继发的免疫抑制状态有积极意义。中性粒细胞和单核巨噬细胞是感染发生时最早聚集到局部病灶的细胞,也是炎症浸润和炎症损伤的主要细胞,Gr-1+细胞包括中性粒细胞和单核巨噬细胞。本研究中给予U75302后,脓毒症小鼠腹腔Gr-1+细胞数目减少,提示炎性细胞浸润减轻,有利于减轻组织损伤。
Ayala等[ 16 ]早已报道脓毒症时会出现淋巴细胞凋亡增加的现象。这不但会导致特异性免疫细胞大量减少,还会破坏特异性免疫与非特异性免疫之间的联系,使得树突状细胞向Th细胞提呈抗原的能力下降。同时还表现出淋巴细胞的增殖能力下降及Th1/Th2比例失调,从而使机体对脓毒症引起的二重感染的易感性增加并降低机体对病原体的抵抗力。胸腺是机体重要的中枢免疫器官,是T淋巴细胞分化、发育和成熟的场所,而CD3细胞分子又是T细胞发育不同阶段的重要表面标志,其阳性表达或阴性表达可以作为研究不同成熟阶段的依据[ 17 ]。因此本研究中选用胸腺CD3+T淋巴细胞的凋亡比例,作为衡量U75302是否会影响脓毒症时T淋巴细胞凋亡的指标。结果表明,小鼠胸腺CD3+T淋巴细胞在脓毒症时凋亡明显增多,使用LTB4-BLT1特异性拮抗剂U75302后凋亡减轻,在一定程度上可改善脓毒症后续免疫抑制的发生和持续存在。
所有作者声明本文不涉及任何利益冲突。
| [1] | Yokomizo T, Izumi T, Chang K, Takuwa Y, Shimizu T.G-protein-coupled receptor for leukotriene B4 that mediates chemotaxis[J].Nature, 1997, 387:620-624. |
| [2] | Oyoshi M K, He R, Li Y, Mondal S, Yoon J, Afshar R, et al.Leukotriene B4-driven neutrophil recruitment to the skin is essential for allergic skin inflammation[J].Immunity, 2012, 37:747-758. |
| [3] | Miyahara N, Ohnishi H, Matsuda H, Miyahara S, Takeda K, Koya T, et al.Leukotriene B4 receptor 1 expression on dendritic cells is required for the development of Th2 responses and allergen-induced airway hyperresponsiveness[J].J Immunol, 2008, 181:1170-1171. |
| [4] | Hikiji H, Ishii S, Yokomizo T, Takato T, Shimizu T.A distinctive role of the leukotriene B4 receptor BLT1 in osteoclastic activity during bone loss[J].Proc Natl Acad Sci USA, 2009, 106:21294-21299. |
| [5] | Zhang S J, Deng Y M, Zhu Y L, Dong X W, Jiang J X, Xie Q M.Intracerebroventricular injection of leukotriene B4 attenuates antigen-induced asthmatic response via BLT1 receptor stimulating HPA-axis in sensitized rats[J].Respir Res, 2010, 11:39. |
| [6] | Marian E, Baraldo S, Visentin A, Papi A, Saetta M, Fabbri L M, et al.Up-regulated membrane and nuclear leukotriene B4 receptors in COPD[J].Chest, 2006, 129:1523-1530. |
| [7] | Mathis S P, Jala V R, Lee D M, Haribabu B.Nonredundant roles for leukotriene B4 receptors BLT1 and BLT2 in inflammatory arthritis[J].J Immunol, 2010, 185:3049-3056. |
| [8] | Unsinger J, Mcglynn M, Kasten K R, Hoekzema A S, Watanabe E, Muenzer J T, et al.IL-7 promotes T cell viability, trafficking, and functionality and improves survival in sepsis[J].J Immunol, 2010, 184:3768-3779. |
| [9] | Shimaoka M, Park E J.Advances in understanding sepsis[J].Eur J Anaesthesiol Suppl, 2008, 42:146-153. |
| [10] | Wang H, Liao H, Ochani M, Justiniani M, Lin X, Yang L, et al.Cholinergic agonists inhibit HMGB1 release and improve survival in experimental sepsis[J].Nat Med, 2004, 10:1216-1221. |
| [11] | Huang W, Tang Y, Li L.HMGB1, a potent proinflammtory cytokine in sepsis[J].Cytokine, 2010, 51:119-126. |
| [12] | Cziupka K, Busemann A, Partecke L I, Pöschke C, Rath M, Traeger T, et al.Tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) improves the innate immune response and enhances survival in murine polymicrobial sepsis[J].Crit Care Med, 2010, 38:2169-2174. |
| [13] | Shubin N J, Monaghan S F, Ayala A.Anti-inflammatory mechanisms of sepsis[J].Contrib Microbiol, 2011, 17:108-124. |
| [14] | Zanotti S, Kumar A, Kumar A.Cytokine modulation in sepsis and septic shock[J].Expert Opin Investig Drugs, 2002, 11:1061-1075. |
| [15] | Londono D, Marques A, Hornung R L, Cadavid D.IL-10 helps control pathogen load during high-level bacteremia[J].J Immunol, 2008, 181:2076-2083. |
| [16] | Ayala A, Herdon C D, Lehman D L, Ayala C A, Chaudry I H.Differential induction of apoptosis in lymphoid tissues during sepsis:variation in onset, frequency, and the nature of the mediators[J].Blood, 1996, 87:4261-4275. |
| [17] | Schwarz B A, Bhandoola A.Trafficking from the bone marrow to the thymus:a prerequisite for thymopoiesis[J].Immunol Rev, 2006, 209:47-57. |
 2014, Vol. 35
2014, Vol. 35


