2. 广东医学院附属医院检验科, 湛江 524001;
3. 南方医科大学公共卫生与热带医学学院P3实验室, 广州 510515;
4. 广州医科大学第二附属医院检验科, 广州 510260
2. Department of Clinical Laboratory, Affiliated Hospital of Guangdong Medical College, Zhanjiang 524001, Guangdong, China;
3. P3 Laboratory, School of Public Health and Tropical Medicine, Southern Medical University, Guangzhou 510515, Guangdong, China;
4. Department of Clinical Laboratory, the Second Affiliated Hospital of Guangzhou Medical University, Guangzhou 510260, Guangdong, China
肠道病毒71 型(enterovirus 71,EV71)是小RNA病毒科肠道病毒属成员,是手足口病(hand-foot-mouth disease,HFMD)的主要传染源之一。EV71 感染所引起的 HFMD 的临床症状与柯萨奇病毒A16型(CA16)感染的临床表现一般较难区别,但EV71 感染除了引起 HFMD 以外,还能够引起无菌性脑膜炎、脑干脑炎和脊髓灰质炎样麻痹等多种与神经系统相关的疾病,严重时可危及生命[ 1,2,3,4 ]。EV71入侵感染中枢神经系统(central nervous system,CNS)的机制尚未清楚,因此,探明EV71感染CNS的致病机制对于防治EV71致CNS疾病至关重要。根据相关研究推测,EV71进入CNS可能通过3种途径: 病毒或通过入血穿血脑屏障 (blood-brain barrier,BBB) 或通过轴突逆运输入脑[ 5,6,7 ],或者采用“Trojan horse”方式通过感染免疫细胞而进入CNS[ 8,9 ]。其中BBB完整性的丢失被认为是EV71感染CNS致脑组织损伤的一个主要原因,但EV71究竟以何种机制穿过BBB尚未见报道。
本研究采用人脑微血管内皮细胞(human brain microvascular endothelial cells,HBMECs)建立体外血脑屏障,用来自于重症HFMD患者的EV71分离野毒株感染HBMECs,观察EV71与HBMECs的相互作用,探讨EV71穿BBB的相关机制。
1 材料和方法 1.1 材料人HBMECs由美国南加州大学Sheng-He Huang惠赠;RD细胞由广东省疾病预防控制中心微检科提供;EV71毒株(KC122766)是来自于临床诊断为重症HFMD患者的EV71分离鉴定毒株;DH5α为本实验室保存;高糖DMEM培养基购自Gibco公司;兔抗EV71 多克隆抗体、PE共轭的羊抗兔IgG抗体购自北京博奥森生物技术有限公司;Flurorescent Mounting Medium with DAPI购自北京中杉金桥生物技术有限公司;罗丹明-鬼笔环肽 (cytoskeleton)购自上海跃腾生物科技有限公司;DL2000TM DNA 标记物、pMD 18-T vector、One-step RNA PCR Kit (AMV)、BamHⅠ、实时定量PCR 试剂盒购自大连TaKaRa 公司。
1.2 EV71感染HBMECs的细胞形态学的检测6 孔细胞培养板内每孔接种2 mL 5×105 /mL HBMECs,采用含10%FBS的生长培养液培养。当细胞达到80%~90%融合时,倾倒掉生长培养液, 实验组孔每孔加入1.5 mL含2%FBS的维持培养液,再加入0.5 mL感染复数(multiplicity of infection,MOI)=5的EV71病毒悬液,并以此接种病毒时间点为0点记时,分别在第8、16、24、36小时加入0.5 mL EV71 病毒悬液侵袭感染。对照组孔只加同体积维持培养液。采用荧光显微镜普通光学镜头进行观察,不同样本间采用同样的放大倍数及相同曝光时间拍照。
1.3 HBMECs中EV71抗原的表达分析2 mL 5×105/mL HBMECs分别接种到2个35 mm2细胞培养皿内,采用MOI=5的EV71 感染HBMECs,并以培养液代替病毒模拟感染作为对照。细胞感染24 h后,倾倒掉培养上清液,PBS轻柔洗涤2次,然后将细胞用4%多聚甲醛固定30 min,PBS 洗涤2次,0.5% Triton X-100 作用15 min 以破膜,PBS 同上洗涤2次,0.6 mL 1% BSA 覆盖培养皿底部30 min 以抑制非特异性反应。每培养皿加入200 μL用1% BSA 稀释的兔抗EV71多克隆抗体 (1300),4℃吸附18 h。PBS 洗涤后,每孔用200 μL (1100) 1% BSA 稀释的PE共轭的羊抗兔IgG 抗体室温孵育1 h。PBS 洗涤后,每孔加入2 滴DAPI 抗荧光淬灭试剂染核5 min,采用荧光显微镜观察,不同样本间采用同样放大倍数及相同曝光时间拍照。 1.4 HBMECs中EV71颗粒的超微结构观察
将长成单层的HBMECs同上感染,对照组同前模拟感染。感染24 h后收集细胞,离心后用2.5%戊二醛固定,1%锇酸盐后固定,梯度乙醇脱水,包埋后超薄切片, 在透射电镜(H-7000FA,日立公司)下观察。 1.5 HBMECs内EV71 RNA拷贝数的定量分析
将5×105 /mL HBMECs以每孔0.5 mL种植在24孔板中的12孔内(剩余12孔为空白对照孔),培养24 h,细胞达到90%左右融合时,倾倒掉生长培养液,每孔加入1.5 mL含2%FBS的维持培养液,空白培养孔内加入相同维持培养液。同前采用EV71感染HBMECs,空白对照孔内每孔加入同样的EV71病毒悬液作为阴性对照。以加入维持液时间点为零点开始记时,6 d内每隔24 h吸取500 μL培养上清液冻存于-70℃冰箱备用,不重复孔吸取,每个时间点设置3个复孔。收集的病毒悬液的病毒RNA采用Total RNA Isolation User Manual Nucleospin RNA试剂盒(Macherey-Nagel,德国)提取,标准曲线的构建及病毒悬液RNA拷贝数测定主要根据文献[ 10 ]方法建立。 1.6 HBMECs 感染后细胞骨架形态的检测
2 mL 5×105 /mL HBMECs接种到35 mm2激光培养皿内,采用MOI=5的EV71 感染HBMECs,并以培养液代替病毒模拟感染作为对照。细胞感染24 h后,倾倒掉培养上清液,PBS (pH 7.4,0.01 mol/L) 轻柔洗涤2次,然后将细胞用4%多聚甲醛固定10 min,用PBS复洗3次,沥干水分(勿干燥),用1%BSA室温封闭5 min,PBS清洗3次。加入100 μL 10 nmol/L罗丹明-鬼笔环肽,室温避光20 min,PBS洗涤后观察实验结果。采用激光共聚焦显微镜 (Zeiss510) 成像,以545 nm激发光检测罗丹明标记红色荧光,不同组间采用完全一致成像系统参数设置,以保证准确的阳性信号荧光强度。
1.7 统计学处理采用SPSS13.0软件进行统计分析,EV71感染HBMECs阳性对照孔与阴性对照孔两组间的EV71 拷贝数比较采用两个重复因素的方差分析,数据以 ±s表示,检验水准(α)为0.05。
2 结 果 2.1 EV71致HBMECs的细胞病变图对照孔内HBMECs没有观察到细胞病变 (图1A);当HBMECs用EV71(MOI=5)感染8 h时,细胞变圆且折光度增加(图1B);随着感染时间延长,一些感染死亡的细胞从培养板内脱落而悬浮在培养液内(图1C、1D);至36 h时,大多数细胞从培养板表面脱落(图1E)。表明EV71能感染HBMECs而引起细胞病变。
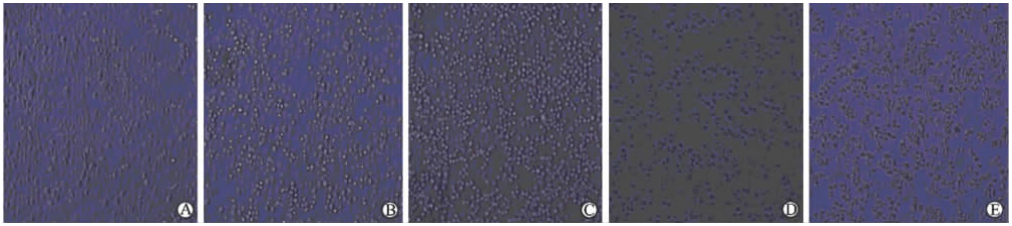 | 图 1 HBMECs感染EV71后的细胞形态学观察Fig 1 Cytopathic changes of HBMECs after enterovirus 71(EV71) infectionHBMECs: Human brain microvascular endothelial cells. A: Control group; B-E: HBMECs infected with EV71 at multiplicity of infection (MOI)=5 for 8 h,16 h,24 h and 36 h,respectively. Original magnification: × 200 |
抗EV71多克隆抗体免疫荧光染色结果可见,红色EV71抗原遍布在EV71感染HBMECs的整个细胞内,但对照组细胞内不存在 (图2)。结果证实EV71能感染HBMECs,并且可以进入细胞核中复制。
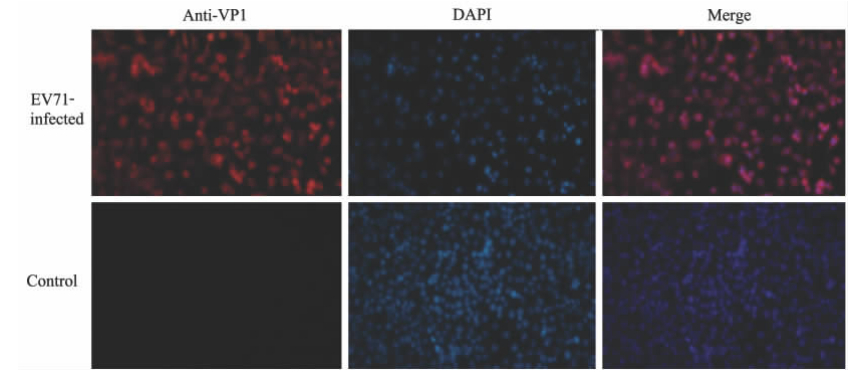 | 图 2 HBMECs内EV71抗原的免疫荧光染色Fig 2 Immunofluorescent staining of enterovirus 71 (EV71) antigen in HBMECs HBMECs: Human brain microvascular endothelial cells. HBMECs infected with EV71 at multiplicity of infection (MOI)=5 for 16 h. Immunofluorescent staining using rabbit anti-EV71-polyclonal antibody (anti-VP1) confirmed the presence of EV71 antigen (red fluorescence) in EV71-infected HBMECs,but not in mock infected cells. Original magnification: ×200 |
在透射电镜下观察,EV71感染的细胞内能看到直径30 nm左右的球形颗粒(图3A),形态大小与文献[ 11 ]报道的EV71一致,而对照组细胞中未见类似颗粒(图3B),进一步说明EV71能感染HBMECs。
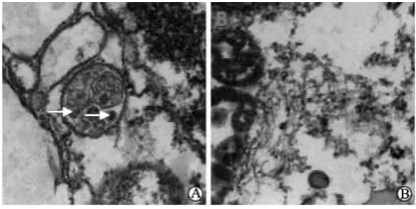 | 图 3 HBMECs内EV71病毒颗粒透射电镜观察Fig 3 Transmission electron microscopy images of enterovirus 71 (EV71) particles in HBMECsHBMECs: Human brain microvascular endothelial cells. A: EV71 group showing multiple EV71 (arrows) contained in the HBMECs; B: Control group showing normal HBMECs. Uranylacetate staining. Original magnification: ×20 000 |
为了探讨EV71在HBMECs的感染复制情况,采用含有226 bp EV71的pMD18-EV71质粒构建了标准方程:y=-3.314log(x) + 43.93, R=0.997,并根据标准曲线得到EV71病毒拷贝数。从病毒复制的曲线图来看,起始HBMECs复制的EV71拷贝数在第2天呈下降趋势,第3天升高,第4天达到顶峰,然后逐渐下降。而空白对照孔内EV71拷贝数不断下降,至第3天已降至0。时间对于病毒的复制有明显影响 (P<0.01),而两组间EV71拷贝数的差异也具有统计学意义(P<0.01)。
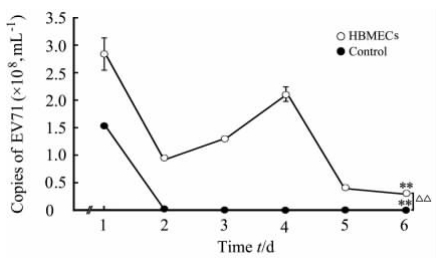 | 图 4 EV71在HBMECs内拷贝数的变化Fig 4 Kinetics of enterovirus 71 (EV71) replication in HBMECsHBMECs: Human brain microvascular endothelial cells. **P<0.01 among different time points in the same group; △△P<0.01 vs control group (ANOVA for the repeated measures). n=3, ±s |
在本实验中,用荧光标记的鬼笔环肽染色可以清晰地显示细胞中微丝的分布。与对照组(图5A) 相比,EV71感染HBMECs组细胞失去正常形态,变得极不规则,胞内微丝排列紊乱,极性消失,微丝聚集在细胞边缘(图5B)。
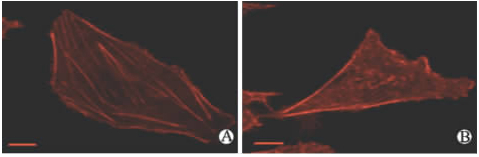 | 图 5 激光共聚焦观察HBMECs肌动蛋白(罗丹明-鬼笔环肽标记)Fig 5 Actin filament rearrangement in HBMECs as visualized by confocal fluorescent microscopy with Rhodamine-phalloidine stainingHBMECs: Human brain microvascular endothelial cells. A: Control group,the actin filaments were evenly distributed throughout the internal compartment of the cytoplasm; B: HBMECs infected with enterovirus 71 (EV71) at multiplicity of infection (MOI)=5 for 24 h,the actin filaments in the cytoplasm were obviously reduced; denser actin aggregates are found in the margin of the cells; and a long protrusion of actin filament staining can often be found in HBMECs. Scale bar=10 μm |
近年来,世界各地频繁报道EV71感染的爆发[ 12,13 ]。2008 年中国内地发生了亚太地区有史以来规模最大的以EV71 为优势毒株的手足口病大流行,且众多城市爆发了以EV71为优势毒株的手足口病流行[ 14,15 ]。迄今尚无有效的疫苗及治疗方法消除这种感染性疾病,主要原因是其致病机制尚不清楚。EV71病毒主要是通过口腔进入消化道,病毒首先在咽和肠道淋巴组织进行繁殖扩增,然后通过形成病毒血症进行扩散,进一步在网状内皮细胞中扩增并最终侵犯脑膜、脊髓和皮肤等靶器官。然而,EV71如何从起始复制位点(肠道)进入到CNS还不是很清楚。已知EV71可通过外周神经沿逆轴突方式感染CNS或通过血运途径穿BBB感染CNS[ 16,17 ],那么EV71究竟以何种方式穿BBB是我们想探讨的问题。
众所周知,BBB是一个以脑微血管内皮细胞、星形胶质细胞和周细胞共同构成的结构和功能的屏障,其中内皮细胞是构成BBB的关键解剖位点。所以在本实验中,采用HBMECs建立体外BBB模型,形态学观察证实EV71可以致HBMECs发生细胞病变,随着时间延长,病变更明显;通过免疫荧光和透射电镜方法证实EV71能感染HBMECs;通过检测HBMECs分泌的EV71拷贝数,证实EV71不仅能感染HBMECs而且能在HBMECs内复制,EV71在HBMECs内的复制在第4天达到高峰期。鉴于病毒感染过程的第一步是病毒通过与位于细胞表面的特异性受体结合而吸附于被感染细胞表面,然后利用细胞的内吞作用进入细胞或将病毒的核酸释放进细胞,可以推测,HBMECs是EV71的易感细胞,HBMECs上可能存在EV71的相关受体,EV71可能通过与HBMECs上的EV71特异性受体结合导致HBMECs的功能与结构改变,也即通过影响BBB功能与结构而进入CNS,其相关机制还值得进一步研究。
近年来,病毒与细胞骨架的关系这一问题正逐渐引起人们的注意。已经证明宿主细胞的骨架系统在多种RNA和DNA病毒的复制过程中起着重要的、有的甚至是不可或缺的作用[ 18,19 ]。细胞骨架包括微管、微丝和中间纤维,由它们共同组成细胞的支架成为细胞运动、细胞形态和跨膜信息传递的结构基础。微丝,亦称为纤维形肌动蛋白 (F-actin),是由球形肌动蛋白(G-actin) 单体分子形成的多聚体,两者之间的动态平衡在一定程度上维持肌动蛋白功能。许多病毒的侵袭、复制等过程均与宿主肌动蛋白骨架体系有关,研究证实人类副流感病毒3附着在胞质肌动蛋白纤维上进行转录和复制[ 20 ]。有文献推断成熟病毒附着于宿主细胞的微丝束网络上,随着细胞的病变,细胞质向中心收缩,不伴随其收缩的微丝束留在细胞外,附着于其上的大量病毒即被高效率地释放出来[ 21 ]。罗丹明标记的鬼笔环肽(phalloidin,Rhodamin conjugated)是用罗丹明衍生物标记的F肌动蛋白特异性荧光探针,可用于细胞形状、细胞骨架的分析。本实验采用罗丹明标记的鬼笔环肽检测了EV71感染组与对照组中的F肌动蛋白表达情况。EV71感染HBMECs组与对照组相比,部分细胞失去正常形态,变得极不规则,胞内微丝排列紊乱,极性消失,微丝聚集在细胞边缘。说明EV71 在HBMECs细胞中复制时,可导致部分细胞微管微丝分解,细胞骨架受损,提示病毒有可能参与微丝聚合与解聚这一动态平衡过程,而微丝骨架的改变也可能对于病毒的复制和活化起到一定的辅助作用,但其具体分子机制与相关信号通路还有待于进一步证实。
总之,本研究结果首次证明EV71可以感染HBMECs并导致部分HBMECs的骨架重排,HBMECs上可能存在EV71的特异性受体,入血EV71病毒可能随血运到达BBB时与BBB上内皮细胞特异性受体结合,导致其结构破坏、功能受损,从而进入颅内感染CNS,其机制还有待于进一步深入研究。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Yang Y, Wang H, Gong E, Du J, Zhao X, McNutt M A, et al.Neuropathology in 2 cases of fatal enterovirus type 71 infection from a recent epidemic in the People's Republic of China:a histopathologic, immunohistochemical, and reverse transcription polymerase chain reaction study[J].Hum Pathol, 2009, 40:1288-1295. |
| [2] | Wang S M, Lei H Y, Huang K J, Wu J M, Wang J R, Yu C K, et al.Pathogenesis of enterovirus 71 brainstem encephalitis in pediatric patients:roles of cytokines and cellular immune activation in patients with pulmonary edema[J].J Infect Dis, 2003, 188:564-570. |
| [3] | Ryu W S, Kang B, Hong J, Hwang S, Kim A, Kim J, et al.Enterovirus 71 infection with central nervous system involvement, South Korea[J].Emerg Infect Dis, 2010, 16:1764-1766. |
| [4] | Nolan M A, Craig M E, Lahra M M, Rawlinson W D, Prager P C, Williams G D, et al.Survival after pulmonary edema due to enterovirus 71 encephalitis[J].Neurology, 2003, 60:1651-1656. |
| [5] | Crotty S, Hix L, Sigal L J, Andino R.Poliovirus pathogenesis in a new poliovirus receptor transgenic mouse model:age-dependent paralysis and a mucosal route of infection[J].J Gen Virol, 2002, 83(Pt 7):1707-1720. |
| [6] | Ohka S, Matsuda N, Tohyama K, Oda T, Morikawa M, Kuge S, et al.Receptor (CD155)-dependent endocytosis of poliovirus and retrograde axonal transport of the endosome[J].J Virol, 2004, 78:7186-7198. |
| [7] | Wong K T, Munisamy B, Ong K C, Kojima H, Noriyo N, Chua K B, et al.The distribution of inflammation and virus in human enterovirus 71 encephalomyelitis suggests possible viral spread by neural pathways[J].J Neuropathol Exp Neurol, 2008, 67:162-169. |
| [8] | Vuorinen T, Vainionpää R, Vanharanta R, Hyypiä T.Susceptibility of human bone marrow cells and hematopoietic cell lines to coxsackievirus B3 infection[J].J Virol, 1996, 70:9018-9023. |
| [9] | Haddad A, Nokhbeh M R, Alexander D A, Dawe S J, Grisé C, Gulzar N, et al.Binding to decay-accelerating factor is not required for infection of human leukocyte cell lines by enterovirus 70[J].J Virol, 2004, 78:2674-2681. |
| [10] | 朵建英, 王 卫, 丛 喆, 刘 强, 魏 强.SYBR Green Ⅰ实时荧光定量RT-PCR 测定肠道病毒71 型(EV71)RNA 拷贝数方法的建立[J].中国比较医学杂志, 2010, 7:27-31. |
| [11] | 蒋 维.肠道病毒71型病毒样颗粒的制备、纯化与鉴定[D].北京:北京工业大学, 2010. |
| [12] | Solomon T, Lewthwaite P, Perera D, Cardosa M J, McMinn P, Coi M H.Virology, epidemiology, pathogenesis, and control of enterovirus 71[J].Lancet Infect Dis, 2010, 10:778-790. |
| [13] | Huang S W, Hsu Y W, Smith D J, Kiang D, Tsai H P, Lin K H, et al.Reemergence of enterovirus 71 in 2008 in Taiwan:dynamics of genetic and antigenic evolution from 1998 to 2008[J].J Clin Microbiol, 2009, 47:3653-3662. |
| [14] | 万俊峰, 朱理业, 刘 红, 曹明华, 丁振涛, 见海晖.阜阳市手足口病(EV71感染)疫情流行病学分析[J ].安徽医学, 2008, 29:344-345. |
| [15] | 何清懿, 陈伟华, 朱维明, 段良松, 陈白鹭, 刘爱平, 等.郴州市2010 年手足口病流行病学特征及病原学监测分析[J].中国现代医学杂志, 2012, 22:83-87. |
| [16] | Chen C S, Yao Y C, Lin S C, Lee Y P, Wang Y F, Wang J R, et al.Retrograde axonal transport:a major transmission route of enterovirus 71 in mice[J].J Virol, 2007, 81:8996-9003. |
| [17] | Wang Y F, Chou C T, Lei H Y, Liu C C, Wang S M, Yan J J, et al.A mouse-adapted enterovirus 71 strain causes neurological disease in mice after oral infection[J].J Virol, 2004, 78:7916-7924. |
| [18] | Irwin C R, Favis N A, Agopsowicz K C, Hitt M M, Evans D H.Myxoma virus oncolytic efficiency can be enhanced through chemical or genetic disruption of the actin cytoskeleton[J].PLoS One, 2013, 8:e84134. |
| [19] | Radtke K, Dhner K, Sodeik B.Viral interactions with the cytoskeleton:a hitchhiker's guide to the cell[J].Cell Microbiol, 2006, 8:387-400. |
| [20] | Gupta S, De B P, Drazba J A, Banerjee A K.Involvement of actin microfilaments in the replication of human parainfluenza virus type 3[J].J Virol, 1998, 72:2655-2662. |
| [21] | Martinez M G, Cordo S M, Candurra N A.Involvement of cytoskeleton in Junin virus entry[J].Virus Res, 2008, 138:17-25. |
 2014, Vol. 35
2014, Vol. 35


