2. 兰州大学第二医院小儿心血管科, 兰州 730030
2. Department of Pediatric Cardiovascular Diseases, Second Hospital of Lanzhou University, Lanzhou 730030, Gansu, China
川崎病(Kawasaki disease,KD)是一种相对常见且具有潜在生命威胁的小儿急性自限性全身血管炎性疾病,多发生于6个月至5岁的婴幼儿,男性较女性多发[ 1 ],其病因尚不明确。研究发现,KD急性期存在明显的免疫失调,在免疫活化过程中,凝血系统被激活,血小板数量增加、活性增强,形成炎症-凝血反应网络,血管内皮细胞受损和活化,出现广泛的血管炎,进而形成冠状动脉狭窄及栓塞等并发症[ 2 ]。
调控巨核细胞及血小板生成的因素众多,其中最受关注的是血小板生成素 (thrombopoietin,TPO),被认为是促进血小板生成最基本的细胞因子 。而血小板反应蛋白1(thrombospondin-1,TSP-1)可以抑制巨核细胞生长,减弱TPO对巨核细胞的促进作用[ 3 ]。新近研究发现,KD患儿急性期TSP-1水平明显升高,提示其可能参与KD急性期全身炎症反应的病理过程[ 4 ]。本研究拟通过检测KD患儿急性期、亚急性期和恢复期血清TSP-1的动态变化及其与血小板数量及活化程度的关系,了解TSP-1在KD患儿血小板变化中的意义。
1 对象和方法 1.1 研究对象(1)KD患儿: 收集2011年9月1日至2012年12月31日兰州大学第二医院小儿心血管科收治并确诊为KD的住院患儿32例,均符合世界小儿川崎病研讨会修订的诊断标准[ 5 ],男21例,女11例,年龄2个月至7岁,平均年龄为 (28.5±21.0)个月,中位年龄为22个月,其中7例患儿≤1岁,12例1~2岁,4例2~3岁,2例3~4岁,4例4~5岁,2例5~6岁,1例7岁。患儿在诊断为KD后于急性期静脉给予丙种球蛋白(丙球)1 g/kg或2 g/kg治疗,如果疗效不佳再静脉给予丙球1 g/kg或2 g/kg一次,同时给予阿司匹林30~50 mg/(kg·d),待患儿发热消退3 d后减量至5~10 mg/(kg·d),2周左右减量至3~5 mg/(kg·d)。KD患儿病程因病情轻重长短不一,急性期、亚急性期及恢复期的划分采用《诸福棠实用儿科学》中的标准[ 6 ]。(2)对照组患儿: 30例同期收住兰州大学第二医院小儿外科住院治疗的择期腹股沟疝患儿被纳入对照组。30例患儿中,男20例,女10例,年龄3~90个月,平均年龄为(28.8±21.1)个月,中位年龄为20个月,其中6例患儿≤1岁,12例1~2岁,3例2~3岁,3例3~4岁,3例4~5岁,2例5~6岁,1例90个月。KD患儿与对照组患儿性别、年龄差异无统计学意义。
1.2 样本采集及指标检测分别采集KD患儿急性期、亚急性期、恢复期及对照组患儿静脉血4 mL,要求无菌、无溶血,2 mL置于无抗凝剂真空采血管,室温静置60 min,2 000 r/min(离心半径为18 cm)离心10 min分离血清,置于1.5 mL离心管,冻存于-80℃冰箱待检。采用人TSP-1 ELISA试剂盒(上海科兴生物科技有限公司)及BioTek ELx800酶标仪检测血清TSP-1在450 nm处的光密度(D)值,绘制标准曲线后得出TSP-1浓度,操作过程严格按照产品使用说明书进行。余2 mL静脉血置于含有乙二胺四乙酸(EDTA)抗凝剂的真空采血管中,采用Sysmex XE-5000自动血细胞分析仪进行检测,获取血小板计数及血小板相关参数如血小板平均体积(mean platelet volume,MPV)、血小板容积(plateletcrit,PCT)、血小板分布宽度(platelet distribution width,PDW)、大血小板比率(platlet-large-cell ratio,PLCR)等指标。
1.3 统计学处理应用SPSS 19.0统计软件对数据进行分析,数据以 ±s表示,急性期组、亚急性期组及恢复期组KD患儿与对照组患儿的比较分别采用两独立样本t检验,急性期组、亚急性期组及恢复期组之间的比较采用重复设计资料的方差分析,血清TSP-1与PLT的相关性采用Pearson线性相关分析。检验水准(α)为0.05。
2 结 果 2.1 不同分期KD患儿与对照组患儿血清TSP-1、血小板计数及相关参数的比较
纳入的KD患儿在急性期均于兰州大学第二医院小儿心血管科住院治疗,其中1例患儿恢复期未到院进行随访,1例患儿亚急性期及恢复期未到院进行随访,未获得相关数据。由表1可见,急性期KD患儿与对照组患儿相比各项指标均出现明显变化,表现为血清TSP-1明显升高,血小板数量增多,活化程度增强; 亚急性期血清TSP-1浓度与对照组相比仍处于较高水平,血小板数量增多明显,血小板活化程度较急性期有所降低; 恢复期血清TSP-1及血小板活化程度与对照组比较差异无统计学意义,但血小板计数仍然处于较高水平。
| 表 1 KD患儿与对照组患儿TSP-1、血小板计数及血小板相关参数比较结果 |
为了解不同分期KD患儿血清TSP-1的动态变化,将1例恢复期失访的患儿和1例亚急性期及恢复期失访的患儿数据剔除,采用重复设计资料的方差分析比较资料完整的30例患儿急性期、亚急性期及恢复期之间的TSP-1水平差异,结果如图1所示。可见随着病情变化,TSP-1浓度逐渐降低(F=65.19,P=0.000 1),各期之间两两比较差异均具有统计学意义(P<0.01)。
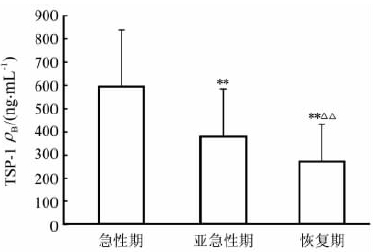 | 图 1 KD患儿急性期、亚急性期 及恢复期血清TSP-1的动态变化 KD: 川崎病; TSP-1: 血小板反应蛋白1.重复设计资料的方差分析,F=65.19,P=0.000 1. **P<0.01与急性期比较; △△P<0.01与亚急性期比较. n=30, ±s |
Pearson线性相关分析发现,急性期、亚急性期及恢复期KD患儿血清TSP-1浓度与血小板计数间均不存在相关关系(表2)。
| 表 2 KD患儿血清TSP-1与血小板计数相关性分析结果 |
血小板的生成受到多种因素的调控,调控位点既可以发生在转录起始位点处,也可发生于蛋白质的修饰阶段。GATA-1、FOG及NF-E2的作用位点位于转录起始处[ 7 ]; TPO、IL-3、GM-CSF、MK-CSF促进祖细胞到不成熟巨核细胞的生长、增殖和分化,IL-6、TPO主要促进不成熟巨核细胞转化为成熟巨核细胞; 而TGF-β1、TSP-l、IL-4、β-TG、PF4等则抑制血小板生成[ 8 ]。KD患儿异常免疫发生过程中,抗原抗体特异性结合,通过细胞内信号转导和特殊基因表达,启动细胞因子的瀑布效应,造成血管内皮损伤、胶原暴露,血小板聚集、活化、功能亢进,进而被大量消耗,从而刺激骨髓产生和释放更大体积的血小板[ 3 ]。本研究中KD患儿急性期出现 血小板计数升高、MPV变大、PDW增大、PLCR升高表现,预示着血小板的活化。随着免疫功能的恢复,炎症消退,新生血小板减少,衰老血小板降解,血小板大小逐渐均一化,PDW降低,MPV变小,PLCR降低,在病情缓解的过程中,血小板活化程度逐渐降低,与相关研究 [ 9 ] 一致。
TSP-1由Baenziger等[ 10 ]首次从凝血酶刺激后的血小板细胞膜中分离,分布于血小板α颗粒及多种组织的细胞外基质中,通过与受体结合,桥接细胞与生长因子、细胞与细胞、细胞与胞外基质而发挥作用。张战军[ 11 ]研究发现特发性血小板减少性紫癜(idiopathic thrombocytopenic purpura,ITP)患儿外周血TSP-1含量较正常对照组高,认为是由ITP发展过程中血小板破坏增多,使过多的TSP-1α颗粒蛋白由破坏的血小板释放所致; 治疗后TSP-1恢复正常,说明血小板破坏减少,α颗粒内容物释放减少。本研究发现KD患儿急性期血小板数量增加、活性增强,TSP-1浓度明显升高,这表明KD患儿急性期可能也存在与ITP患儿类似的血小板内容物释放增多表现: 急性期KD患儿炎症反应明显,血小板活化程度最高,释放其内容物明显增多,TSP-1作为血小板α颗粒内容物随之增多,其血清浓度明显升高。 静脉给予丙球治疗后,异常炎症反应改善,血小板总体活化程度较急性期降低但仍高,释放TSP-1仍较多。进入恢复期,继发性增多的血小板衰老、活性降低并被降解,释放TSP-1进一步减少,直到恢复正常。因此我们认为,KD患儿病程中血清TSP-1浓度与血小板活化程度变化趋势一致,可以作为评估血小板活化程度的一个指标,但有待与经典血小板活化指标如CD62p等进行比较。
有研究认为TSP-1可以抑制巨核细胞生长,减弱TPO对巨核细胞的促进作用[ 3,12 ]。TSP-1对巨核细胞生长的抑制效应包括两个方面: 一是通过它在巨核细胞表达的受体起直接抑制作用; 二是通过调节TPO与巨核祖细胞结合,发挥间接抑制作用[ 13 ]。研究发现,与正常对照儿童相比,ITP患儿骨髓中TSP-1含量明显升高,而血小板明显减少,其原因可能为过量的TSP-1抑制了巨核细胞的生长及成熟 [ 13, 14 ]。本研究统计分析显示血清TSP-1浓度与血小板数量未表现负相关关系,可能原因包括: 外周血血小板数量受到正向及负向调控因子的双重调控,TSP-1只是众多负向调控因子中的一种,血小板活化过程中释放的其他物质,如PF4、TNF-α等对巨核细胞也可能发挥抑制作用; KD患儿病程中TSP-1对巨核细胞生成抑制作用强度如何,本研究尚不能判断,有待与PF4、β-TG等进行比较; KD病程中血小板新生及活化降解过程均明显,在数量出现动态变化的过程中,血小板功能也呈现动态变化,释放的内容物具有多种生物学功能,使得血小板数量变化更加复杂,不能用单一原因解释; 血清TSP-1来源于血小板α颗粒,与血小板活化程度有关,血小板活化时其释放增多。
综上,KD患儿TSP-1在病程中呈现动态变化,急性期TSP-1水平明显升高,亚急性期明显降低,恢复期进一步降低至正常水平,与血小板活化程度相一致。在KD病程中TSP-1对巨核细胞生成的抑制作用有待进一步研究。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Lin M C, Fu Y C, Jan S L, Lai M S.Comparative effectiveness of intravenous immunoglobulin for children with Kawasaki disease: a nationwide cohort study[J].PLoS One, 2013, 8:e63399. |
| [2] | Newburger J W, Takahashi M, Gerber M A, Gewitz M H, Tani L Y, Burns J C, et al.Diagnosis, treatment, and long-term management of Kawasaki disease: a statement for health professionals from the Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease, Council on Cardiovascular Disease in the Young, American Heart Association[J].Pediatrics, 2004, 114:1708-1733. |
| [3] | Yang M, Li K, Ng M H, Yuen P M, Fok T F, Li C K, et al.Thrombospondin-1 inhibits in vitro megakaryocytopoiesis via CD36[J].Thromb Res, 2003, 109:47-54. |
| [4] | 张超英, 李晓惠, 林 瑶, 张明明, 潘 燕.血小板反应蛋白在川崎病中的变化及意义[J].中华临床医师杂志(电子版), 2013, 7: 4528-4530. |
| [5] | Ayusawa M, Sonobe T, Uemura S, Ogawa S, Nakamura Y, Kiyosawa N, et al;Kawasaki disease research committee.Revision of diagnostic guidelines for Kawasaki disease (the 5th revised edition)[J].Pediatr Int, 2005, 47:232-234. |
| [6] | 胡亚美, 江载芳.诸福棠实用儿科学[M].7版.北京:人民卫生出版社, 2005:695-705. |
| [7] | Vyas P, Ault K, Jackson C W, Orkin S H, Shivdasani R A.Consequences of GATA-1 deficiency in megakaryocytes and platelets[J].Blood, 1999, 93:2867-2875. |
| [8] | 李晓静, 程源山, 杨 默.IL-1β与川崎病患儿血小板升高的关系[J].血栓与止血学, 2006, 12:265-267. |
| [9] | 龚 萍, 贺湘玲.川崎病患儿血小板参数的动态变化与冠状动脉病变的关系[J].中国医师杂志, 2011, 9:702-703. |
| [10] | Baenziger N L, Brodie G N, Majerus P W.A thrombin-sensitive protein of human platelet membranes[J].Proc Natl Acad Sci USA, 1971, 68:240-243. |
| [11] | 张战军.CD-47、TSP-1及细胞因子与儿童特发性血小板减少性紫癜关系的研究[D].济南:山东大学, 2009. |
| [12] | Chen Y Z, Incardona F, Legrand C, Momeux L, Caen J, Han Z C.Thrombospondin, a negative modulator of megakaryocytopoiesis[J].J Lab Clin Med, 1997, 129:231-238. |
| [13] | Ozcebe O I, Karakus S, Haznedaroğlu I C, GÖker H, Kosar A, Kocoğlu H, et al.Plasma thrombospondin in immune thrombocytopenic purpura[J].J Int Med Res, 2002, 30:52-55. |
| [14] | 白松婷, 袁志喜, 赵晓明, 邹 湘, 盛光耀.TPO、TSP-l和TGF-β1在特发性血小板减少性紫癜患儿骨髓表达的改变及其意义[J].中国小儿血液与肿瘤杂志, 2001, 11:198-200. |
 2014, Vol. 35
2014, Vol. 35


