2. 郑州大学基础医学院寄生虫学教研室, 郑州 450052
2. Department of Parasitology, College of Basic Medical Sciences, Zhengzhou University, Zhengzhou 450052, Henan, China
DNA聚合酶polβ是Weissbach等[ 1 ]1971年在牛胸腺细胞中发现的单肽链小分子蛋白,广泛存在于哺乳动物细胞核内。polβ相对分子质量为39 000,是目前已知的DNA聚合酶中最小的,也是哺乳动物体内复制保真度最低、最不精确的一种DNA聚合酶,它在细胞内的稳定表达对于DNA的正常复制与修复及细胞的正常分化有着重要作用[ 2,3,4 ]。顺铂(cisplatin,cDDP)为一广谱、高效抗癌药,是目前最重要的临床抗癌药物之一。 我国是食管癌的高发地区,尤其是河南省林州市(原河南省林县)及其毗邻的辉县等地。 食管鳞癌对顺铂耐药是化疗失败的重要因素之一,其发生机制仍不清楚。我们前期进行的耐药基因筛查研究显示在人食管鳞癌顺铂耐药细胞系EC9706/cDDP中polβ的表达水平明显高于亲本细胞EC9706,提示polβ很可能在EC9706/cDDP细胞顺铂耐药的形成中起一定作用[ 5,6 ]。为进一步研究polβ在顺铂耐药中的作用并探索有效的逆转方法,本研究拟构建靶向polβ基因的siRNA重组慢病毒,观察polβ基因沉默后EC9706/cDDP细胞对顺铂敏感性的改变,明确polβ的沉默是否会在一定程度上逆转其耐药性。
1 材料和方法 1.1 实验材料
高分化人食管鳞癌顺铂耐药细胞系EC9706/cDDP由本课题组构建[ 6 ]。慢病毒包装细胞293FT和大肠杆菌DH5α、pRNAT-U6.2/Lenti siRNA表达载体为本室保存。 Opti-MEM®Ⅰ培养基购自美国Gibco公司。限制性内切酶BamHⅠ、PstⅠ购自Promega公司。ViraPowerTMPackaging Mix(经优化的包含3种包装质粒的混合物)、转染试剂LipofectamineTM购自美国Invitrogen公司。胶回收试剂盒及小量质粒提取试剂盒购自Axygen公司。兔抗人polβ抗体、羊抗兔多克隆抗体及TRITC标记的羊抗兔抗体购自北京中山生物技术有限公司。编码发卡样siRNA的DNA单链模板序列及相关引物均由生工生物工程(上海)股份有限公司合成。
1.2 靶向polβ基因的siRNA慢病毒的构建 1.2.1siRNA 靶点设计与合成参照polβ mRNA序列(GenBank: M13140),用Ambion siRNA 靶序列分析设计系统根据siRNA设计原则设计siRNA 靶点。针对靶基因序列设计多个 RNA 干扰靶点序列,最终确定2个长为19 bp的靶序列: 5′-CGT GAG CCA AGC TAT CCA C-3′(197~215位点)、 5′-CTG TTA CAT CAG GTT GTG G-3′(741~759位点),设计分别针对这2个靶序列的2对编码短发夹RNA的DNA单链模板(第一对命名为pol11、pol12,第二对命名为pol21、pol22),同时随机组合出一条无关对照序列 5′-GTC AAT GGT CGT GTA GAG T-3′,针对该序列的编码短发夹RNA的DNA单链模板命名为polc1、polc2。合成的成对引物干粉溶于退火缓冲液,90℃水浴 15 min,自然冷却。
1.2.2 siRNA慢病毒表达载体克隆制备与鉴定(1)寡核苷酸的退火、纯化: 用缓冲液溶解DNA单链片段。退火体系: 正、反义模板链各2 μL (1 μg/μL),1×退火buffer 46 μL。退火反应条件: 95℃ 5 min,70℃ 10 min,缓慢降至30℃,维持30 min,缓慢降至4℃。-20℃保存。将退火后产物用2.0%低熔点琼脂糖凝胶电泳回收纯化,纯化具体步骤参照AXYGEN胶回收纯化试剂盒操作规程。(2)连接与转化: 用BamHⅠ/PstⅠ双酶切载体,酶切产物电泳,胶回收纯化开环pRNAT-U6.2/Lenti载体。Polβ siRNA模板寡核苷酸胶回收产物3 μL,开环pRNAT-U6.2/Lenti载体1 μL,T4 DNA连接酶 1 μL,4℃过夜。将重组慢病毒载体转化到DH5α感受态细菌中,取菌液50 μL涂于Amp+LB平板,37℃过夜。(3)阳性克隆的 PCR 鉴定及测序: 随机挑取若干菌落,扩增后煮沸裂解法提取细菌DNA,用pRNAT-U6.2/Lenti的插入鉴定通用引物PCR扩增、电泳,鉴定出阳性重组克隆,之后转平板培养2次,上法鉴定仍阳性者,送生工生物工程(上海)股份有限公司测序进一步鉴定,鉴定正确的3种siRNA慢病毒表达载体分别命名为pRNAT-U6.2/Lenti-polβ1、pRNAT-U6.2/Lenti-polβ2、pRNAT-U6.2/Lenti-polβC。
1.2.3 产生siRNA的慢病毒包装将9 μg ViraPowerTM Packaging Mix和3 μg pRNAT-U6.2/Lenti-polβ1(pRNAT-U6.2/Lenti-polβ2或pRNAT-U6.2/Lenti-polβC)表达质粒DNA(共12 μg)溶于1.5 mL Opti-MEM®Ⅰ无血清培养液中,轻轻混匀,制得溶液A。将36 μL LipofectamineTM 2000用1.5 mL Opti-MEM®Ⅰ无血清培养液稀释,轻轻混匀,室温孵育5 min,制得溶液B。将稀释好的溶液A和B混合,轻轻混匀。室温孵育20 min,使DNA-脂质体复合物形成。胰酶消化并计数293FT细胞,制备细胞密度为1.2×106/mL的细胞悬液。将DNA-脂质体复合物加至含5 mL Opti-MEM®Ⅰ含血清培养液的10 cm组织培养皿(不含抗生素),再加入5 mL 制备好的293FT细胞悬浮液(共6×106细胞),轻轻混匀,置CO2培养箱37℃孵育过夜。移去含DNA-脂质体复合物的培养液,换含1 mol/L丙酮酸钠的完全培养液。转染48~72 h后将含病毒上清液移至15 mL无菌锥形管。4℃ 100 000×g离心5 min,除去细胞碎片。210 000×g离心90 min,弃上清,450 μL PBS重悬。吸取病毒悬浮液至冷冻管分装,-80℃保存。
1.2.4 病毒效价测定将293FT细胞按2×105 细胞/孔接种于6孔板中,待24 h后感染病毒。取病毒原液作不同比例稀释( 1:103~1:1010) ,每一浓度设3个复孔。按每孔400 μL加病毒稀释液至细胞培养板中,37℃培养4~6 h。换新鲜培养液,继续培养24 h,荧光显微镜下计数GFP阳性细胞数。按下述公式分别计算重组慢病毒的滴度: 病毒滴度(CTU/mL)=GFP细胞阳性数×病毒上清稀释倍数/病毒感染液体积。
1.3 病毒感染EC9706/cDDP细胞用胰蛋白酶消化EC9706/cDDP细胞,以2.5×105细胞/孔的密度接种于6孔板上,用含10%胎牛血清的RPMI 1640培养液培养。接种24 h后,按细胞与病毒1:10的比例加入病毒稀释液,感染细胞48 h。
1.4 polβ表达的检测 1.4.1 半定量RT-PCR检测分别用相关基因引物进行PCR扩增,以β-actin作参照。PCR扩增反应体系(30 μL): dH2O 20.45 μL,10×Buffer 3.0 μL,Taq酶0.15 μL,dNTP 2.4 μL,上、下游引物各1.0 μL,模板(反转录产物)2.0 μL。PCR扩增程序: 94℃ 5 min预变性;94℃变性45 s,55℃退火45 s,72℃延伸 60 s,35个循环;72℃终末延伸5 min。
1.4.2 蛋白质印迹检测
收集转染前后的细胞,裂解后收集上清,参照 BCA 蛋白浓度测定试剂盒说明书对蛋白质进行定量。每孔上样50 μg蛋白样品进行 SDS-PAGE,电泳后利用电转移法将凝胶中的蛋白质转移到 PVDF 膜上。将PVDF膜放入杂交袋中,用含5%脱脂奶粉的TBS封闭,4℃过夜。将封闭后的PVDF膜置于另一干净杂交袋中,加入用封闭液稀释的一抗兔抗人polβ(1:200)中,室温摇床振荡1 h或4℃过夜,取出漂洗;再加用封闭液稀释的二抗羊抗兔多克隆抗体(1:1 500)中,室温摇床振荡1 h,取出进行漂洗、显色、定影、保存。
1.4.3 免疫荧光实验将细胞用PBS冲洗3次,4%多聚甲醛固定30 min后,用0.3%Triton X-100打孔。20%正常山羊血清封闭20 min,加一抗(兔抗人polβ多抗)4℃孵育过夜,PBS冲洗3次后加二抗(TRITC标记的羊抗兔抗体)。暗环境37℃孵育2 h,PBS冲洗3次,蒸馏水冲洗5 min。水溶性封片剂封片。
1.5 细胞对顺铂敏感性的检测采用MTT法检测细胞对顺铂的敏感性。取对数生长期细胞以3×104细胞/mL密度接种于96孔培养板,每孔200 μL。24 h后更换含不同终浓度顺铂的培养液,每一浓度设3个复孔,并设不含药空白对照组,48 h后每孔加入5 mg/mL的MTT 20 μL,继续培养4 h后,每孔加入二甲亚砜(DMSO) 200 μL,充分混匀,上酶标仪在波长550 nm处测定各孔光密度值(D)。顺铂对细胞的相对抑制率用公式计算: 相对抑制率(%)= (1-加药孔D值/对照孔D值)×100%;50%细胞生长抑制所需的药物浓度(IC50)用IC50计算器软件计算;耐药指数(RI)用公式计算: RI=耐药细胞IC50/亲本细胞IC50。
1.6 统计学处理采用SPSS 17.0统计软件对数据进行分析。实验数据以 ±s表示,多样本均数间的比较采用方差分析,检验水准(α)为 0. 05。
2 结 果 2.1 靶向polβ基因的siRNA慢病毒构建成功将重组慢病毒载体转化DH5α,在Amp+ LB平板上经氨苄青霉素初筛,挑取菌落,用pRNAT-U6.2/Lenti插入通用鉴定引物对重组质粒进行PCR鉴定,电泳结果见图1。阳性者条带位于538 bp左右,阴性者条带位于480 bp左右。测序结果与我们设计合成的序列完全一致,说明本实验已把合成的双链DNA模板插入到了pRNAT-U6.2/Lenti中,成功构建了2个能靶向polβ基因的慢病毒载体pRNAT-U6.2/Lenti-polβ1、pRNAT-U6.2/Lenti-polβ2及阴性对照载体pRNAT-U6.2/Lenti-polβC。经测定pRNAT-U6.2/Lenti-polβ1、pRNAT-U6.2/Lenti-polβ2、pRNAT-U6.2/Lenti-polβC三种病毒的滴度分别为 2.1×107、2.0×107、2.3×107 CTU/mL。
 | 图 1 靶向polβ基因的siRNA慢病毒 表达载体的PCR鉴定结果 Fig 1 PCR identification of lentiviral vector of siRNA specific for polβ 1: Positive clone pRNAT-U6.2/Lenti-polβ1; 2: Positive clone pRNAT-U6.2/Lenti-polβ2; 3: Positive clone pRNAT-U6.2/Lenti-polβC; 4: Negative clone; M: DNA marker |
RT-PCR检测显示,未感染EC9706/cDDP细胞及分别感染pRNAT-U6.2/Lenti-polβC、pRNAT-U6.2/Lenti-polβ2、pRNAT-U6.2/Lenti-polβ1的EC9706/cDDP细胞内polβ mRNA的相对表达水平分别为0.62±0.03、0.67±0.08、0.28±0.05、0.09±0.02,表明感染pRNAT-U6.2/Lenti-polβ1、pRNAT-U6.2/Lenti-polβ2的细胞内polβ mRNA的表达明显低于未感染EC9706/cDDP及感染pRNAT-U6.2/Lenti-polβC的细胞(P<0.05,图2),与感染 pRNAT-U6.2/Lenti-polβC的细胞相比分别下调了90.2%和54.8%。蛋白质印迹结果显示,pRNAT-U6.2/Lenti-polβ1、pRNAT-U6.2/Lenti-polβ2对polβ蛋白的表达均有抑制作用,其中前者效果显著(图3)。免疫荧光结果显示,pRNAT-U6.2/Lenti-polβ1感染EC9706/cDDP细胞后在荧光显微镜下发红色荧光的细胞数目少且荧光较弱(图4),表明pRNAT-U6.2/Lenti-polβ1可有效抑制细胞内polβ的表达。
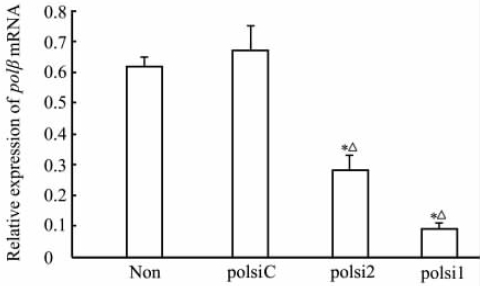 | 图 2 RT-PCR检测polβ mRNA在不同慢病毒 感染EC9706/cDDP细胞内的表达水平 Fig 2 Expression of polβ mRNA in EC9706/cDDP cells infected by different lentiviruses by RT-PCR Non: Non-infected; polsiC: pRNAT-U6.2/Lenti-polβC; polsi2: pRNAT-U6.2/Lenti-polβ2; polsi1: pRNAT-U6.2/Lenti-polβ1; cDDP: Cisplatin. *P<0.05 vs non group; △P<0.05 vs polsiC group. n=3, ±s |
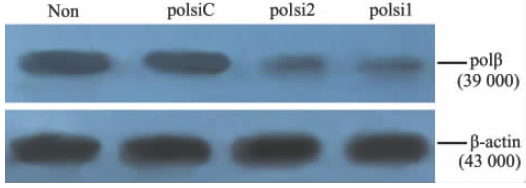 | 图 3 蛋白质印迹检测polβ蛋白在不同慢病毒 感染EC9706/cDDP细胞内的表达 Fig 3 Expression of polβ protein in EC9706/cDDP cells infected by different lentiviruses by Western blotting analysis Non: Non-infected; polsiC: pRNAT-U6.2/Lenti-polβC; polsi2: pRNAT-U6.2/Lenti-polβ2; polsi1: pRNAT-U6.2/Lenti-polβ1; cDDP: Cisplatin |
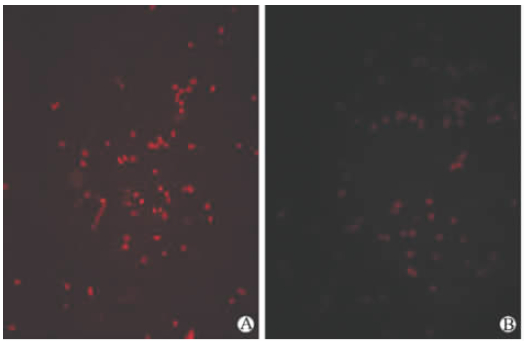 | 图 4 免疫荧光检测polβ蛋白在慢病毒感染 EC9706/cDDP细胞内的表达 Fig 4 Expression of polβ in EC9706/cDDP cells infected by lentiviruses by immunofluorescence assay A: Non-infected; B: pRNAT-U6.2/Lenti-polβ1. cDDP: Cisplatin |
经MTT法检测,一系列不同浓度顺铂处理细胞48 h后,顺铂以剂量依赖方式抑制EC9706/cDDP细胞增殖(图5)。亲本细胞EC9706对顺铂的IC50为4.02 μg/mL,感染pRNAT-U6.2/Lenti-polβ1、pRNAT-U6.2/Lenti- polβC的/cDDP细胞及未感染EC9706/cDDP细胞对顺铂的IC50分别为55.71、62.41、63.11 μg/mL,其耐药指数分别为13.9、15.5、15.7,其中前者与后二者相比差异有统计学意义(P<0.05),表明沉默polβ的表达可部分逆转EC9706/cDDP细胞对顺铂的耐药性。
 | 图 5 MTT法检测顺铂对慢病毒感染后 EC9706/cDDP细胞生长的抑制 Fig 5 Growth inhibition effect of cisplatin on EC9706/cDDP cells infected by lentivirus by MTT Non: Non-infected; polsiC: pRNAT-U6.2/Lenti-polβC; polsi2: pRNAT-U6.2/Lenti-polβ2; polsi1: pRNAT-U6.2/Lenti-polβ1; cDDP: Cisplatin |
研究肿瘤耐药的产生机制及其逆转策略对提高肿瘤的化疗效果、延长患者的生存期有着重要意义。DNA损伤修复是活细胞利用各种途径对其基因组出现的损伤产生的保护性反应,在很大程度上保证了遗传物质的稳定性以及复制、转录的忠实性和准确性,使生命活动正常进行。许多化疗药物通过各种机制引起肿瘤细胞内DNA损伤以抑制肿瘤细胞的增殖,如铂类化疗药的细胞毒作用与DNA损伤有关,若损伤DNA的修复加强,抗肿瘤药物就不能发挥作用,导致耐药性的产生。近年来DNA损伤修复过程中的polβ与肿瘤耐药的关系逐渐引起人们的注意,研究表明polβ的高表达与肿瘤细胞对顺铂等的耐药有关[ 7,8,9 ],有学者发现使用polβ抑制剂能够提高肿瘤细胞对顺铂的反应性[ 10 ]。使用DNA修复抑制剂提高肿瘤的治疗效果被认为具有重要应用前景[ 11 ]。我们前期研究也观察到了食管癌顺铂耐药性与polβ表达的关系[ 12 ],并发现抗凋亡因子HAX-1在增强polβ表达的同时也增强了食管癌细胞对顺铂的耐药性[ 13 ]。本研究旨在观察抑制polβ表达对食管癌细胞顺铂耐药性的影响。
以特异性shRNA介导的RNAi技术,为逆转肿瘤细胞多药耐药的治疗开创了新的思路[ 14,15,16,17 ]。Albertella等[ 18 ]转染靶向polβ的siRNA至SKOV3细胞和HeLa细胞系,发现转染siRNA后细胞系对顺铂的敏感性提高。韩丽萍等[ 19 ]观察到,转染靶向polβ的siRNA组的人卵巢癌HO-8910细胞的活细胞数明显少于正常细胞组和空载体对照组,随着顺铂浓度的增加差别越来越明显,呈浓度依赖性;polβ基因沉默后,人卵巢癌HO-8910细胞系对顺铂的敏感性增加。本研究用靶向polβ的siRNA重组慢病毒感染EC9706/cDDP后可下调polβ的mRNA及蛋白表达水平,对cDDP的耐药指数由15.7降为13.9,进一步证明polβ的表达与细胞的顺铂耐药性有关,同时表明利用RNAi技术可增强食管癌细胞对顺铂的敏感性。
本实验中虽然polβ基因的沉默可使EC9706/cDDP细胞耐药性降低,但其IC50未达到敏感细胞水平(4.02 μg/mL),原因可能是这个基因在EC9706/cDDP细胞的耐药性中仅起部分作用,除此之外,还有其他基因或机制的参与[ 5 ],故单纯封闭该基因以逆转耐药的作用有限。结合前期研究[ 5,6,7 ],我们认为EC9706/cDDP细胞对顺铂耐药性增强可能与细胞内polβ蛋白表达增加有关。Polβ表达增加可以导致DNA修复能力增强及产生跨损伤合成,从而对顺铂形成耐受。但是由于polβ具有错误倾向,易产生突变,本实验中这种增加表达的polβ极有可能产生了突变,有待进一步研究。阐明polβ在降低顺铂蓄积、修复顺铂-DNA加合物以及诱发细胞凋亡的分子生物学机制是我们下一步的工作方向。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Weissbach A, Schlabach A, Fridlender B, Bolden A.DNA polymerases from human cells[J].Nat New Biol, 1971, 231:167-170. |
| [2] | Burgers P M.Eukaryotic DNA polymerases in DNA replication and DNA repair[J].Chromosoma, 1998, 107:218-227. |
| [3] | Fortini P, Pascucci B, Parlanti E, Sobol R W, Wilson S H, Dogliotti E.Different DNA polymerases are involved in the short-and long-patch base excision repair in mammalian cells[J].Biochemistry, 1998, 37:3575-3580. |
| [4] | Matsuda T, Bebenek K, Masutani C, Hanaoka F, Kunkel T A.Low fidelity DNA synthesis by human DNA polymerase-eta[J].Nature, 2000, 404:1011-1013. |
| [5] | 李 敏, 王志举, 付 庆, 赵国强, 董子明.人食管癌顺铂耐药细胞系的建立及耐药相关基因的筛选[J].中国卫生检验杂志, 2007, 17:18-20. |
| [6] | 李 敏, 王志举, 李文涛, 董子明.人食管癌顺铂耐药细胞系EC9706/cDDP的建立及其生物学特征[J].世界华人消化杂志, 2006, 14:3257-3260. |
| [7] | 李 敏, 臧文巧, 付 庆, 李文涛, 董子明.Polβ高表达与食管癌细胞耐药的相关性[J].第四军医大学学报, 2007, 28:1065-1068. |
| [8] | Illuzzi J L, Wilson D M 3rd.Base excision repair:contribution to tumorigenesis and target in anticancer treatment paradigms[J].Curr Med Chem, 2012, 19:3922-3936. |
| [9] | Ali-Osman F, Berger M S, Rairkar A, Stein D E.Enhanced repair of a cisplatin-damaged reporter chloramphenicol-O-acetyltransferase gene and altered activities of DNA polymerases alpha and beta, and DNA ligase in cells of a human malignant glioma following in vivo cisplatin therapy[J].J Cell Biochem, 1994, 54:11-19. |
| [10] | Boudsocq F, Benaim P, Canitrot Y, Knibiehler M, Ausseil F, Capp J P, et al.Modulation of cellular response to cisplatin by a novel inhibitor of DNA polymerase beta[J].Mol Pharmacol, 2005, 67:1485-1492. |
| [11] | Barakat K, Gajewski M, Tuszynski J A.DNA repair inhibitors:the next major step to improve cancer therapy[J].Curr Top Med Chem, 2012, 12:1376-1390. |
| [12] | 崔华娟, 金 戈, 杨洪艳, 黄幼田, 郑智敏, 赵继敏, 等.人食管癌顺铂耐药细胞系DNA聚合酶β的表达[J].郑州大学学报(医学版), 2005, 40:17-19. |
| [13] | Sun S J, Feng L, Zhao G Q, Dong Z M.HAX-1 promotes the chemoresistance, invasion, and tumorigenicity of esophageal squamous carcinoma cells[J].Dig Dis Sci, 2012, 57:1838-1846. |
| [14] | Li H, Zhou S, Li T, Liu Z, Wu J, Zeng G, et al.Suppression of BCRP expression and restoration of sensitivity to chemotherapy in multidrug-resistant HCC cell line HEPG2/ADM by RNA interference[J].Hepatogastroenterology, 2012, 59:2238-2242. |
| [15] | Zhao L J, Xu H, Qu J W, Zhao W Z, Zhao Y B, Wang J H.Modulation of drug resistance in ovarian cancer cells by inhibition of protein kinase C-alpha (PKC-α) with small interference RNA (siRNA) agents[J].Asian Pac J Cancer Prev, 2012, 13:3631-3636. |
| [16] | Yin Q, Shen J, Chen L, Zhang Z, Gu W, Li Y.Overcoming multidrug resistance by co-delivery of Mdr-1 and survivin-targeting RNA with reduction-responsible cationic poly(β-amino esters)[J].Biomaterials, 2012, 33:6495-6506. |
| [17] | Maddalena F, Laudiero G, Piscazzi A, Secondo A, Scorziello A, Lombardi V, et al.Sorcin induces a drug-resistant phenotype in human colorectal cancer by modulating Ca2+ homeostasis[J].Cancer Res, 2011, 71:7659-7669. |
| [18] | Albertella M R, Lau A, O'Connor M J.The overexpression of specialized DNA polymerases in cancer[J].DNA Repair(Amst), 2005, 4:583-593. |
| [19] | 韩丽萍, 刘娟芳, 赵国强, 董子明.RNA干扰靶向沉默polβ基因对人卵巢癌细胞增殖活性及对化疗药物敏感性的影响[J].中国肿瘤临床, 2011, 38:197-199. |
 2014, Vol. 35
2014, Vol. 35


