宽叶缬草(Valeriana officinalis Linn. var. latiofolia Miq.)为败酱科缬草属植物欧缬草(Valeriana officinalis L.)的变种,生于林下或沟边,海拔1 500 m以下,主产于我国东北至西南的广大地区[1]。以根和根茎入药,性辛、苦、温,有宁心安神、理气止痛、清热止泻、祛风除湿的功效。民间常用于治疗肾虚失眠、腹胀腹泻、消化不良、痢疾以及头痛等症侯。现代药理和临床实验研究表明,宽叶缬草在镇静、抗抑郁、抗癫 、调节血脂、抗脂质过氧化、保护肾脏、以及防治胆囊结石和心、脑血管系统疾病等方面均有显著作用[2 ,3]。本实验对宽叶缬草水层进行了化学成分的研究,从中分离并鉴定了13个化合物,所有化合物均为首次从该植物中分离得到[3]。
Bruker DRX-500型核磁共振仪,TMS为内标物;ESI-MS用Agilent LC/MSD Trap XCT质谱仪测定;大孔树脂Diaion HP-20填料购自日本三菱化工;凝胶Sephadex LH-20为Phramacia公司产品;反相硅胶ODS(粒径40~70 μm)为Merck公司产品;硅胶H、GF254型、G型薄层硅胶板均为烟台芝罘黄务硅胶开发试验厂生产;试剂均为分析纯。
宽叶缬草于2007年8月采自贵州省高坡乡, 由第二军医大学药学院生药学教研室张汉明教授鉴定为败酱科缬草属宽叶缬草(Valeriana officinalis Linn. var. latiofolia Miq.)的根,标本保存于本教研室,标本号为No.2007-08-18。
宽叶缬草根(9.8 kg)经粉碎后以10倍量去离子水冷浸提取2次,每次24 h,合并提取液。提取液上大孔吸附树脂柱,先用10倍柱体积去离子水冲洗,后用10倍柱体积30%乙醇洗脱并收集洗脱液,浓缩得浸膏100 g。浸膏加硅胶(100~200目)拌样,上硅胶柱,分别用氯仿-甲醇(101)、氯仿-甲醇-水(610.07)、氯仿-甲醇-水(510.06)、氯仿-甲醇-水(410.1)、氯仿-甲醇-水(310.1)梯度洗脱,利用正、反相硅胶柱色谱、Sephadex LH-20柱色谱、制备薄层色谱等手段分离纯化,得到化合物 1 (4 mg)、 2 (14 mg)、 3 (20 mg)、4(25 mg)、5(10 mg)、 6 (55 mg)、 7 (4 mg)、8(35 mg)、9(10 mg)、10(15 mg)、11(7 mg)、12(17 mg)、13(7 mg)。各化合物结构式见图 1。
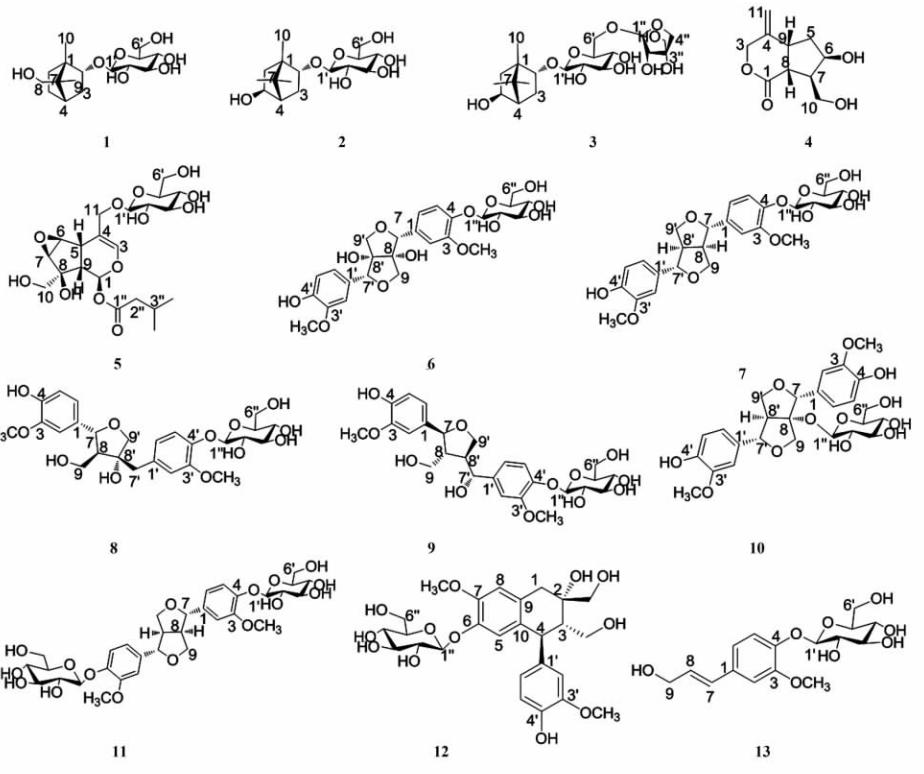 | 图1 化合物1~13的结构式 Fig 1 Chemical structures of compound 1-13 |
白色粉末, [α]25D=-15.7°(c,0.27,MeOH),ESI-MS m/z:355[M+Na]+,331[M-H]-,367[M+Cl]-,结合1HNMR、13CNMR及DEPT谱推测其分子式为C16H28O7。计算其不饱和度为3。1HNMR谱结合HSQC谱,高场区存在2个甲基质子信号0.98(3H,s),0.90(3H,s);2组羟甲基质子信号,一组为3.32(1H,d,J=10.3 Hz),3.67(1H,d,J=10.3 Hz),另一组为3.67(1H,dd,J=3.6,11.7 Hz),3.88(1H,dd,J=2.3,12.5 Hz);在3.16~4.24之间存在6组连氧的次甲基质子信号,其中4.24(1H,d,J=7.8 Hz)为糖的端基质子信号。13CNMR谱和DEPT谱给出16个碳信号,分别对应于2个甲基、5个亚甲基、7个次甲基以及2个季碳。13CNMR谱还显示葡萄糖的端基碳信号106.62(C-1′)以及6′位羟甲基碳信号66.34(C-6′),结合1H-1H COSY谱数据,得到结构中存在葡萄糖片段,同时根据端基质子的偶合常数,可知该糖为β构型。1H-1H COSY谱还显示苷元部分存在-OCH-CH2-CH-CH2-CH2-片段,进一步分析HMBC谱, H-9与C-1、C-4、C-7以及C-8远程相关,H-10与C-1、C-2、C-6以及C-7远程相关,构成崁烷型单萜骨架;葡萄糖片段端基质子信号与苷元C-2(87.85)存在明显相关,证实葡萄糖连在苷元的C-2上。因此推测化合物 1 可能为崁烷型单萜苷结构。经与文献[4]数据对比,鉴定化合物 1 为甘西鼠尾甲苷A。化合物 1 的核磁数据见表 1。
| 表1 化合物1~3的核磁数据(CD3OD,125 MHz/500 MHz) Tab 1 125 MHz for 13CNMR and 500 MHz for 1HNMR spectral data of compounds 1-3 in CD3OD |
无定形粉末, [α]25D=-30.4°(c,0.03,MeOH),ESI-MS m/z:355[M+Na]+,687[2M+Na]+,331[M-H]-, 663[2M-H]-,结合1HNMR、13CNMR及DEPT谱推测其分子式为C16H28O7。计算其不饱和度为3。比较化合物 2 和化合物 1 的核磁数据(表 1)发现,化合物 2 的骨架类型与化合物 1 相似,化合物 2 也存在一个葡萄糖片段,4.22(1H,d,J=7.8 Hz)为葡萄糖的端基质子信号,根据其偶合常数,可知该糖为β构型。HMBC谱显示,该质子信号与苷元C-2(82.57)存在明显相关,证明葡萄糖连在苷元的C-2上。与化合物 1 不同的是,1HNMR谱显示化合物 2 在高场区存在3个甲基质子信号0.84(3H,s),1.07(3H,s),0.91(3H,s)。结合13CNMR谱和DEPT谱,3.84(1H,dd,J=2.3,7.6 Hz)处的次甲基质子信号推测该叔碳可能连羟基。HMBC谱显示,该质子(H-5)明显与C-3、C-6远程相关。经与文献[5,6]数据对比,鉴定化合物 2 为当归棱子芹醇葡萄糖苷。化合物 2 的核磁数据见表 1。
白色无定形粉末, [α]25D=-48.6°(c,1.6,MeOH),ESI-MS m/z:487[M+Na]+,463[M-H]-,499[M+Cl]-,结合1HNMR、13CNMR及DEPT谱推测其分子式为 C21H36O11。计算其不饱和度为4。比较化合物 3 和化合物 2 的核磁数据(表 1)发现,化合物 3 比化合物 2 只多了5个碳信号,推测化合物 3 的糖部分可能含有11个碳原子,进一步比较数据,可能为1个六碳糖和1个五碳糖的二聚糖。1HNMR谱显示,4.19(1H,d,J=8.0 Hz)为葡萄糖的端基质子信号,根据其偶合常数,可知该糖为β构型。同时HMBC谱显示,该质子信号与苷元C-2(83.16)存在明显相关,证明葡萄糖连在苷元的C-2上。5.00(1H,d,J= 2.3 Hz)为另一个糖的端基质子信号,根据其偶合常数,可知该糖以β构型与葡萄糖相连。经与文献[7,8]数据对比,鉴定化合物 3 为(-)-当归棱子芹醇-2-O-β-D-呋喃芹菜糖基-(1→6)-β-D-吡喃葡萄糖苷。化合物 3 的核磁数据见表 1。
无色油状,[α]25D=-13.5°(c,0.004,MeOH),ESI-MS m/z:221[M+Na]+,419[2M+Na]+,197[M-H]-, 395[2M-H]-,结合1HNMR、13CNMR及DEPT谱推测其分子式为C10H14O4。计算其不饱和度为4。1HNMR谱显示有1个环外双键的烯氢信号5.06(1H,s),5.18(1H,s);余下的3个亚甲基质子信号4.73(2H,dd,J=11.9,27.2 Hz),1.66(1H,m),2.16(1H,m),3.82(2H,m);4个次甲基信号4.38(1H,m),2.40(1H,m),3.00(1H,dd,J=9.6,11.4 Hz),3.47(1H,m)。13CNMR显示环外双键的碳信号143.66(C-4),113.36(C-11)以及1个酯羰基信号176.95(C-1)。结合13CNMR谱和DEPT谱,化合物 4 共有10个碳信号,分别对应4个亚甲基、4个次甲基、2个季碳。同时1H-1H COSY谱显示,化合物 4 中存在-CH-CH2-CH-CH-片段。在HMBC谱中,H-11与C-3、C-9远程相关,H-10与C-7、C-6、C-8远程相关,H-8与C-1、C-9、C-7远程相关。结合其不饱和度说明化合物4可能为含有2个环和1个环外双键的环烯醚萜内酯类化合物。经与文献[9]数据对比,鉴定化合物4为6-羟基-7-羟甲基-4-亚甲基六氢环戊骈吡喃-1(3H)-酮。化合物4的NMR数据:1HNMR(500 MHz,CD3OD):4.73(2H,dd,J=11.9,27.2 Hz,H-3),1.66(1H,m,H-5a),2.16(1H,m,H-5b),4.38(1H,m,H-6),2.40(1H,m,H-7),3.00(1H,dd,J=9.6,11.4 Hz,H-8),3.47(1H,m,H-9),3.82(2H,m,H-10),5.06(1H,s,H-11a),5.18(1H,s,H-11b)。13CNMR(125 MHz,CD3OD):176.95(C-1),72.08(C-3),143.66(C-4),40.95(C-5),73.09(C-6),51.59(C-7),44.46(C-8),40.48(C-9),61.50(C-10),113.36(C-11)。
白色粉末,[α]25D=-137°(c,0.11,MeOH),ESI-MS m/z:499[M+Na]+,475[M-H]-,511[M+Cl]-,结合1HNMR、13CNMR及DEPT谱推测其分子式为C21H32O12。计算其不饱和度为6。1HNMR谱显示有1个异戊酰基取代的质子信号0.94(6H,d,J=6.6 Hz),2.02(1H,m),2.17(2H,d,J=1.9 Hz);1个烯氢信号6.40(1H,d,J=1.6 Hz);4.03(1H,d,J=2.5 Hz),3.35(1H,d,J=2.5 Hz)为2个连氧的次甲基质子信号,4.39(1H,d,J=7.8Hz)为糖的端基质子信号。13CNMR谱显示1个异戊酰基的碳信号172.56(C-1″),43.72(C-2″),26.44(C-3″),22.19(C-4″),22.22(C-5″);一组双键碳信号142.19(C-3),108.82(C-4);1个三元含氧环结构的碳信号59.30(C-6),59.77(C-7);还显示葡萄糖的端基碳信号101.66(C-1′)以及6′位羟甲基碳信号62.48 (C-6′)。同时结合1H-1H COSY谱数据,得到结构中存在葡萄糖片段,同时根据端基质子的偶合常数,可知该糖为β构型。1H-1H COSY谱中存在H-5/H-9/H-1明显相关的-CH-CH-CH-片段。HMBC谱中,H-11明显与C-3、C-4、C-5、C-1′远程相关,H-1明显与C-3、C-4、C-1″远程相关,H-6明显与C-5、C-9远程相关,H-7明显与C-8、C-9远程相关,H-10明显与C-7远程相关。结合不饱和度推测化合物5可能为含有1个异戊酰基和1个含氧三元环的环烯醚萜苷类化合物。经与文献[10]数据对比,鉴定化合物5为缬草苷A。化合物5的1HNMR(500 MHz,CD3OD)数据:6.39(1H,d,J=4.8 Hz,H-1),6.40(1H,d,J=1.6 Hz,H-3),3.07(1H,d,J=8.0 Hz,H-5),4.03(1H,d,J=2.5 Hz,H-6),3.35(1H,d,J=2.5 Hz,H-7),2.01(1H,d,J=7.8 Hz,H-9),3.68(2H,d,J=3.7 Hz,H-10),4.24(1H,d,J=11.9 Hz,H-11a),4.34(1H,d,J=11.9 Hz,H-11b),4.39(1H,d,J=7.8 Hz,glu-H-1′),3.20(1H,dd, J=8.0,9.2 Hz,glu-H-2′),3.36(1H,m,glu-H-3′),3.27(2H,m,glu-H-4′,5′),3.65(1H,m,glu-H-6′a),3.88(1H,d,J=1.5,11.2 Hz,glu-H-6′b),2.17(2H,d,J=1.9 Hz,isovaleryl-H-2″),2.02(1H,m,isovaleryl-H-3″),0.94(6H,d,J=6.6 Hz,isovaleryl-H-4″,5″)。13CNMR(125 MHz,CD3OD):90.16(C-1),142.19(C-3),108.82(C-4),35.02(C-5),59.30(C-6),59.77(C-7),79.69(C-8),42.99(C-9),66.64(C-10),69.10(C-11),101.66(glu-C-1′),74.74(glu-C-2′),77.80(glu-C-3′),71.41(glu-C-4′),77.57(glu-C-5′),62.48 (glu-C-6′),172.56(isovaleryl-C-1″),43.72(isovaleryl-C-2″),26.44(isovaleryl-C-3″),22.19(isovaleryl-C-4″),22.22(isovaleryl-C-5″)。
白色无定形粉末,[α]25D=-25.3°(c,1.0,MeOH),ESI-MS m/z:575[M+Na]+,587[M+Cl]-,结合1HNMR、13CNMR及DEPT谱推测其分子式为C26H32O13。计算其不饱和度为11,推测可能含有2个苯环。1HNMR谱中,7.03(1H,d,J=1.6 Hz),6.78(1H,d,J=8.0 Hz),6.84(1H,dd,J=1.6,8.0 Hz)构成苯环的一组ABX型偶合质子信号;7.09(1H,d,J=1.6 Hz),7.14(1H,d,J=8.5 Hz),6.93(1H,dd,J=1.6,8.5 Hz)构成另一个苯环的ABX型偶合质子信号;2个甲氧基信号3.84(6H,s);4.95(1H,s),4.99(1H,s)为2个连氧的次甲基质子信号;3.98(2H,d,J=9.4 Hz),4.10(2H,d,J=9.4 Hz)为2个连氧的亚甲基质子信号;4.89(1H,d,J=7.3 Hz)为糖的端基质子信号。13CNMR谱显示了葡萄糖的端基碳信号102.36(C-1″)以及6″位羟甲基碳信号62.12(C-6″),同时结合1H-1H COSY谱数据,得到结构中存在葡萄糖片段,同时根据端基质子的偶合常数,可知该糖为β构型。HMBC谱显示,该质子信号与苷元C-4(147.16)存在明显相关,证明葡萄糖连在苷元的C-4上。除去2个苯环和1个葡萄糖,尚余2个不饱和度,推测化合物 6 可能为双环氧木脂素苷类化合物。经与文献[11]数据对比,鉴定化合物 6 为双四氢呋喃木脂素-4-O-β-D-吡喃葡萄糖苷。化合物 6 的核磁数据见表 2、表 3。
| 表2 化合物6~11的氢谱数据(CD3OD, 500 MHz) Tab 2 500 MHz for 1HNMR spectral data of compound 6-11 in CD3OD |
| 表3 化合物6~11的碳谱数据(CD3OD,125 MHz) Tab 3 125 MHz for 13CNMR spectral data of compound 6-11 in CD3OD |
白色晶体,[α]25D=-46.7°(c,0.016,MeOH),ESI-MS m/z:561[M+Na]+,573[M+Cl]-,结合1HNMR、13CNMR及DEPT谱推测其分子式为C26H34O12。计算其不饱和度为10,推测可能含有2个苯环。 1HNMR谱显示,7.14(1H,d,J=1.8 Hz),6.74(1H,d,J=8.2 Hz),6.87(1H,dd,J=1.8,8.2 Hz)构成苯环的一组ABX型偶合质子信号;7.00(1H,d,J=1.8 Hz),7.09(1H,d,J=8.2 Hz),6.84(1H,dd,J=1.8,8.2 Hz)构成另一个苯环的一组ABX型偶合质子信号;3.84(3H,s),3.85(3H,s)为2个甲氧基信号;4.72(1H,d,J=7.1 Hz)为连氧的次甲基质子信号;3.74(1H,d,J=5.5 Hz),3.81(1H,d,J=9.4 Hz)为羟甲基的2个质子信号;4.87(1H,d,J=7.3 Hz)为糖的端基质子信号。 13CNMR谱显示了葡萄糖的端基碳信号102.56(C-1″)以及6″位羟甲基碳信号62.12(C-6″),同时结合1H-1H COSY谱数据,得到结构中存在葡萄糖片段,同时根据端基质子的偶合常数,可知该糖为β构型。
HMBC谱显示,该质子信号与苷元C-4′(146.21)存在明显相关,证明葡萄糖连在苷元的C-4′上。除去苯环和1个葡萄糖,尚余1个不饱和度,推测化合物 8 为单环氧木脂素苷类化合物。以上数据与文献[13,14]报道的基本一致,鉴定化合物 8 为小蜡苷Ⅰ。化合物 8 的核磁数据见表 2、表 3。
白色无定形粉末, [α]25D=-64°(c,0.15,MeOH),ESI-MS m/z:561[M+Na]+,537[M-H]-,573[M+Cl]-,结合1HNMR、13CNMR及DEPT谱推测其分子式为C26H34O12。计算其不饱和度为10,推测可能含有2个苯环。比较化合物9和化合物8的1HNMR谱和13CNMR谱(表 2、表 3)发现,化合物9和化合物8很相似,只是将化合物8的8′位上的羟基移到了7′位上。1HNMR谱显示,4.54(1H,d,J=8.2 Hz),4.61(1H,d,J=7.6 Hz)为2个连氧的次甲基质子信号。1H-1HCOSY谱中,化合物9的H-7′/H-8′/H-9′明显相关存在-CH-CH-CH2-的片段,这也证明了上述一点。经与文献[15]数据对比,鉴定化合物9为青木香苷A。化合物9的核磁数据见表 2、表 3。
白色无定形粉末,[α]25D=-15.3°(c,0.045,MeOH),ESI-MS m/z:559[M+Na]+,535[M-H]-,结合1HNMR、 13CNMR及DEPT谱推测其分子式为C26H32O12。计算其不饱和度为11,推测可能含有2个苯环。1HNMR谱显示,7.10(1H,d,J=1.8 Hz),6.72(1H,dd,J=8.0 Hz),6.86(1H,d,J=1.8,8.0 Hz)构成苯环的一组ABX型偶合质子信号;7.04(1H,d,J=1.8 Hz),6.81(1H,d,J=8.2 Hz),6.88(1H,dd,J=1.8,8.2 Hz)构成另一个苯环的一组ABX型偶合质子信号;3.84(3H,s),3.88(3H,s)为2个甲氧基信号;4.69(1H,s),4.82(1H,s)为2个连氧的次甲基质子信号;3.80(1H,dd,J=5.8,9.0 Hz),4.49(1H,t,J=8.7 Hz),3.94(1H,d,J=10.5 Hz),4.39(1H,d,J=10.5 Hz)为2个连氧的亚甲基质子信号;4.34(1H,d,J=7.6 Hz)为糖的端基质子信号。13CNMR谱显示了葡萄糖的端基碳信号99.65(C-1″)以及6″位羟甲基碳信号62.06(C-6″),同时结合1H-1H COSY谱数据,得到结构中存在葡萄糖片段,同时根据端基质子的偶合常数,可知该糖为β构型。HMBC谱显示,该质子信号与苷元C-8(98.79)存在明显相关,证明葡萄糖连在苷元的C-8上。除去2个苯环和1个葡萄糖,尚余2个不饱和度,推测化合物10可能为双环氧木脂素苷类化合物。与化合物 7 不同的是,化合物10的葡萄糖基连在C-8上,HMBC谱也证实了这一点。经与文献[16,17]数据对比,鉴定化合物10为(+)-1-羟基松脂酚-1-O-β-D-葡萄糖苷。化合物10的核磁数据见表 2、表 3。
白色粉末,[α]25D=-24.4°(c,0.11,MeOH),ESI-MS m/z:705[M+Na]+,681[M-H]-,717[M+Cl]-,结合 1HNMR、13CNMR及DEPT谱推测其分子式为C32H42O16。计算其不饱和度为12,推测可能含有2个苯环。1HNMR谱显示,7.03(1H,d,J=2.0 Hz),7.14(1H,d,J=8.2 Hz),6.91(1H,dd,J=2.0,8.2 Hz)构成苯环的一组ABX型偶合质子信号;3.87(3H,s)为甲氧基信号;4.76(1H,d,J=4.1 Hz)为1个连氧的次甲基质子信号;3.89(1H,m),4.25(1H,m)为1个连氧的亚甲基质子信号;4.87(1H,d,J=7.3 Hz)为糖的端基质子信号。13CNMR谱显示了葡萄糖的端基碳信号102.47(C-1′)以及6′位羟甲基碳信号62.10(C-6′),同时结合1H-1H COSY谱数据,得到结构中存在葡萄糖片段,同时根据端基质子的偶合常数,可知该糖为β构型。HMBC谱显示,该质子信号与苷元C-4(147.10)存在明显相关,证明葡萄糖连在苷元的C-4上。结合其相对分子质量,推测化合物11可能为具有对称结构的双环氧木脂素苷类化合物。以上数据与文献[18]报道的基本一致,鉴定化合物11为(+)-松脂酚-4,4′-O-二吡喃葡萄糖苷。化合物11的核磁数据见表 2、表 3。
白色无定形粉末,ESI-MS m/z:365[M+Na]+,683[2M-H]-,结合1HNMR、13CNMR及DEPT谱推测其分子式为C16H22O8。计算其不饱和度为6,推测可能含有1个苯环。1HNMR谱显示,7.06(1H,d,J=1.8 Hz),7.10(1H,d,J=8.5 Hz),6.94(1H,dd,J=1.8,8.5Hz)构成苯环的一组ABX型偶合质子信号;6.54(1H,d,J=15.8 Hz),6.27(1H,dt,J=5.7,15.8 Hz)为1组烯氢信号;3.86(3H,s)为1个甲氧基信号;4.88(1H,d,J=7.6Hz)为糖的端基质子信号。13CNMR谱显示1个双键的碳信号130.88(C-7)、128.49(C-8)和葡萄糖的端基碳信号102.35(C-1′)以及6″位羟甲基碳信号62.11(C-6′),同时结合1H-1H COSY谱数据,得到结构中存在葡萄糖片段,同时根据端基质子的偶合常数,可知该糖为β构型。HMBC谱显示,该质子信号与苷元C-4(147.23)存在明显相关,证明葡萄糖连在苷元的C-4上。经与文献[21-22]数据对比,鉴定化合物13为松柏苷。化合物13的NMR数据:1HNMR(500 MHz,CD3OD):7.06(1H,d,J=1.8 Hz,H-2),7.10(1H,d,J=8.5 Hz,H-5),6.94(1H,dd,J=1.8,8.5 Hz,H-6),6.54(1H,d,J=15.8 Hz,H-7),6.27(1H,dt,J=5.7,15.8 Hz,H-8),4.20(2H,dd,J=1.4,5.7 Hz,H-9),3.86(3H,s,3-OCH3),4.88(1H,d,J=7.6 Hz,H-1′),3.48(1H,m,H-2′),3.47(1H,m,H-3′),3.39(1H,m,H-4′,5′),3.68(1H,dd,J=5.0,11.9 Hz,H-6′a),3.86(1H,m,H-6′b)。13CNMR(125 MHz,CD3OD):133.28(C-1),110.99(C-2),150.49(C-3),147.23(C-4),117.53(C-5),120.34(C-6),130.88(C-7),128.49(C-8),63.32(C-9),56.32(3-OCH3),102.35(C-1′),74.51(C-2′),77.46(C-3′),70.94(C-4′),77.82(C-5′),62.11(C-6′)。
在以往的化学成分研究中,对宽叶缬草中的小极性成分,尤其是挥发性成分研究居多,而对极性较大的成分研究鲜见报道。例如王立群等[23]通过GC-MS分析,与标准图谱对照,鉴定挥发油中已知成分,主要以单萜和倍半萜类成分为主;杨乾等[24]研究了宽叶缬草的化学成分及药理活性方面的进展,其化学成分主要有挥发油类和环烯醚萜类成分;Wang 等[25,26]从湖北产宽叶缬草的根中小极性部位发现并报道了11个倍半萜化合物。根据文献报道,宽叶缬草中的小极性的挥发性成分具有镇静、抗抑郁等药理活性。本研究主要对宽叶缬草的水溶性化学成分进行了初步研究,我们分离得到13个化合物,其中化合物 1 ~ 3 是单萜苷类化合物,化合物4和5是环烯醚萜类化合物,化合物 6 ~12是木脂素苷类化合物,化合物13为苯丙素苷类化合物,且均为首次从该植物中分离得到。由结果可见,宽叶缬草的水溶性成分主要以苯丙素及木脂素苷类为主,同时有少量的单萜苷和环烯醚萜苷,经查阅文献发现,木脂素苷类化合物成分虽无显著的镇静作用,但具有调节血脂、抗脂质过氧化等药理作用。本研究结果不仅丰富了对该植物次生代谢产物结构类型的认识,同时为宽叶缬草的合理临床应用提供了新的科学依据。
所有作者声明本文不涉及任何利益冲突。
| [1] | 中国科学院中国植物志编辑委员会.中国植物志(第73卷第一分册)[M].北京: 科学出版社, 1986:32-33. |
| [2] | 中国药材公司.中国中药资源志要[M].北京: 科学出版社, 1994:1215-1216. |
| [3] | 王有为, 陈 倩.中国宽叶缬草药用功效研究概况[J].亚太传统医药, 2005(3):69-71. |
| [4] | 杨 阳, 吴志军, 杨颖博, 来 威, 孙连娜, 陈万生.甘西鼠尾草中三个新的萜类化合物[J].高等学校化学学报, 2011, 32:1318-1322. |
| [5] | 蒲首丞, 郭远强, 高文远.天胡荽化学成分的研究[J].中草药, 2010, 41:1440-1442. |
| [6] | Takeuchi H, Lu Z G, Fujita T.New monoterpene glucoside from the aerial parts of thyme (Thymus vulgaris L.)[J].Biosci Biotechnol Biochem, 2004, 68:1131-1134. |
| [7] | Kitajima J, Okamura C, Ishikawa T, Tanaka Y.Monoterpenoid glycosides of Glehnia littoralis root and rhizoma[J].Chem Pharmaceut Bull, 1998, 46:1595-1598. |
| [8] | 闫福林, 董 丽, 刘振岭, 晁淑军, 郝永兵.长毛三脉紫菀化学成分的研究[J].新乡医学院学报, 2007, 24:548-550. |
| [9] | Zhang Y, Lu Y, Zhang L, Zheng Q T, Xu L Z, Yang S L.Terpenoids from the roots and rhizomes of Nardostachys chinensis[J].J Nat Prod, 2005, 68:1131-1133. |
| [10] | KuruÜzÜm-UzÜA, GÜvenalp Z, OmÜr Demirezer L, Bergère I, Stroch K, Zeeck A.4'-Deoxy iridoid glycosides from Centranthus longiflorus[J].Phytochemmtry, 2002, 61:937-941. |
| [11] | Piccinelli A L, Arana S, Caceres A, di Villa Bianca Rd, Sorrentino R, Rastrelli L.New lignans from the roots of Valeriana prionophylla with antioxidative and vasorelaxant activities[J].J Nat Prod, 2004, 67:1135-1140. |
| [12] | 张彦龙, 曾伟民, 王慧荣, 朱 丽, 徐洪亮, 匡海学.香鳞毛蕨中木脂素类抗氧化活性成分的研究[J].中草药, 2008, 39:343-346. |
| [13] | Gao B B, She G M, She D M.Chemical constituents and biological activities of plants from the genus Ligustrum[J].Chem Biodivers, 2013, 10: 96-128. |
| [14] | 欧阳明安.女贞小蜡树的木脂素及黄酮类配糖体成分研究[J].中草药, 2003, 34:196-198. |
| [15] | Zhou Z W, Yin S, Wang X N, Fan C Q, Li H, Yue J M.Two new lignan glycosides from Saussurea laniceps[J].Helv Chim Acta, 2007, 90:951-956. |
| [16] | Yang M C, Lee K H, Kim K H, Choi S U, Lee K R.Lignan and terpene constituents from the aerial parts of Saussurea pulchella[J].Arch Pharm Res, 2007, 30:1067-1074. |
| [17] | Kang H S, Chung H Y, Byun D S, Choi J S.Further isolation of antioxidative (+)-1-hydroxypinoresinol-1-O-beta-D-glucoside from the rhizome of Salvia miltiorrhiza that acts on peroxynitrite, total ROS and 1, 1-diphenyl-2-picrylhydrazyl radical[J].Arch Pharm Res, 2003, 26:24-27. |
| [18] | 杨 鑫, 丁 怡, 张东明.毛冬青中木质素苷类化学成分的研究[J].中国中药杂志, 2007, 32:1303-1305. |
| [19] | 刘春力, 段营辉, 戴 毅, 姚新生.甘松根化学成分研究[J].中药材, 2011, 34:1216-1219. |
| [20] | Sugiyama M, Nagayama E, Kikuehi M.Lignan and phenylpropanoid glycosides from Osmanthus asiaticus[J].Phytochemistry, 1993, 33:1215-1219. |
| [21] | GÜvenalp Z, zbek H, KuruÜzÜm-Uz A, Kazaz C, Demīrezer L .Secondary metabolites from Nepeta heliotropifolia[J].Turk J Chem, 2009, 33:667-675. |
| [22] | 杨竹雅, 卫莹芳, 周志宏, 马晓霞.厚朴叶中具血管活性作用部位的化学成分研究[J].中草药, 2013, 44:260-264. |
| [23] | 王立群, 熊义涛, 陶福华, 李念群.宽叶缬草挥发油成分分析[J].中药材, 1999, 22:298-299. |
| [24] | 杨 乾, 鞠爱华, 白万富, 陈鹏飞.宽叶缬草的化学成分及药理活性研究进展[J].中国现代应用药学, 2008, 25:613-616. |
| [25] | Wang P C, Ran X H, Chen R, Luo H R, Liu Y Q, Zhou J, et al.Germacrane-type sesquiterpenoids from the roots of Valeriana officinalis var. latifolia[J].J Nat Prod, 2010, 73:1563-1567. |
| [26] | Wang P C, Ran X H, Luo H R, Hu J M, Chen R, Ma Q Y, et al.Volvalerelactones A and B, two new sesquiterpenoid lactones with an unprecedented skeleton from Valeriana officinalis var. latifolia[J].Org Lett, 2011, 13:3036-3039. |
 2014, Vol. 35
2014, Vol. 35


