2. 第二军医大学药学院药剂学教研室, 上海 200433
2. Department of Pharmaceutics, School of Pharmacy, Second Military Medical University, Shanghai 200433, China
微小RNA(miRNA)可以使目标mRNA降解,从而达到基因沉默的效果,是未来基因疗法中一个重要方向[1]。相比特定的DNA编码基因,miRNA的调节作用更为有效, 因而在恶性肿瘤、免疫疾病以及显性遗传病等领域极具研究价值[2,3,4,5]。但miRNA极不稳定,设计一个能保护miRNA免受外界环境降解、排泄,并且能运载其高效进入内涵体并逃逸的传递系统十分必要。
以聚乙二醇-聚{氮-[氮-(2-氨乙基)-2-氨乙基]天冬氨酸},即PEG-P[Asp(DET)]为基本骨架的高分子材料是一种新型高效的聚阳离子高分子载体材料[6]。因其具有独特的质子海绵效应,在复合pDNA和siRNA的体内实验中成功实现了高效的细胞内涵体逃逸[6,7,8,9]。相对于双链pDNA可以在胶束核心被稳定压缩形成稳定的胶束核心,单链的miRNA只有21个碱基对的长度,短小并且具有一定的刚性结构[10],miRNA在生理环境下形成稳定胶束复合物难度显著增大。因此,很有必要对其进行合理的修饰,使高分子的链段对miRNA分子具有更好的结合能力,形成更为稳定的miRNA胶束复合物。增加胶束核心的疏水性是改善基因结合能力有效的办法之一, 例如 Oba等[11]利用胆甾醇基修饰PEG-P[Asp(DET)]的ω端基,显著增加了pDNA复合物的稳定性。本实验拟利用氯甲酸胆甾醇修饰聚天冬氨酸侧链及端基伯胺,形成疏水程度更高的聚合物,其具有的高疏水性和阳电荷效应有望与miRNA形成稳定的胶束复合物并达到较高转染效率。本实验中,我们制备了miRNA的聚合物复合胶束,并对其粒径、Zeta电位、胶稳定性、细胞摄取以及材料的细胞毒性等性质进行了考察。
甲氧基封端聚乙二醇氨(PEG-NH2, Mw=5 000,上海晶纯实业有限公司,二亚乙基三胺(DET,百灵威化学技术有限公司),氯甲酸胆甾醇酯(cholesterol chloroformate,百灵威化学技术有限公司),天冬氨酸(阿法埃莎化学有限公司),苯甲醇(国药集团化学试剂有限公司)。miRNA:Hsa-miR-15a (5′-UAG CAG CAC AUA AUG GUU UGU-3′), 5′端FAM标记的Hsa-miR-15a (5′-UAG CAG CAC AUA AUG GUU UGU-3′) ,上海吉玛制药技术有限公司.
冷冻干燥机(美国Virtis公司);Zeta sizer Nano ZS激光粒度分析仪(英国Malvern公司);NANOpure DiamondTM超纯水机(美国Barnstead公司);VTX-3000L型涡旋混合器(德国Binder公司);酶标仪(美国Thermo Fisher公司);超速离心机(日本Hitachi公司)。
聚乙二醇-b-聚天冬氨酸苄酯(PEG-b-PBLA)按照参考文献[12]合成。随后用DET对PEG-b-PBLA进行氨解:称取烘干的PEG-b-PBLA 0.4 g,加入重蒸的二甲基甲酰胺(DMF)约10 mL,再加入无水硫酸钠预处理的DET约8 mL,恒温水浴24 h,盐酸调节pH值至7.0左右,纯水透析,冻干得PEG-P[Asp(DET)],见图 1。核磁共振法检查其氨解情况,溶剂为重水。
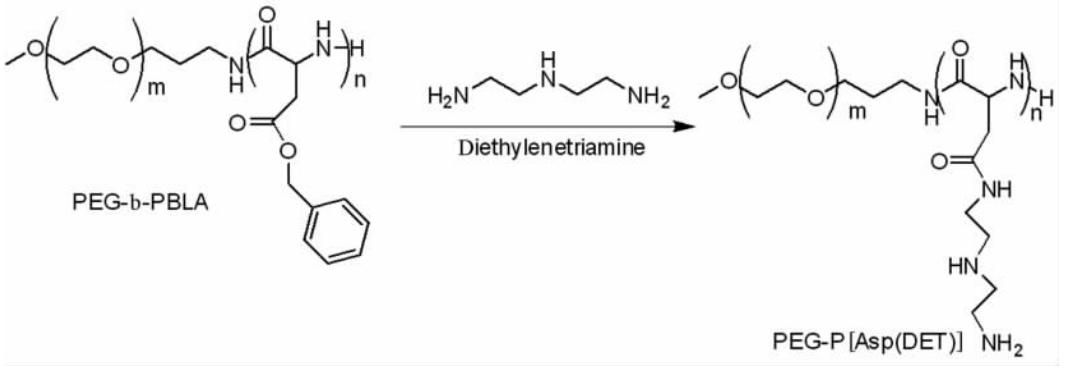 | 图1 聚乙二醇-b-聚天冬氨酸苄酯(PEG-b-PBLA)的氨解Fig 1 Ammonolysis of PEG-b-PBLA |
称取干燥的PEG-P[Asp(DET)]各0.3 g,按照修饰度分别为10%、20%、30%、40%和50%计算氯甲酸胆甾醇酯的用量,以二甲亚砜(DMSO)作为溶剂,三乙胺为缚酸剂进行反应24 h, 纯水透析,冻干,得到胆甾醇基修饰度不同的PEG-P[Asp(DET)](图 2)。
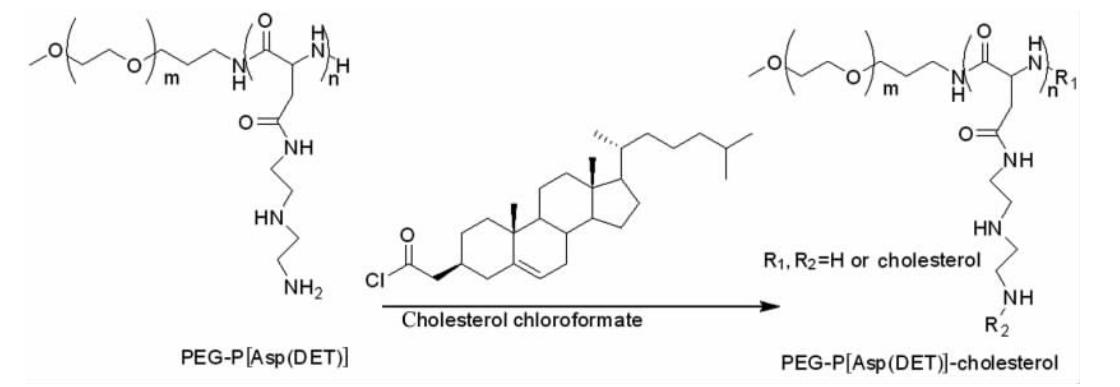 | 图2 胆甾醇部分修饰PEG-P[Asp(DET)]的合成示意图 Fig 2 Cholesterol modification of PEG-P[Asp(DET)] |
精密称取胆甾醇修饰度分别为10%、20%、30%、40%和50%的上述合成材料各10 mg, 溶解于100 μL PBS缓冲溶液中,超声30 min,静置30 min,完全溶解(1 g/10 mL)的则视为易溶,没有完全溶解的采用倍比稀释的方法逐次验证其是否溶解。实验证明PEG-P[Asp(DET)]-10%胆甾醇可以保证工作浓度下有良好的溶解度,因此选用PEG-P[Asp(DET)]-10%胆甾醇进行后期实验。
将miRNA溶解在含有焦碳酸二乙酯( DEPC,0.1%)的Tris-HCl缓冲溶液中,以保护基因不受RNA酶的影响而降解。按照预设好的氮磷(N/P)比以及响应材料浓度,将二者的Tris-HCl溶液以体积比21混合,在振荡器上孵育得到目标胶束复合物,用粒径分析仪测定其粒径和Zeta电位。
变性PAGE凝胶电泳:配制胶浓度为12%的聚丙烯酰胺凝胶,用DEPC水分别溶解RNA与高分子材料,按照N/P为1、2、3、4、5与不同浓度 (0.04、0.08、0.12、0.16、0.20 mg/mL)的PEG-P[Asp(DET)]-10%胆甾醇混合;样品在室温下震荡5 min,85℃水浴15 min,冰浴10 min;用上样缓冲液混合上样,冰水浴低温电泳,180 V,50 min,银染显色观察。溶液及试剂均经DEPC处理。
FAM标记的hsa-miR-15a (FAM-miRNA)在激发波长和发射波长分别为495 nm和525 nm时有强吸收,因此可利用荧光酶标仪监测其绿色荧光强度值,从而确定对应溶液中基因的浓度。包裹FAM-miRNA的胶束复合物通过 Amicon○ R Ultra超滤离心管(100 000标称相对分子质量,NMWL)离心后收集未包封的miRNA,测定荧光强度, 用浓度分别为100 μg/mL、50 μg/mL、25 μg/mL、10 μg/mL、2.5 μg/mL、1 μg/mL、 500 ng/mL、100 ng/mL、10 ng/mL的FAM-miRNA溶液制备miRNA标准曲线,标准曲线的线性回归方程为将样品荧光强度值带入标准曲线方程中,算出对应的miRNA含量。线性范围在10 ng~100 μg之间。用以下公式 计算:包封率(%)=miRNA加入-miRNA上清/miRNA加入×100%
PEG-P[Asp(DET)]-10%胆甾醇/hsa-miR-15a胶束复合物在N/P=20的情况下,加入胶束复合物后观察摄取效果。收集 K562细胞,接种至24孔板中,每孔加入细胞1 mL,加入不同处方制备的新鲜复合物20 μL (5′ FAM标记)。实验组为PEG-P[Asp(DET)]-10%胆甾醇/hsa-miR-15a,3个对照组分别为裸hsa-miR-15a组、PEI/hsa-miR-15a组和 lipo2000/hsa-miR-15a组;各实验组培养4 h后,收集细胞,PBS清洗,细胞固定液固定后,滴加至载玻片上用 0.5 mL 4’,6-二脒基-2-苯基吲哚(DAPI)染色剂染色15 min,用PBS清洗后,滴加抗荧光淬灭封片液封片后用共聚焦显微镜观察。FAM的激发波长为488 nm,发射波长为505~530 nm;DAPI染色剂激发波长为340 nm, 发射波长为488 nm。
取出对数生长期的K562细胞,重悬接种于96孔板,每孔1×105个细胞,按照CCK-8试剂盒说明书进行细胞毒性检测,按以下公式计算细胞生存率:生存率(%)=(样品D值-空白D值)/(阴性对照D值-空白组D值)×100%。
如图 3A所示,通过PEG重复单元与DET重复单元的关系以及峰的位置与面积,确认最终合成了PEG113-P[Asp(DET)]94,其天冬氨酸链的聚合度约为94;图 3B中c峰是胆甾醇基接上以后的特征峰,经由峰面积计算胆甾醇的修饰度为7.99%。实验结果证明,胆甾醇基的修饰度会随着氯甲酸胆甾醇的修饰度上升而上升,但是没发现二者有线性关系。修饰度高的材料不能在工作条件下(N/P=20)保持良好的溶解性,因此本实验选取胆甾醇基修饰在10%的材料作为后续实验的材料。
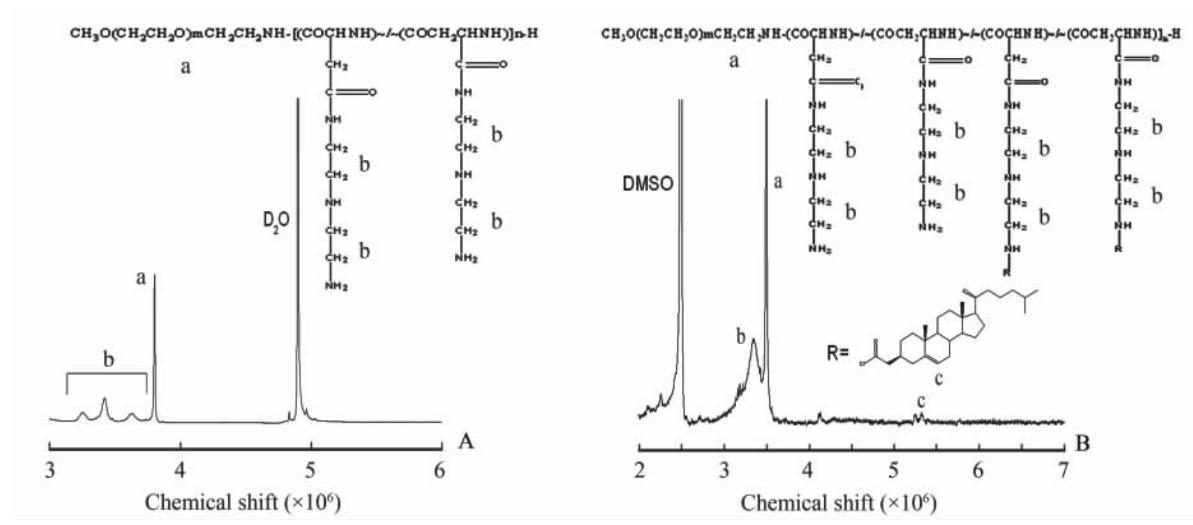 | 图3 PEG-P[Asp(DET)](A)和PEG-P[Asp(DET)]-10% cholesterol (B)的1HNMR图谱Fig 3 1HNMR spectrum of PEG-P[Asp(DET)](A) and PEG-P[Asp(DET)]-10% cholesterol (B) |
胶束复合物的粒径和Zeta电位对于后期实验方案的确定具有重要的参考作用。 miRNA本身刚性较强,分子间斥力也较强,因此形成胶束直径较pDNA直径大。表 1中,氯甲酸胆甾醇未修饰和修饰两种材料与hsa-miR-15a(cmiRNA=5 μmol/mL)形成的复合物,粒径都小于200 nm。修饰过后材料的 Zeta电位由修饰前的(24.6±1.3) mV变成了修饰后的(13.2±2.0) mV,因而导致修饰后的粒径反而比未修饰之前小。
| 表1 胆甾醇未修饰/修饰材料复合miRNA 的粒径、Zeta电位以及PDI的比较 Tab 1 Comparison of particle size, Zeta potential and PDI between unmodified and chole-modified PEG-P[Asp(DET)]/miRNA n=3, ±s |
PEG-P[Asp(DET)]-10%胆甾醇包裹基因的结果如图 4A所示。随着N/P比的增大,miRNA全部滞留在在加样孔中, N/P=5时高分子材料完全和基因复合,形成了稳定的胶束复合物。将该胶束复合物置于10%胎牛血清(FBS)培养液中,具有相同的趋势(图 4B),唯一不同的是完全复合形成稳定复合物的N/P比值稍微有所差异。
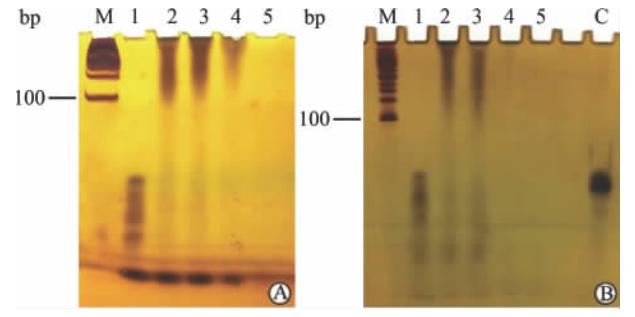 | 图4 PEG-P[Asp(DET)]-10%胆甾醇/miRNA复合物的凝胶阻滞电泳Fig 4 Gel retardation electrophoresis of PEG-P[Asp(DET)]-10%cholesterol/miRNAA: The stability of the complex in aqueous solution; B: In 10% fetal bovine serum/phosphate buffered solution solution. M: RNA marker band; 1-5: N/P(Nitrogen-phosphorus) ratio; C: Single chain primer of DNA, a reference of degradation of miRNA |
采用超滤离心法测定的miRNA的包封率。结果未加修饰的高分子材料PEG-P[Asp(DET)] /miRNA的包封率为(71.3±2.1)%,而PEG-P[Asp(DET)]-10%胆甾醇/miRNA的包封率为(90.5±3.2)%,显示疏水修饰后的高分子材料的包封率上升。
从图 5A可以看出,裸的hsa-miR-15a几乎不能进入细胞,而传统的转染试剂聚乙烯亚胺(PEI)/hsa-miR-15a组具有很强绿色荧光,验证了其良好的细胞摄取能力;10%胆甾醇修饰组对于胶束复合物的摄取,大于现在已经商品化生产的lipo2000试剂。 用流式细胞技术对摄入复合物的绿色荧光进行了表征,在图 5B中同样可以看出该复合物的细胞摄取能力大于lipo2000。
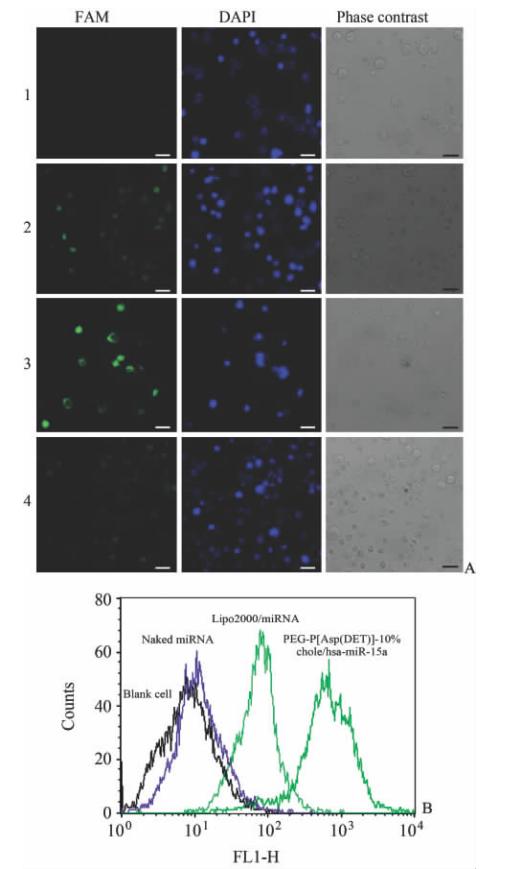 | 图5 PEG-P[Asp(DET)]-10%胆甾醇/miRNA 胶束复合物的细胞摄取Fig 5 Cellular uptake of PEG-P[Asp(DET)]-10% chole/miRNAA: Cell images under laser scanning confocal microscope, N/P=20, concentration of miRNA is 100 nmol·mL-1 ; B: Fluorescence intensity distribution after cellular uptake in K562 cells. In Fig 5A, FAM-labeled miRNA and DAPI labeled nuclei are shown in green and blue, respectively, black bar represents 10 μm; fluorescence intensity distribution of PEI group beyond 104, not shown in Fig 5B. 1: Naked miRNA; 2: PEG-P[Asp(DET)]-10% chole/miRNA; 3: PEI/miRNA; 4: Lipo2000/miRNA. Chole: Cholesterol; FAM: Carboxyflourescein; DAPI: 4’,6-diamidino-2-2-phenylindole; PEI: Polyetherimide |
在高分子材料的工作浓度0.04 mg/mL时,传统的转染试剂PEI对于材料有相当大的细胞毒solutionsolution性,48 h后细胞的存活量很少,约为15.6%;商品化的试剂lipo2000组细胞的生存率为82.4%,而高分子材料组的细胞存活率相对于空白对照组来说接近100%(为99.8%),表明PEG-P[Asp(DET)]-10%胆甾醇具极低的细胞毒性。
为了增加高分子化合物与与基因物质之间的相互作用,初步解决miRNA在体内的传递问题,本实验选用氯甲酸胆甾醇修饰PEG-P[Asp(DET)]来进一步增加高分子材料稳定基因的能力, 通过增加高分子链段正电荷部分的疏水性来增加高分子聚合物和基因的结合能力,从而以稳定的状态通过内吞作用进入细胞实施转染。
本实验合成了PEG-P[Asp(DET)]-10%胆甾醇,核磁方法验证了其聚合度。实验中发现,胆甾醇基侧链修饰PEG-P[Asp(DET)]后,其中的DET在后续透析以及修饰反应中容易水解,是后续实验实现细胞内吞及质子海绵效应的重要基础[7],保证后续水相的反应和透析体系在弱酸性环境中是合成实验中的关键问题。
实验表明,PEG-P[Asp(DET)]-10%胆甾醇与miRNA形成的复合物粒径反而大于未加修饰的材料,其原因可能为胶束的粒径取决于miRNA在胶束复合物内的压缩程度。未经修饰的PEG-P[Asp(DET)]带有较多正电荷,与基因作用较强,可以将刚性的miRNA压缩在胶核之内,而PEG-P[Asp(DET)]-10%胆甾醇虽然可以更好地稳定胶束复合物,但是却降低了正负电荷的相互作用,这一点Zeta电位的数据也可以印证; PEG-P[Asp(DET)]-10%胆甾醇与miRNA形成的复合物具有较高的包封率,显示疏水修饰策略能改善阳离子高分子材料复合miRNA的能力,其原因可能为与高分子链段的端基伯胺被胆甾醇基取代后与miRNA的相互作用增强。
PEI作为常用的基因转染试剂,其链段胺基带有大量的正电荷,可以和细胞磷脂膜双分子层膜中的磷酸根等负电荷物质相互作用,大大促进了细胞的内吞作用,但是其细胞毒性大,常作为摄取材料的阳性对照。Lipo2000是已经商品化的阳离子脂质体材料,在复合pDNA和siRNA进入细胞以及转染实验中都有优良表现,本实验以此2种材料作为阳性参照来验证高分子胶束复合物的摄取。结果表明,该胶束复合物比商业化试剂lipo2000更好地转入细胞,显示该系列的材料可以作为一种良好的载体材料复合miRNA进入细胞实施后期的细胞转染实验。同时实验中发现,PEG-P[Asp(DET)]-10%胆甾醇/hsa-miR-15a在细胞内的分布不均匀,可能与细胞体积差异和细胞周期有关,尚需进行摄取机制的研究。流式细胞术检测结果表明,PEG-P[Asp(DET)]-10%胆甾醇/hsa-miR-15a组的平均强度较大,峰形较宽,也证实了细胞对该胶束复合物的摄取不均匀。
本实验对该材料的细胞毒性也进行了考察,发现其具有很低的细胞毒性。该材料有望以其低毒、高效摄取和转染特性成为miRNA基因治疗方面的良好载体,其在细胞内的内涵体逃逸、转染等行为尚待进一步研究。在胶束复合物的外部接上抗体,使胶束复合物对特定细胞系具有特异选择性,也是以后值得深入研究的问题。
所有作者声明本文不涉及任何利益冲突。
| [1] | Napoli C, Lemieux, Jorgensen R.Introduction of a chimeric chalcone synthase gene into petunia results in reversible co-suppression of homologous genes in trans[J].Plant Cell, 1990, 2:278-289. |
| [2] | Napoli C, Lemieux, Jorgensen R.Introduction of a chimeric chalcone synthase gene into petunia results in reversible co-suppression of homologous genes in trans[J].Plant Cell, 1990, 2:278-289. |
| [3] | Guo S, Kemkhues K.par-1, a gene required for establishing polarity in C.elegans embryos, encodes a putative Ser/Thr kinase that is asymmetrically distributed[J].Cell, 1995, 81:611-620. |
| [4] | Fire A, Xu S, Montgomery M K, Kostas S A, Driver S E, Mello C C.Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J], Nature, 1998.391:806-811. |
| [5] | Sharp P A, Zamore P D.Molecular biology RNA interference[J].Science, 2000, 287:2431-2433. |
| [6] | Rubinson D A, Dillon C P, Kwiatkowski A V, Sievers C, Yang L, Kopinja J, et al.A lentivirus-based system to functionally silence genes in primary mammalian cells, stem cells and transgenic mice by RNA interference[J].Nat Genet, 2003, 33:401-406. |
| [7] | Miyata K, Oba M, Nakanishi M, Fukushima S, Yamasaki Y, Koyama H, et al.Polyplexes from poly(aspartamide) bearing 1, 2-diaminoethane side chains induce pH selective, endosomal membrane destabilization with amplified transfection and negligible cytotoxicity[J].J Am Chem Soc, 2008, 130:16287-16294. |
| [8] | Liu Z H, Zhang Z Y, Zhou C R, Jiao Y P.Hydrophobic modifications of cationic polymers for gene delivery[J].Prog Polym Sci, 2010, 9:1144-1162. |
| [9] | Manganiello M J, Cheng C, Convertine A J, Bryers J D, Stayton P S.Diblock copolymers with tunable pH transitions for gene delivery[J].Biomaterials, 2012, 33:2301-2309. |
| [10] | Kim H J, IshⅡ A, Miyata K, Lee Y, Wu S, Oba M, et al.Introduction of stearoyl moieties into a biocompatible cationic polyaspartamide derivative, PAsp(DET), with endosomal escaping function for enhanced siRNA-mediated gene knockdown[J].J Contr Rel, 2010, 145:141-148. |
| [11] | De Smedt S C, Demeester J, Hennink W E.Cationic polymer based gene delivery systems[J], Pharm Res, 2000, 17:113-126. |
| [12] | Oba M, Miyata K, Osada K, Christie R J, Sanjoh M, Li W, et al.Polyplex micelles prepared from ω-cholesteryl PEG-polycation block copolymersfor systemic gene delivery[J].Biomaerials, 2011, 32:652-663. |
| [13] | 王玲玲.氨基酸共聚物的合成研究[D].北京化工大学, 2007. |
 2014, Vol. 35
2014, Vol. 35


