2. 华中科技大学同济医学院附属协和医院心血管病研究所, 武汉 430022
2. Institute of Cardiology, Union Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430022, Hubei, China
1999年Wallukat等[1]在先兆子痫患者中首次发现抗血管紧张素Ⅱ1型受体自身抗体 (angiotensin Ⅱ type 1 receptor agonistic autoantibody, AT1-AA)。该自身抗体参与多种原发性或继发性心肌病变[2,3,4],并与病理情况下的心肌重构有关[5]。我们前期临床研究发现甲状腺功能亢进(甲亢)性心脏病患者AT1-AA阳性率为52.2%,与甲亢无心脏病组阳性检出率(26.7%)和正常对照组阳性检出率 (12.5%)比较差异有统计学意义,认为AT1-AA可能为甲亢性心脏病的发病机制之一[6]。但AT1-AA致甲亢性心脏病的信号转导通路尚不清楚。
磷脂酰肌醇-3-激酶(phosphatidylinositol 3 kinase, PI3K)-蛋白激酶B(protein kinase B, Akt)是细胞内重要的信号转导通路,近年研究发现PI3K/Akt参与甲状腺素(thyroid hormones, THs)致心肌肥大的病理生理过程,血管紧张素Ⅱ1型受体(angiotensin Ⅱ type 1 receptor,AT1R)在此信号通路中发挥重要的中介作用[7 ,8]。本研究通过观察甲亢心肌肥大大鼠AT1-AA和PI3K/Akt的表达,初步探讨AT1-AA在甲亢大鼠心肌肥大中的作用及其与PI3K/Akt信号通路的关系,深入了解AT1-AA致甲亢心肌肥大的信号转导机制,以进一步明确甲亢性心脏病发病机制,为更好地防治甲亢性心脏病提供理论依据。
体质量200~220 g、8周龄SD大鼠54只,购自武汉大学实验动物中心(动物合格证编号4200593400),适应性喂养1周后无不良反应,进食水正常者纳入试验。饲养环境:室温20~24℃,相对湿度40%~60%,饲料由武汉大学实验动物中心提供,自由摄食饮水,12 h交替照明。
PCR引物由南京金斯瑞生物科技有限公司合成,实时定量PCR试剂盒购自Fermentas公司;RIPA细胞裂解液、蛋白酶抑制剂苯甲基磺酰氟(PMSF)、BCA蛋白定量试剂盒购自碧云天生物技术有限公司;AT1R兔抗大鼠一抗和GAPDH小鼠抗大鼠一抗购自Santa Cruz公司,PI3K和p-Akt兔抗大鼠一抗购自Cell Signaling公司,山羊抗兔二抗和抗小鼠二抗购自武汉博士德生物工程有限公司。血清促甲状腺激素(TSH)、游离三碘甲状腺原氨酸(FT3)和游离甲状腺素(FT4)放免试剂盒购自北京北方生物技术研究所。左甲状腺素钠片(L-thyroxin, L-thy,商品名为优甲乐)由德国默克公司赠送,产品规格为100 μg×100片/盒,批号为148214,进口药品注册证号:H20100524。奥美沙坦酯片购自第一三共制药(上海)有限公司,产品规格20 mg×7片/盒。生产批号:20041202。
L-thy充分研磨后以0.1 g/L质量浓度混悬于5 g/L质量浓度羧甲基纤维素钠(CMC-Na)混悬液中,配制后置于冰箱保存待用。实验大鼠共分为3组:甲亢组、甲亢+奥美沙坦组及对照组, 每组18只。甲亢组每日1次灌服CMC-Na混悬的L-thy 0.5 mg/kg,持续28 d,制备甲亢大鼠模型;甲亢+奥美沙坦组每日1次灌服CMC-Na混悬的L-thy 0.5 mg/kg及奥美沙坦2 mg/kg,连续给药28 d;对照组每日1次灌服等体积CMC-Na。
大鼠于实验结束后禁食8 h,称质量,以10%水合氯醛(0.03 mL/kg)腹腔注射麻醉后,使用Powerlab/16sp生理记录仪记录心率。测定结束后,经下腔静脉取血2 mL,迅速取出心脏,用冰生理盐水清洗心腔内积血、滤纸吸干,去除心脏周围组织及血管,电子天平准确称量全心质量(HW),计算心脏质量与体质量的比值(heart weight index,HWI,单位为mg/g),将其作为心脏肥大的指标。2 mL血液经分离血清后,置于-20℃冰箱保存备用,心脏组织于-70℃冻存备用。
采用TRIzol一步法抽提大鼠心肌组织总RNA,经分光光度计进行RNA定量和定性检测,反转录反应严格依照试剂盒说明进行。引物设计如下,ANP:上游 5′-GGG CTT CTT CCT CTT CCT G-3′,下游 5′-CTG AGA CGG GTT GAC TTC C-3′; GAPDH:上游 5′-ACA GCA ACA GGG TGG TGG AC-3′,下游 5′-TTT GAG GGT GCA GCG AAC TT-3′。扩增条件:94℃ 变性(30 s)、56℃退火(30 s)、72℃延伸(25 s),30次循环,继续72℃延伸(5 min)。使用ABI7900实时定量PCR仪进行扩增,扩增完成后60℃开始升温作熔解曲线验证扩增产物的特异性。反应完成后设定基线值和阈值,计算机分析得到阈循环(Ct)值,基因相对表达量以2-ΔΔCt值计算分析。
采用固相多肽合成法,用PSSM-8型多肽自动合成仪(日本岛津公司),按照大鼠AT1R细胞外第二环表位肽段人工合成抗原多肽,合成多肽为AT1R的第165~191位氨基酸残基片段。用高压液相色谱分析,合成肽的纯度>95%。此合成肽段由华中科技大学心血管免疫实验室人工合成并馈赠。采用酶联免疫吸附试验(ELISA)法检测AT1-AA。研究血清与阴性血清的光密度(D)值之比 (标本D值-空白对照D值)/(阴性对照D值-空白对照D值),超过2.1倍者判为抗体检测阳性。
提取心脏总蛋白,BCA法测定蛋白浓度。以75 μg总蛋白样品上样。10% SDS-PAGE分离,PVDF膜印迹。将PVDF膜用5%脱脂奶粉室温封闭2 h,加AT1R一抗(1500)、PI3K一抗(11 000)、p-Akt一抗(1600)和GAPDH一抗(11 000)4℃孵育过夜,然后加入辣根过氧化物酶HRP标记的二抗孵育2 h。加入ECL发光剂,于暗室中经X线显影、定影。凝胶成像系统半定量分析测得灰度值,以AT1R、PI3K和p-Akt与相应的GAPDH条带所测灰度值的比值进行蛋白的半定量分析。
具体操作按试剂盒说明书进行。
采用SPSS 18.0软件进行统计学分析,数据以 ±s表示,组间差异采用两独立样本t检验进行比较,检验水准(α)为0.05。
建模后,甲亢组、甲亢+奥美沙坦组大鼠表现出易激惹症状,摄食、饮水量明显增加。实验结束时各组大鼠一般参数见表1。由表1可见,与对照组比较,甲亢组、甲亢+奥美沙坦组大鼠血清FT3、FT4升高,TSH下降,BW增长缓慢,HR增快。甲亢组、甲亢+奥美沙坦组大鼠HWI增加,与对照组相比差异均有统计学意义(P<0.05,P<0.05);甲亢组大鼠HWI亦高于甲亢+奥美沙坦组大鼠(P<0.05)。RT-PCR法检测结果显示,甲亢组和甲亢+奥美沙坦组大鼠心肌组织ANP mRNA相对表达量比对照组升高(P均<0.01),而且甲亢+奥美沙坦组大鼠心肌组织ANP mRNA表达比甲亢组降低(P<0.05,图 1)。
 | 图1 RT-PCR检测各组大鼠 心肌组织ANP mRNA的表达 Fig 1 Expression of ANP mRNA in myocardium tissues of rats in three groups by RT-PCR ANP: Atrial natriuretic peptide. 1: Hyperthyroidism group; 2: Hyperthyroidism+olmesartan group; 3: Control group. *P<0.05, **P<0.01. n=18, ±s |
各组大鼠血清AT1-AA的ELISA检测结果见表 1。由表 1可见,甲亢组、甲亢+奥美沙坦组大鼠AT1-AA水平和阳性率均高于对照组(P<0.01或P<0.05)。
| 表1 各组大鼠一般参数及AT1-AA检测结果比较Tab 1 Comparison of general data and results of AT1-AA between different groups N=18 |
 | 图2 蛋白质印迹分析检测各组 大鼠心肌组织AT1R的表达 Fig 2 Expression of AT1R protein in myocardium tissue of rats in three groups by Western blotting analysis AT1R: Angiotensin Ⅱ type 1 receptor. 1: Hyperthyroidism group; 2: Hyperthyroidism+olmesartan group; 3: Control group. *P<0.05, **P <0.01. n=18, ±s |
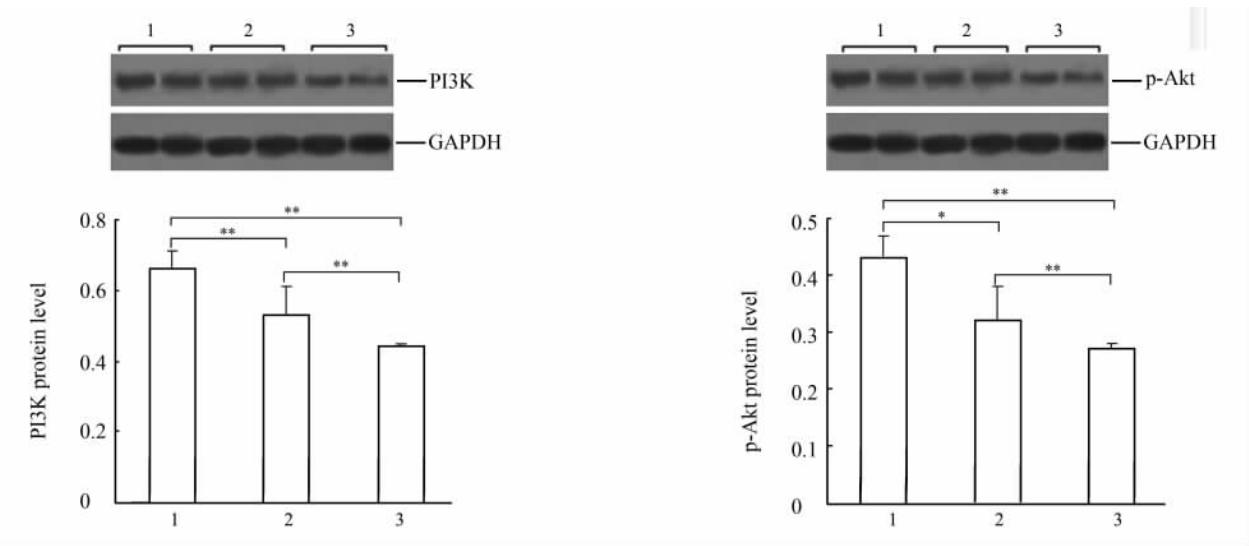 | 图3 蛋白质印迹分析检测各组大鼠心肌组织PI3K/Akt的表达Fig 3 Expression of PI3K/Akt in myocardium tissues of rats in three groups by Western blotting analysis A: Upper urinary tract CEUS shows the 2nd physiological stricture (arrow); B: Upper urinary tract CEUS shows that the ureter was seriously narrowed (arrow); C: SonoVue shows in bladder(BL)-the ureter was incompletely obstructed; D: Surgical specimen, the markedly thickened ureteral wall. Pathologic diagnosis reveales segmental submucous inflammation and fibroplasias. CEUS: Contrast-enhanced ultrasonography; LUR: Lower ureter |
将甲亢大鼠按AT1-AA检测结果分为AT1-AA阳性组(11/18, 61.11%)和AT1-AA阴性组(7/18, 38.89%)。结果显示,PI3K和p-Akt的表达水平在AT1-AA阳性组甲亢大鼠分别为0.68±0.06和0.45±0.03,高于AT1-AA阴性组甲亢大鼠的0.63±0.03和0.40±0.01,差异具有统计学意义(P均<0.01,图 4A、 4B)。
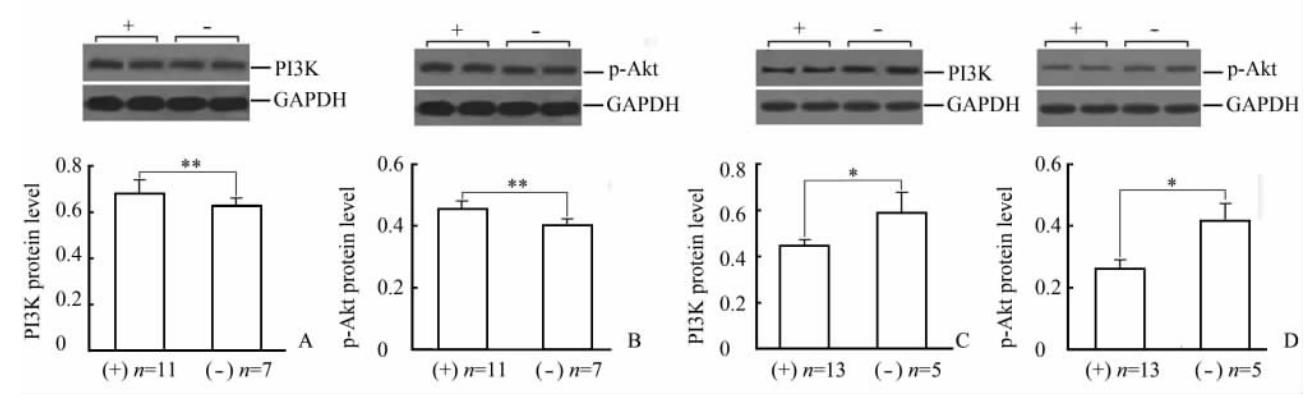 | 图4 甲亢与甲亢+奥美沙坦两组大鼠的AT1-AA阳性组与AT1-AA阴性组心肌组织PI3K/Akt的表达Fig 4 Expression of PI3K/Akt in AT1-AA positive and negative groups in hyperthyroidism and hyperthyroidism+olmesartan ratsPI3K: Phosphatidylinositol 3 kinase; Akt: Protein kinase B. A,B: Hyperthyroidism rats; C,D: Hyperthyroidism+olmesartan rats. *P<0.05, **P<0.01. ±s |
将甲亢+奥美沙坦大鼠按AT1-AA检测结果分为AT1-AA阳性组(13/18, 72.22%)和AT1-AA阴性组(5/18, 27.78%)。与AT1-AA阴性组甲亢大鼠比较,AT1-AA阳性组甲亢大鼠心肌组织PI3K和p-Akt表达水平降低 (0.44±0.03 vs 0.58±0.07, P<0.05; 0.26±0.03 vs 0.41±0.06, P<0.05),见图 4C、4D。
已有研究证实,肾素-血管紧张素系统(rennin-angiotensin system, RAS)在甲亢心肌肥大中意义重大[9 ,10,11,12]。目前认为RAS的效应分子血管紧张素Ⅱ (angiotensin Ⅱ, AngⅡ)主要是通过AT1R发挥生物学效应的。该受体广泛分布于心脏、肾脏及血管平滑肌细胞等部位,其过度激活能引发多种病理生理改变[13,14]。鉴于RAS 在甲亢心肌肥大的发生、发展中起着十分重要的作用,因而该系统的主要受体AT1R与甲亢心肌肥大的关系也受到广泛重视。AT1R是一种膜表面蛋白,为G蛋白偶联受体(G-protein-coupled-receptors,GPCR)成员之一,当受到反复病理性刺激后诱导机体自身免疫反应产生AT1-AA。AT1-AA是针对AT1R细胞外第二环肽的特异性抗体,通过与AT1R特异性结合后产生病理激动剂样效应引起组织损伤,成为独立于AngⅡ以外的另一条刺激AT1R的通路,该抗体可能是RAS中另一重要的致病因子[15]。罗余生等[16]通过主动免疫AT1R细胞外第二环多肽片段诱导大鼠产生AT1-AA,发现大鼠心肌细胞出现线粒体增多、肿胀,嵴溶解消失,基质密度降低,甚至呈囊泡状,肌丝排列不整,肌原纤维溶解、断裂等电镜下病理改变;金珠等[17]发现从免疫大鼠血清中提取的抗体可使心肌细胞体积增大,蛋白合成增加;Okruhlicova 等[18]发现,AT1-AA可使心肌肥大细胞的免疫荧光反应增强,胞内颗粒增大,对肥大细胞的形态和功能有调变作用,而心肌肥大细胞与病理情况下心肌组织重构有密切关系。以上研究均提示该抗体具有介导心脏重构的作用。但是,目前关于AT1-AA与甲亢心肌肥大相关性研究的报道尚少。
本研究采用定时定量给予L-thy建立甲亢大鼠模型,通过检测AT1-AA结果可知甲亢大鼠AT1-AA阳性率和D值均高于对照组,同时,甲亢大鼠心肌肥大指标HWI及ANP mRNA亦高于正常大鼠,而给予奥美沙坦的甲亢大鼠上述指标低于未给予血管紧张素受体拮抗剂的甲亢大鼠,提示该自身抗体可能介导并参与了甲亢心肌肥大的发生、发展。抗GPCR自身抗体通过特异性识别相应受体的细胞外第二环肽功能表位肽段诱导自身免疫反应,并对各受体表现出不随时间而失敏感的激动剂样刺激效应[19,20],持续过度的病理性刺激效应可能是引起心脏功能异常和病理性改变的重要原因[21]。
目前已证实,PI3K/Akt信号通路激活可导致心肌细胞肥大的发生[22],而PI3K为GPCR的主要下游效应器, PI3K的下游信号分子Akt磷酸化才能行使其生物学功能。近年来研究表明,甲亢时PI3K/Akt信号通路激活可引起心肌细胞不可逆性肥大[7, 23],一方面THs可直接作用于甲状腺素受体激活此条信号通路;另一方面AngⅡ通过细胞膜上的GPCRs也可激活此条信号通路[24]。但AT1-AA致甲亢心肌肥大是否与PI3K/Akt信号通路有关尚需进一步研究。我们发现甲亢大鼠PI3K和p-Akt表达高于正常大鼠,而甲亢+奥美沙坦组大鼠上述分子的表达较甲亢组下降;基于AT1R为AT1-AA的主要效应分子及其在PI3K/Akt信号通路中的重要作用[8],我们同时检测了各组大鼠AT1R表达,结果表明甲亢大鼠AT1R表达水平较正常大鼠升高。因此,推测AT1-AA致甲亢心肌肥大的发生可能与AT1R及PI3K/Akt信号通路参与有关。为深入探讨AT1-AA与PI3K/Akt信号通路的关系,我们进一步研究发现,在甲亢组及甲亢+奥美沙坦组大鼠中,前者AT1-AA阳性大鼠PI3K/p-Akt的表达高于AT1-AA阴性大鼠,而后者AT1-AA阳性大鼠上述分子的表达明显降低,说明AT1-AA可能通过AT1R激活PI3K/Akt信号通路而致甲亢心肌肥大的产生,给予AT1R拮抗剂奥美沙坦后,PI3K/Akt信号通路明显受到抑制。上述研究结果证实,AT1-AA可能通过AT1-AA/AT1R/PI3K/Akt信号通路导致甲亢心肌肥大的发生与发展。
本研究结果提示AT1-AA另一种激活PI3K/Akt信号通路的刺激因子,AT1-AA/AT1R/PI3K/Akt信号通路的激活是甲亢心肌肥大发生、发展的重要原因之一。因此,对于AT1-AA阳性的甲亢性心脏病患者有针对性地给予血管紧张素受体拮抗剂或直接清除体内AT1-AA,阻止AT1-AA对心肌细胞的靶向攻击,抑制PI3K/Akt信号通路的激活,有可能阻止或逆转甲亢心肌肥大的发生。
所有作者声明本文不涉及任何利益冲突。
| [1] | Wallukat G, Homuth V, Fischer T, Lindschau C, Horstkamp B, JÜpner A, et al.Patients with preeclampsia develop agonistic autoantibodies against the angiotensin AT1 receptor[J].J Clin Invest, 1999, 103:945-952. |
| [2] | 张 麟, 杨新春, 刘秀兰, 缪国斌, 王树岩, 张 健.扩张型心肌病与抗G-蛋白偶联受体的自身抗体[J].中华心血管病杂志, 2002, 30:363-365. |
| [3] | 张 麟, 吴雅峰, 缪国斌, 张 磊, 刘瑞红, 刘秀兰.心力衰竭患者与心脏β2、α1肾上腺素能受体和血管紧张素Ⅱ1型受体的自身抗体[J].中华心血管病杂志, 2003, 1:17-20. |
| [4] | 赵林双, 谭学莹, 向光大, 王 敏, 周子华, 孙慧玲, 等.2型糖尿病患者α1肾上腺素能受体和血管紧张素Ⅱ1型受体自身抗体与冠状动脉性心脏病的关系[J].中华高血压杂志, 2012, 5:452-456. |
| [5] | 仇 燕, 朱 峰, 廖玉华, 李正在, 王 敏.高血压病患者血清抗血管紧张素Ⅱ1型受体自身抗体与心脏重构的相关分析[J].中华心血管病杂志, 2007, 35:1141-1144. |
| [6] | 徐金玲, 赵林双, 王 敏.血管紧张素Ⅱ1 型受体、α1 和β1肾上腺素能受体自身抗体与甲状腺毒症性心脏病相关性分析[J].中华内分泌代谢杂志, 2013, 29:774-778. |
| [7] | Kuzman J A, O'Connell T D, Gerdes A M.Rapamycin prevents thyroid hormone-induced cardiac hypertrophy[J].Endocrinology, 2007, 148:3477-3484. |
| [8] | Diniz G P, Carneiro-Ramos M S, Barreto-Chaves M L.Angiotensin type 1 receptor mediates thyroid hormone-induced cardiomyocyte hypertrophy through the Akt/GSK-3beta/mTOR signaling pathway[J].Basic Res Cardiol, 2009, 104:653-667. |
| [9] | Hu L W, Benvenuti L A, Liberti E A, Carneiro-Ramos M S, Barreto-Chaves M L.Thyroxine-induced cardiac hypertrophy: influence of adrenergic nervous system versus renin-angiotensin system on myocyte remodeling[J].Am J Physiol Regul Integr Comp Physiol, 2003, 285:R1473-R1480. |
| [10] | Diniz G P, Takano A P, Barreto-Chaves M L.MiRNA-208a and miRNA-208b are triggered in thyroid hormone-induced cardiac hypertrophy-role of type 1 angiotensin Ⅱ receptor (AT1R) on miRNA-208a/α——MHC modulation[J].Mol Cell Endocrinol, 2013, 374(1-2):117-124. |
| [11] | Diniz G P, Carneiro-Ramos M S, Barreto-Chaves M L.Angiotensin type 1 (AT1) and type 2 (AT2) receptors mediate the increase in TGF-beta1 in thyroid hormone-induced cardiac hypertrophy[J].Pflugers Arch, 2007, 454:75-81. |
| [12] | Carneiro-Ramos M S, Diniz G P, Nadu A P, Almeida J, Vieira R L, Santos R A, et al.Blockage of angiotensin Ⅱ type 2 receptor prevents thyroxine-mediated cardiac hypertrophy by blocking Akt activation[J].Basic Res Cardiol, 2010, 105:325-335. |
| [13] | Mczewski1 M, Mczewska J, Duda M.Hypercholesterolaemia exacerbates ventricular remodeling after myocardial infraction in the rat: role of angiotensin Ⅱ type 1 receptors[J].Br J Pharmacol, 2008, 154:1640-1648. |
| [14] | Yang X, Wang F, Chang H, Zhang S, Yang L, Wang X, et al.Autoantibody against AT1 receptor from preeclamptic patients induces vasoconstriction through angiotensin receptor activation[J].J Hypertens, 2008, 26:1629-1635. |
| [15] | 周子华, 廖玉华, 王 敏, 程龙献, 魏宇淼, 王朝晖.高血压脑卒中患者血浆抗血管紧张素Ⅱ受体1型自身抗体的作用[J].中国临床康复, 2004, 31:6944-6949. |
| [16] | 罗余生, 廖玉华, 王 敏, 魏宇淼, 董继华, 王金萍, 等.AT1-受体多肽诱导大鼠免疫损伤反应及其药物干预的研究[J].高血压杂志, 2002, 10:143-148. |
| [17] | 金 珠, 王 瑾, 张文慧, 王小芳, 支建明.AT1受体抗体对大鼠心肌结构和功能的影响[J].现代免疫学, 2010, 30:202-206. |
| [18] | Okruhlicova L, Morwinski R, Schulze W, Bartel S, Weismann P, Tribulova N, et al.Autoantibodies against G-protein-coupled receptors modulate heart mast cells[J].Cell Mol Immunol, 2007, 4:127-133. |
| [19] | Matsui S, Fu M.Pathological importance of anti-G-protein coupled receptor autoantibodies[J].Int J Cardiol, 2006, 112:27-29. |
| [20] | Wallukat G, Fu M L, Magnusson Y, Hjalmarson A, Hoebeke J, Wollenberger A.Agonistic effects of anti-peptide antibodies and autoantibodies directed against adrenergic and cholinergic receptors: absence of desensitization[J].Blood Press Suppl, 1996, 3:31-36. |
| [21] | Yoshikawa T, Baba A, Nagatomo Y.Autoimmune mechanisms underlying dilated cardiomyopathy[J].Circ J, 2009, 73:602-607. |
| [22] | Shioi T, Kang P M, Douglas P S, Hampe J, Yballe C M, Lawitts J, et al.The conserved phosphoinositide 3-kinase pathway determines heart size in mice[J].EMBO J, 2000, 19:2537-2548. |
| [23] | Kenessey A, Ojamaa K.Thyroid hormone stimulates protein synthesis in the cardiomyocyte by activating the Akt-mTOR and p70S6K pathways[J].J Biol Chem, 2006, 281:20666-20672. |
| [24] | Ojamaa K.Signaling mechanisms in thyroid hormone-induced cardiac hypertrophy[J].Vascul Pharmacol, 2010, 52(3-4):113-119. |
 2014, Vol. 35
2014, Vol. 35


