2. 南通大学附属医院消化内科, 南通 226000;
3. 南通大学附属医院病理科, 南通 226000;
4. 南通市如皋港人民医院外科, 如皋 226532
2. Department of Gastroenterology, Affiliated Hospital of Nantong University, Nantong 226000, Jiangsu, China;
3. Department of Pathology, Affiliated Hospital of Nantong University, Nantong 226000, Jiangsu, China;
4. Department of Surgery, People's Hospital of Rugao Port, Rugao 226532, Jiangsu, China
胃癌是常见的恶性肿瘤之一,居全世界癌症死亡原因的第2位,我国属于胃癌的高发地区,胃癌患者总体预后尚不理想,5年总体生存率仅25%[1,2]。鸟苷酸环化酶C(GC-C)是鸟苷酸环化酶家族成员之一,是一种N连接糖蛋白受体,常分布于绒毛肠细胞顶端,如正常小肠黏膜上皮和原发或继发大肠肿瘤,而肠外组织(如正常食管和胃上皮组织)不表达[2]。前期研究[3,4]发现,GC-C mRNA和蛋白在胃癌组织中出现异位表达,且胃癌患者外周血GC-C mRNA表达与病情进展有关。因此,本研究采用实时荧光定量PCR(RFQ-PCR)技术检测胃癌患者外周血GC-C mRNA表达水平,并探讨其可能的临床价值。 1 材料和方法 1.1 主要试剂及仪器
TRIzol试剂、Prime ScriptTM RT试剂盒和SYBR Premix Ex TaqTM Ⅱ试剂盒购自大连宝生物有限公司,淋巴细胞分离液购自天津中国医学科学院血液学研究所,β-肌动蛋白和GC-C引物由生工生物工程(上海)股份有限公司设计合成,焦碳酸二乙酯(DEPC)为上海捷瑞公司产品,纯水处理仪812-3为上海宝尔公司产品,立式压力蒸气灭菌锅(YXQ-LS-75SII)为上海博迅公司产品,低温冷冻离心机(ALLEGRA X-15R)为美国Beckman公司产品,烘箱(BHG-9243BS)为上海新苗公司产品,-80℃冰箱(MDF-U71V型)为日本Sanyo公司产品,RFQ-PCR仪为杭州博日公司产品。 1.2 样本来源
收集2009年11月至2010年8月南通大学附属医院普通外科及南通市如皋港人民医院外科住院60例胃癌患者,术前一次性采集外周血5 mL,采血时间均为手术前48 h以内,抽取同时期门诊15例胃肠上皮化生和21例胃异型增生患者及20例健康体检者外周血各5 mL。患者年龄32~81岁,其中男性42例、女性18例。术前均未行放化疗和其他抗肿瘤治疗,外周血标本采集后立即置入液氮速冻后转至-80℃冰箱保存备用。
所有标本切片均由两位病理科医师双盲法核片确定病理类型。所有肿瘤患者均行D2胃癌根治术,术后记录病理类型、临床分期、组织学分级、浸润深度、淋巴转移等参数。胃癌患者的TNM分期依照美国癌症联合委员会(AJCC)制定的胃癌TNM分期第7版标准判定。所有患者术后均行XELOX方案化疗6个周期,均未放疗。60例胃癌患者中肿瘤组织<5 cm 32例,≥5 cm 28例;肠型胃癌28例,弥漫型胃癌32例;Ⅰ~Ⅱ期胃癌26例,Ⅲ~Ⅳ期胃癌34例;淋巴结转移19例,无淋巴结转移41例;肿瘤未浸润浆膜层17例,浸润浆膜及以外43例;高中分化癌29例,低分化癌31例。本研究入组患者和对照组术前均行胃镜检查和活检病理确诊,并行电子肠镜检查排除了大肠肿瘤。本研究经南通大学附属医院医学伦理委员会批准,并获得所有患者及受试者知情同意。 1.3 实验方法 1.3.1 总RNA提取
将抽取的外周血用单核细胞分离液分离单个核细胞(PBMC),按照说明书应用TRIzol试剂提取PBMC总RNA。取已分离的外周血PBMC悬液放于1.5 mL Eppendorf管中,加入TRIzol 1 mL,室温静置5 min,再加入0.2 mL氯仿,振荡15 s,静置2 min。4℃离心,12 000 g×15 min,取上清;随后加入0.5 mL异丙醇,混匀后静置10 min。4℃离心12 000 g×10 min,弃上清。加1 mL 75%乙醇,轻轻洗涤沉淀。4℃离心7 500 g×5 min,弃上清。再次加入1 mL 75%乙醇,轻轻洗涤沉淀。再次4℃离心7 500 g×5 min,弃去上清。真空离心干燥后加入30 μL DEPC,水浴箱内65℃促溶15 min。检测RNA浓度后分装,-80℃保存。 1.3.2 cDNA合成
总RNA 1 μg、引物1 μg、DEPC H2O补齐至12 μL,70℃孵育5 min,置冰上;加5×反应缓冲液 4 μL、RNA酶抑制剂1 μL、10 mmol/L dNTP混合液 2 μL,37℃孵育5 min,置冰上;加 Revert AidTM M-Mulv反转录酶1 μL,42℃ 60 min;70℃10 min。反转录成cDNA后分装,-20℃保存。 1.3.3 实时荧光定量PCR检测
从GenBank查取GC-C和β-肌动蛋白基因序列,以Primer 5软件分别设计引物各1对由上海生工生物工程公司合成,序列如下,GC-C:上游,5′ -CAA CCT GAC CAA GTT CTA CGG-3′,下游,5′-AAT GTG CCA TCA GGG TAG GA-3′,预计扩增产物长度126 bp;β-肌动蛋白:上游,5′ -TGA CGT GGA CAT CCG CAA AG-3′,下游,5′-CTG GAA GGT GGA CAG CGA GG-3′,预计扩增产物长度205 bp。PCR反应体系:SYBR Premix Ex TaqTM 12.5 μL,PCR 上游引物1.0 μL,PCR下游引物1.0 μL,模板2.0 μL,无菌水8.5 μL,总体积 25 μL。PCR扩增条件:95℃ 30 s预变性,95℃ 5 s,60℃ 30 s,共40循环。确认RFQ-PCR扩增曲线和融解曲线分别读取各样本实时PCR扩增曲线所对应的循环次数。在相同的条件下实验重复3次。Ct值>35认为该基因不表达,即为阴性。 1.4 术后随访
纳入标准:(1)经病理检测证实为胃腺癌;(2)切缘无癌细胞残留;(3)术前行外周血GC-C mRNA检测;(4)术前未行新辅助化疗;(5)术后行XELOX方案化疗6个周期。采用门诊随访为主结合电话随访。随访时检查CEA、胃镜、腹部B超、CT或MRI等。术后第1年每3个月随访,术后1~4年每6个月随访,胃癌组随访自手术后起,终点指标:(1)残胃复发或食管空肠吻合口复发;(2)死亡,或者生存者随访至2014年7月31日。 1.5 统计学处理
采用SPSS 17.0统计软件进行分析,率的比较采用χ2检验或Fisher确切概率法,偏态分布计量资料采用中位数和范围表示以及Wilcoxon秩和检验,Kaplan-Meier法计算各组生存率,Log-rank法进行显著性检验,检验水准(α)为0.05。 2 结 果
2.1 胃癌患者术前外周血GC-C mRNA的表达水平
健康体检者外周血中未检测到GC-C mRNA表达,在肠上皮化生和异型增生患者外周血中分别检测到2例和3例阳性,表达阳性率分别为9.5%和20.0%;而胃癌患者术前外周血GC-C mRNA的阳性率较高,为48.3%(29/60),与健康体检者、肠上皮化生和异型增生患者比较,差异均有统计学意义(P<0.05)。在肠型胃癌患者外周血中GC-C mRNA表达高于弥漫型胃癌,并且与胃癌临床TNM分期、浸润深度、淋巴结转移和分化程度相关(P<0.05或0.01,表 1),而与性别、年龄及肿瘤大小等因素无关。
|
|
表 1 胃癌患者术前外周血GC-C mRNA的表达与临床病理特征的关系 |
60例胃癌患者中,术后1年肿瘤复发17例,复发率为28.3%;术后2年累计肿瘤复发36例,累计复发率为60.0%;术后3年累计肿瘤复发49例,累计复发率为81.7%;术后4年累计肿瘤复发54例,累计复发率为90.0%。其中,GC-C阳性29例,GC-C阴性31例,GC-C阳性患者术后1年、2年、3年和4年的累计复发率高于GC-C阴性患者(P<0.05,P<0.01),且GC-C阳性患者术后中位复发时间短于GC-C阴性患者,差异有统计学意义(P<0.01,表 2)。
|
|
表 2 胃癌患者术后累计复发率和中位复发时间 |
随访60例胃癌患者的资料表明:术后4年内累计死亡47例,占总人数的78.3%。其中,术前外周血GC-C mRNA阴性表达患者4年生存率高于术前阳性表达患者,差异有统计学意义(P<0.05,图 1)。
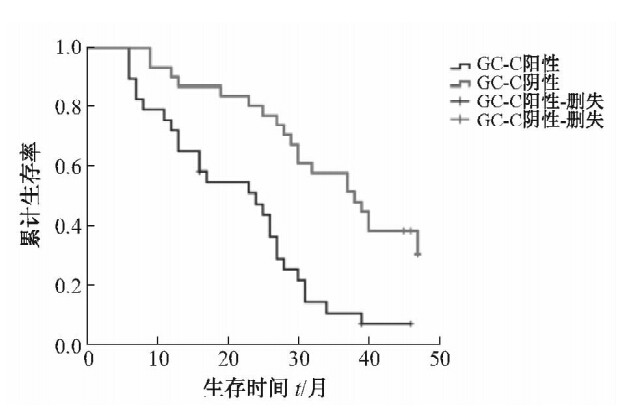
|
图 1 胃癌患者术前外周血GC-C mRNA阳性与阴性患者生存曲线的对比 |
GC-C可作为大肠癌微转移的生物学指标,与CK19、CK20、CEA等相比,GC-C有较高的肠道组织特异性和较低的假阳性率,外周血GC-C mRNA的表达能早期监测大肠癌患者术后复发和转移[5]。既往研究提示GC-C在胃腺癌发生、发展过程中可能发挥重要作用,Hp感染可能参与GC-C的致瘤调节[3,6,7]。然而,GC-C表达与胃癌预后关系的研究目前鲜有报道。本研究结果发现,在健康体检者未检测到GC-C mRNA的表达,肠上皮化生及异型增生患者外周血中表达阳性率很低,而胃癌患者术前外周血中检测到GC-C mRNA阳性表达,临床病理分期Ⅲ~Ⅳ期、淋巴转移、低分化和浆膜外浸润胃癌患者GC-C mRNA阳性率显著高于Ⅰ~Ⅱ期、无淋巴结转移、高中分化和浆膜内浸润患者(P<0.05或P<0.01)。GC-C阳性患者术后中位复发时间明显短于GC-C阴性患者,两组术后1~4年累计肿瘤复发率及中位复发时间比较差异有统计学意义(P<0.05或P<0.01)。因此,对于术前GC-C阳性患者,尤其是含量较高的患者,应视为术后复发和转移的高危患者,应对其加强术后监测,及时辅助治疗,必要时术前进行新辅助化疗。
综上所述,胃癌患者术前外周血GC-C mRNA有较高的阳性率,其与胃癌患者病情进展有关,可能作为一种有效预测胃癌术后复发的生物学标记物,通过对GC-C mRNA的检测有助于了解患者的预后、评价手术效果,也有助于选择最有效的治疗方案尽可能延长患者的生命。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Siegel R,Naishadham D,Jemal A.Cancer statistics, 2012[J].CA Cancer J Clin,2012,62:10-29. |
| [2] | Chen W,Zheng R,Zhang S,Zhao P,Li G,Wu L,et al.Report of incidence and mortality in China cancer registries,2009[J].Chin J Cancer Res,2013,25:10-21. |
| [3] | 毛振彪,许 钟,张健锋,朱慧君,章建国,潘正平.鸟苷酸环化酶C和尾型同源盒转录因子2在胃癌及癌前病变组织中的表达及意义[J].中华消化杂志,2008,28:673-677. |
| [4] | 张健锋,薛世民,张 弘,孟 海,朱惠君,毛振彪.胃癌患者外周血中鸟苷酸环化酶C信使RNA的表达及其临床意义[J].中华医学杂志,2012,92:371-375. |
| [5] | 毛振彪,王唯一,张冬雷,黄介飞,鞠少卿.实时荧光定量PCR检测大肠癌患者外周血鸟苷酰环化酶C基因及其临床意义[J].第二军医大学学报,2005,26:1252-1255. Mao Z B,Wang W Y,Zhang D L,Huang J F,Ju S Q.Real-time fluorescence quantitative reverse transcription PCR in determination of guanylyl cyclase-C gene expression in peripheral blood of patients with colorectal cancer and its clinical significance[J].Acad J Sec Mil Med Univ,2005,26:1252-1255. |
| [6] | Mao Z B,Zhang J F,Xu Z,Zhu H J,Zhang J G,Pan Z P,et al.Ectopic expression of guanylyl cyclase C in gastric cancer as a potential biomarker and therapeutic target[J].J Dig Dis,2009,10:272-285. |
| [7] | Zhang J F,Mao Z B,Li Z L,Xue S M,Zhu H J,Zhang H,et al.Ectopic expression of guanylyl cyclase C and endogenous ligand guanylin correlates significantly with Helicobacter pylori infection in gastric carcinogenesis [J].Med Oncol,2012,29:1748-1757. |
 2014, Vol. 35
2014, Vol. 35


