帕金森病(Parkinson disease,PD)的发病率仅次于阿尔茨海默症,是一种进行性神经元退行性疾病,患者主要的临床症状包括静止性震颤、运动减少、僵硬和姿势失衡等[1, 2]。这些临床症状主要是由于黑质多巴胺(dopamine,DA)神经元进行性死亡、存活的神经元胞质内路易小体形成、局部胶质细胞增生和纹状体DA缺失,以及黑质与纹状体之间的神经通路变性和缺失所致的[3, 4, 5]。1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)可透过血脑屏障,进入脑内后转化成活性毒素分子1-甲基-4-苯基吡啶离子(l-methyl-4-phenylpyridinium,MPP+),MPP+可被选择性转运入DA能神经元,损伤DA能神经元。因此,MPTP作为制备PD动物模型的经典神经毒素,能在动物或人体诱发PD样病理和行为学改变[6]。
DA受体家族是多巴胺信号系统的重要成员,其在众多的神经活动,包括自主运动、情感、奖赏等高级功能中发挥着重要的作用[7]。DA受体包括D1-like受体(dopamine D1-like receptor)和D2-like受体(dopamine D2-like receptor)两型,D1-like受体又包括D1和D5受体亚型;D2-like受体包括D2、D3和D4受体亚型。许多证据显示,多种DA受体亚型在运动功能调控中起关键作用,并与PD发病机制有关。大量数据表明DA受体家族中D2受体与帕金森病有着紧密的关系[8, 9]。动物实验表明,黑质纹状体DA神经递质的慢性损伤会导致纹状体多巴胺靶细胞超敏,并被认为与纹状体D2 受体有关,后经原位杂交证实,在6-羟多巴胺诱导的帕金森病大鼠,纹状体D2 受体mRNA 的表达增加,长期应用D2受体激动剂则可逆转这种上调效应[10]。有研究报道,D2 受体可能是遗传性帕金森病的相关基因[11],老龄D2受体敲除小鼠可表现出PD样病理特征,如神经元丢失及形成聚集体等[12]。D2受体激动剂对部分PD患者有一定的治疗效果[13]。
基于此,本研究采用多巴胺D2受体基因敲除的小鼠,以MPTP致帕金森病小鼠模型,通过爬杆实验、游泳实验,免疫组化染色观察酪氨酸羟化酶(TH)阳性多巴胺神经元的变化来探讨多巴胺D2受体在运动协调方面的作用,以及与PD病理表现之间的关系,为PD的临床诊治提供参考建议。
1 材料和方法 1.1 动物来源及处理8周龄雄性健康成年C57BL/6 野生型(WT)小鼠由南通大学实验动物中心提供。Drd2(B6.129S2-Drd2tm1Low/J)杂合子小鼠来自美国Jackson实验室。本实验选用通过10代回交所得的C57BL/6(自交系)背景的D2全身敲除小鼠(D2-/-),小鼠体质量为25~30 g。全价颗粒饲料喂养,自由饮水,室温保持在(24 ± 1)℃,每天交替进行12 h光照,12 h黑暗。实验前,将动物置于实验环境适应3 d。所有程序均按照美国国立实验动物保护和使用卫生指南执行,并获得动物保护和使用委员会批准。
1.2 PD小鼠模型的制备实验分为4组:对照组、生理盐水组、PD 模型组(均为野生型C57BL /6小鼠)及D2受体敲除的PD模型组。MPTP(购自Sigma公司,美国)溶于生理盐水,配成浓度5 mg/mL,两种PD模型组经腹腔注射MPTP,每只小鼠按照每次20 mg/kg体质量注射,间隔2 h注射1次,共注射4次,1 d内注射完,上午9:00注射第1针,11:00注射第2针,13:00注射第3针,15:00注射最后一针。6 d后,动物进行行为学检测,第7天处死,取材检测中脑腹侧黑质致密部TH阳性神经元数目。
1.3 爬杆实验为检测C57BL /6小鼠肢体运动协调情况,将一直径为1.5 cm 的软木球固定于1根长50 cm、直径1 cm 的木杆顶端,木杆上缠上纱布以增加摩擦,然后将杠竖直放置,被测小鼠头朝上放置于软木球下方不远处,记录下小鼠上到小球上至折返回到杆底部所需时间。在MPTP注射前1周,每天在上午9:00对小鼠进行爬杆训练,共训练7次,剔除差异特别大的小鼠以减小实验误差。小鼠造模6 d后,再次对其进行爬杆实验,记录爬杆时间。
1.4 游泳实验将受试小鼠放入1个20 cm × 30 cm × 20 cm的有机玻璃水箱中,水深10 cm,水温为24~25℃。评分标准如下:在1 min内四肢无活动者记为0分;偶尔用后肢浮动并漂浮在水箱一边者记1.0分;偶尔游泳者记为1.5分;漂浮时间占整个受试时间50%以上者记为2.0分;大部分时间游泳,仅偶尔漂浮者记为2.5分;连续不断游泳者记为3.0分;间隔1 min检测1次,共检测10 min,取平均值。
1.5 免疫荧光染色各组小鼠行为学检测后,用4%甲醛溶液灌注固定,取脑,沉糖后进行冰冻切片,切片厚度为25 μm,隔3张取1张。根据Franklin和Paxinos[7]小鼠脑图谱,挑选每只小鼠的黑质致密部(substantia nigra pars compacta,SNpc)的10张实验切片进行TH免疫荧光染色。切片先用0.01 mol/L PBS (pH 7.4) 洗涤3次,每次10 min;然后用10%正常山羊血清室温封闭30 min;吸弃血清,加小鼠抗TH抗体(1∶400),4℃孵育48 h,加FITC标记的山羊抗小鼠抗体(1∶100),4℃孵育16 h。上述步骤之间均用0.01 mol/L PBS洗涤切片3次,每次10 min。甘油/PBS(体积比1∶1)封片,荧光显微镜摄片观察。采用捷达形态学分析系统对TH阳性神经元的数目进行统计,计数每只小鼠10张切片的TH阳性神经元总数。
1.6 统计学处理采用SPSS 11.0统计软件,计量资料用x±s表示,方法采用单因素方差分析,进一步两两比较采用SNK-q检验,检验水准(α)为0.05。
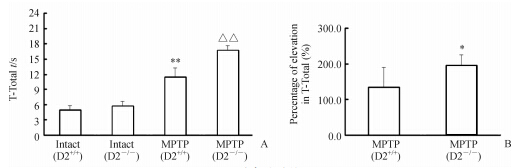
2 结 果 2.1 爬杆实验结果表明:野生型小鼠(D2+/+)和D2受体基因敲除小鼠(D2-/-)在注射MPTP之后,爬杆时间均长于相应空白对照组,差异有统计学意义(P<0.01),且D2-/-组小鼠在注射MPTP之后的爬杆时间延长得更明显(图 1A);且D2-/-组小鼠爬杆时间延长百分率较D2+/+组小鼠明显升高,差异有统计学意义(P<0.05,图 1B)。结果提示:注射MPTP之后小鼠的肢体运动协调能力下降,且D2-/-小鼠下降得更为明显。
|
图 1 爬杆实验结果 Fig 1 Results of pole test A: The time taken to reach the floor (T-Total). **P<0.01 vs intact (D2+/+); △△P<0.01 vs intact (D2-/-). B: Comparison of elevation in T-Toyal between wild type mice and D2 receptor gene knockout mice. The percentage of elevation in T-Total of wild type mice was (T-Total of MPTP [D2+/+] minus T-Total of Intact [D2+/+])/T-Total of Intact (D2+/+). The percentage of elevation in T-Total of D2 receptor gene knockout mice was (T-Total of MPTP [D2-/-] minus T-Total of Intact [D2-/-])/ T-Total of Intact (D2-/-),*P<0.05 vs MPTP (D2+/+). n=4,x±s |
结果表明:D2+/+和D2-/-小鼠在注射MPTP之后,游泳评分均明显低于相应的空白对照组,差异均有统计学意义(P<0.01),且D2-/-小鼠在注射MPTP之后的游泳评分降低得更明显(图 2A);D2-/-组小鼠游泳评分降低百分率较D2+/+组升高,差异有统计学意义(P<0.05,图 2B)。结果提示,注射MPTP之后小鼠的肢体运动协调能力下降,且D2受体基因敲除小鼠下降得更为明显。

|
图 2 游泳实验结果 Fig 2 Results of swimming test A: The swim scores were recorded. **P<0.01 vs intact (D2+/+),△△P<0.01 vs intact (D2-/-). B: Comparison of swimming score decrease between wild type mice and D2 receptor gene knockout mice. The percentage of decrease in swim score of wild type mice was (swim score of Intact [D2+/+] minus swim score of MPTP [D2+/+])/ swim score of Intact (D2+/+). The percentage of decrease in swim score of D2 receptor gene knockout mice was (swim score of Intact [D2-/-] minus swim score of MPTP [D2-/-])/ swim score of Intact (D2-/-). *P<0.05 vs MPTP (D2+/+); n=4,x±s |
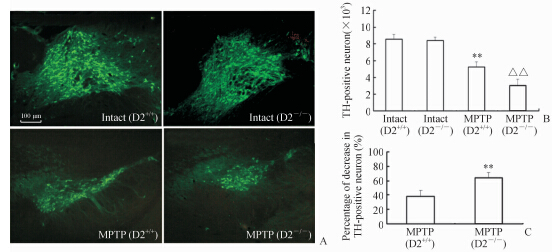
结果表明:不管是野生型,还是D2受体基因敲除小鼠,在未注射MPTP之前,其SNpc部位分布着较多的TH阳性神经元,层叠排列,神经元突起较多;而在注射MPTP之后,野生型小鼠模型组和D2受体基因敲除小鼠模型组的SNpc内TH阳性神经元数量明显减少,差异具有统计学意义(P<0.01),且D2受体基因敲除小鼠模型组SNpc内TH阳性神经元数量的降低比野生型小鼠模型组更明显(图 3A、3B)。因此,本研究将D2受体基因敲除小鼠模型组和野生型小鼠模型组SNpc内TH阳性神经元降低百分率作比较(图 3C),发现D2受体基因敲除小鼠模型组SNpc内TH阳性神经元数目降低百分率较野生型小鼠模型组高,差异有统计学意义(P<0.01)。结果提示,小鼠腹腔注射MPTP特异性破坏了SNpc中TH阳性神经元,且D2受体基因敲除小鼠更严重。
|
图 3 免疫荧光染色结果 Fig 3 Results of TH-positive neurons A: Representative TH staining in the substantia nigra pars compacta. Seven days after the last MPTP injection,the TH-positive neurons were counted. B: TH-positive neurons were recorded. **P<0.01 vs intact (D2+/+); △△P<0.01 vs intact (D2-/-). C: Comparison of TH-positive neurons between wild type mice and D2 receptor gene knockout mice. The percentage of decrease in TH-positive neurons of wild type mice was (TH-positive neuron of Intact [D2+/+] minus TH-positive neuron of MPTP [D2+/+])/TH-positive neurons of Intact (D2+/+). The percentage of decrease in TH-positive neurons of D2 receptor gene knockout mice was (TH-positive neurons of Intact [D2-/-] minus TH-positive neuron of MPTP [D2-/-])/TH-positive neurons of Intact (D2-/-). **P<0.01 vs MPTP (D2+/+). n=4,x±s |
自从发现帕金森病、精神分裂症、药物成瘾等神经系统疾病与DA有关后,DA对躯体运动、认知和精神活动的重要性已逐渐被人们认识到[14]。这其中,DA受体所起的关键性作用不言而喻[15]。近年来,随着对日益增多的老年性疾病PD的研究,大量的证据表明多巴胺D2 受体与机体运动调控和神经炎症有着密切关系。本研究采用多巴胺D2受体基因敲除的小鼠,以MPTP致帕金森病小鼠为模型,对小鼠的行为学进行检测,结果发现注射MPTP后小鼠爬杆实验时间延长,游泳实验评分降低,说明注射MPTP后小鼠肢体运动协调能力下降;且D2受体基因敲除小鼠爬杆实验时间的延长及游泳实验评分的降低较野生型小鼠更为明显,说明DA D2受体的确在小鼠肢体运动协调方面起着重要作用,D2受体缺失使得MPTP所致PD样行为学改变更为严重;此外,本研究还对SNpc部位TH阳性神经元,即DA能神经元数目变化进行了检测,结果发现注射MPTP后,小鼠SNpc部位DA能神经元数目显著下降,呈现PD样改变,且与野生型小鼠相比,D2受体基因敲除小鼠SNpc部位DA能神经元数目下降更加严重。这些结果均提示,D2受体基因敲除小鼠对MPTP更加易感,且DA D2受体缺失加剧了MPTP诱导的帕金森病样改变。
有报道表明,在D2受体缺失的情况下,小鼠脑内多个区域均呈现显著的炎症反应,且这一反应随着年龄的增长逐渐增强[16]。在神经毒素MPTP诱导的PD小鼠动物模型中,D2受体的缺失加剧了胶质细胞的激活,使炎症反应更趋于严重,导致中脑DA能神经元对神经毒素更加敏感,死亡率上升[17],这些报道合理地解释了我们的研究结果。在我们的研究结果中,未注射MPTP的D2受体基因敲除鼠,不管是行为学方面还是脑内TH神经元的损伤方面,均没有表现出帕金森病样的改变,这可能是因为本实验所用小鼠均为8周的青壮年鼠。因此,只有在注射MPTP之后,D2受体基因敲除小鼠才表现出比野生型小鼠对MPTP这种神经毒素敏感性更高。
综上所述,本研究进一步拓展了人们对DA受体生理功能的理解,为今后选择合适靶点,有效地延缓脑衰老,干预神经退行性疾病提供了有价值的信息。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Jellinger K A.The pathology of Parkinson's disease [J].Adv Neurol,2001,86:55-72. |
| [2] | Langston J W.Parkinson's disease:current and future challenges[J].Neurotoxicology,2002,23:443-450. |
| [3] | Olanow C W,Tatton W G.Etiology and pathogenesis of Parkinson's disease[J].Annu Rev Neurosci,1999,22:123-144. |
| [4] | Dauer W,Przedborski S.Parkinson's disease: mechanisms and models[J].Neuron,2003,39:889-909. |
| [5] | Savitt J M,Dawson V L,Dawson T M.Diagnosis and treatment of Parkinson disease:molecules to medicine[J].J Clin Invest,2006,116:1744-1754. |
| [6] | Langston J W,Ballard P,Irwin I.Chronic parkinsonism in humans due to a product of meperidine-analog synthesis[J].Science,1983,219:979-980. |
| [7] | Girault J A,Greengard P.The neurobiology of dopamine signaling[J].Arch Neurol,2004,61:641-644. |
| [8] | Dai D,Wang Y,Wang L,Li J,Ma Q,Tao J,et al.Polymorphisms of DRD2 and DRD3 genes and Parkinson's disease:A meta-analysis[J].Biomed Rep,2014,2:275-281. |
| [9] | Jorg M,Scammells P J,Capuano B.The dopamine D2 and adenosine A2A receptors:past,present and future trends for the treatment of Parkinson's disease[J].Curr Med Chem,2014,21:3188-3210. |
| [10] | Jones S R,Gainetdinov R R,Caron M G.Application of microdialysis and voltammetry to assess dopamine functions in genetically altered mice:correlation with locomotor activity[J].Psychopharmacology,1999,147:30-32. |
| [11] | Oliveri R L,Annesi G,Zappia M,Civitelli D,De Marco E V,Pasqua A A,et al.The dopamine D2 receptor gene is a susceptibility locus for Parkinson's disease[J].Mov Disord,2000,15:127-131. |
| [12] | Tinsley R B,Bye C R,Parish C L,Tziotis-Vais A,George S,Culvenor J G,et al.Dopamine D2 receptor knockout mice develop features of Parkinson disease[J].Ann Neurol,2009,66:472-484. |
| [13] | Goldenberg M M.Medical management of Parkinson's disease[J].P T,2008,33:590-606. |
| [14] | Sherer T B,Betarbet R,Stout A K,Lund S,Baptista M,Panov A V,et al.An in vitro model of Parkinson's disease:linking mitochondrial impairment to altered alpha-synuclein metabolism and oxidative damage[J].J Neurosci,2002,22:7006-7015. |
| [15] | Ward C D,Duvoisin R C,Ince S E,Nutt J D,Eldridge R,Calne D B.Parkinson's disease in 65 pairs of twins and in a set of quadruplets[J].Neurology,1983,33:815-824. |
| [16] | Kaasinen V,Vilkman H,Hietala J,Ngren K,Helenius H,Olsson H,et al.Age-related dopamine D2/D3 receptor loss in extrastriatal regions of the human brain[J].Neurobiol Aging,2000,21:683-688. |
| [17] | Shao W,Zhang S Z,Tang M,Zhang X H,Zhou Z,Yin Y Q,et al.Suppression of neuroinflammation by astrocytic dopamine D2 receptors via αB-crystallin[J].Nature,2013,494:90-94. |
 2014, Vol. 35
2014, Vol. 35


