2. 重庆医科大学附属第一医院康复科, 重庆 400016
2. Department of Rehabilitation Medicine, The First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China
骨肉瘤在小儿恶性骨肿瘤患者中最常见,主要发生在儿童期和青春期,严重影响患者的生活质量[1, 2]。目前手术联合辅助化疗能提高患者生存率,但对反复发作转移和产生耐药性的骨肉瘤患者的预后仍然不佳[3, 4]。光动力疗法是通过肿瘤细胞吸收光敏剂,随后在肿瘤部位进行局部光照,产生细胞活性氧(ROS)杀伤肿瘤细胞达到靶向治疗,已被用于肿瘤的治疗中[5, 6, 7]。光动力疗法由于其独特的优点和良好的兼容性,在肿瘤的综合治疗中发挥重要作用。芦荟大黄素是从传统中药中提取的新型蒽醌化合物,已被证实具有抗肿瘤效应[8, 9, 10]。而且,研究表明芦荟大黄素具有一定的荧光性,可以作为一种很有前景的光敏剂[11, 12]。芦荟大黄素(AE)介导的光动力疗法(AE-PDT)能降低药物使用浓度从而减少药物毒性,同时能诱导细胞凋亡,具有一定的抗肿瘤效应[13, 14]。
自噬是真核细胞进化保守的降解自身细胞器或蛋白质的过程,在肿瘤的发生发展中起到重要作用。本研究旨在观察AE-PDT诱导人骨肉瘤MG63细胞发生自噬现象,并初步探讨自噬在AE-PDT治疗骨肉瘤中的作用及其与凋亡的关系。 1 材料和方法 1.1 试剂和仪器
人骨肉瘤细胞MG-63(购于ATCC,USA); AE(Sigma);DMEM/F12培养基及胎牛血清(Gibco);胰蛋白酶(碧云天);单丹磺酰尸胺(MDC,Sigma);2’,7’-二氯荧光二乙酸盐(DCFH-DA,Sigma);β-actin、Beclin-1和LC3兔抗鼠抗体(Sigma);羊抗兔辣根过氧化物酶IgG(碧云天);细胞活力细胞毒性检测试剂盒(CCK-8,碧云天);Annexin Ⅴ-PI双染检测试剂盒(凯基);光动力治疗仪。 1.2 细胞分组及处理
将细胞分成光动力对照组(Control组、AE组、LED组)和AE-PDT实验组。AE组和AE-PDT组加入梯度浓度(0、5、10、50、100 μmol/L)的AE,在37.0℃和5%CO2的细胞培养箱避光孵育6 h后,用PBS缓冲液洗3次,再换成等量的培养基;LED组和AE-PDT组使用430 nm波长、连续输出方式、光功率密度为40 mW/cm2的LED光源照射为0、60、120和160 s,使细胞接受的光能量密度达到0、2.4、4.8和6.4 J/cm2。 1.3 CCK-8检测细胞活性
以细胞密度为5×103个/孔将MG63细胞接种到96孔板,每组设置3个复孔,每孔加入100 μL细胞悬液,在37.0℃培养箱内培养24 h后使其贴壁,细胞处理24 h后每孔加入CCK-8试剂10 μL,避光培养1 h,用酶标仪检测450 nm波长处光密度(D)值。按公式计算细胞生长抑制率(%)= (空白对照组平均D值-实验组平均D值)∕空白对照组平均D值×100%。我们最终选择AE的浓度为10 μmol/L、光照能量密度为4.8 J/cm2作为后续实验的处理条件。 1.4 DCFH-DA荧光染色检测ROS
将MG63以细胞密度为5×104个/孔接种到24孔板,处理后各组细胞加入浓度为10 μmol/L DCFH-DA染料200 μL,37.0℃孵育20 min,PBS洗3次后直接荧光显微镜下观察(激发波长488 nm、发射波长520 nm)。 1.5 MDC染色观察自噬泡
将各组细胞进行爬片处理后,弃培养基,PBS冲洗3次,4%多聚甲醛固定15 min,PBS洗2次,加入浓度为0.05 mmol/L MDC染料200 μL,37℃孵育45 min,PBS冲洗2次,荧光显微镜下(激发波长425 nm、发射波长525 nm)观察细胞自噬空泡积聚的变化。 1.6 透射电镜观察自噬体
EP管收集光动力实验组细胞并离心,用2.5%戊二醛和1%锇酸进行固定,梯度乙醇及丙酮脱水,包埋固化后切片,3%醋酸铀-枸橼酸铅双染色,透射电镜观察并摄片。 1.7 流式细胞术检测凋亡
将MG63细胞以1×106个/孔接种于6孔板中,在AE-PDT处理细胞前1 h用5 mmol/L 3-甲基腺嘌呤(3-MA)预处理细胞,收集所有组细胞进行Annexin Ⅴ-PI双染,采用流式细胞仪检测。 1.8 Western印迹检测Beclin-1和LC3蛋白的表达
收集各组细胞后按常规操作方法进行,β-actin和Beclin-1转至0.45 μm的PVDF膜,LC3转至0.20 μm的PVDF膜,β-actin抗体(1∶1 000)、Beclin-1抗体(1∶1 000)和LC3抗体(1∶1 000)4℃孵育过夜;辣根过氧化物酶标记二抗(1∶1 000),ECL发光显影。 1.9 统计学处理
应用SAS统计软件分析,数据以x±s表示,多组数据间比较采用单因素方差分析及两因素方差分析,组内两两比较采用SNK-q检验分析。检验水准(α)为0.05。 2 结 果 2.1 芦荟大黄素介导的光动力对人骨肉瘤细胞MG63的细胞活性抑制作用
光敏剂AE介导的光动力作用对人骨肉瘤MG63细胞的细胞活性有显著抑制作用,且其抑制作用呈剂量依赖效应。在单纯光敏剂AE浓度为10 μmol/L或单纯光照能量密度为4.8 J/cm2时对细胞活性无明显抑制作用,但光敏剂AE的浓度为10 μmol/L联合光照能量密度为4.8 J/cm2光动力处理细胞时抑制细胞活性(P<0.05)。因此,我们最终选择芦荟大黄素的浓度为10 μmol/L,光照能量密度为4.8 J/cm2作为后续实验的处理条件。
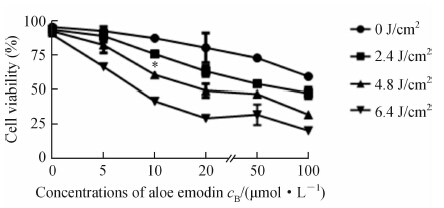 | 图 1 MG63细胞活性检测 Fig 1 Viability of MG63 cells as detected by cell counting kit-8 *P<0.05 vs control group. n=3,x±s |
AE-PDT对照组(Control组、AE组和LED组)细胞基本无荧光;AE-PDT作用MG63细胞3 h后,细胞变为圆形,荧光染色信号显著增强。
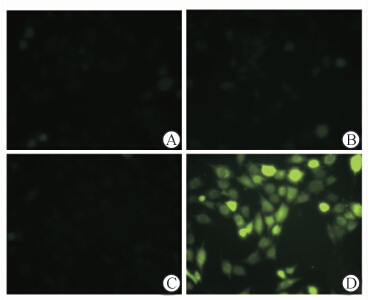 | 图 2 2’,7’-二氯荧光二乙酸盐检测细胞活性氧水平 Fig 2 Level of reactive oxygen species as detected by 2’,7’-dichlorofluorescin diacetate staining A: Empty control group; B: Single aloe emodin group; C: Single light emitting diode group; D: Aloe emodin-photodynamic therapy group |
荧光显微镜下染上MDC荧光的自噬泡呈绿色点状结构,主要分布于核周。光动力作用MG63细胞3 h后,核周积聚大量自噬小泡,与对照组(Control组、AE组和LED组)相比显著增加。
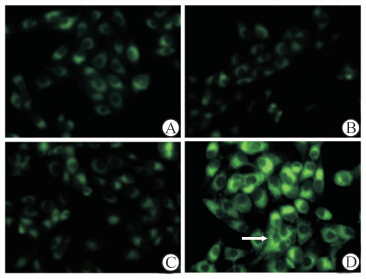 | 图 3 单丹磺酰尸胺染色检测细胞自噬体 Fig 3 Monodansylcadaverin staining of autophagosomes in MG63 cells A: Empty control group,B: Single aloe emodin group,C: Single light emitting diode group,D: Aloe emodin-photodynamic therapy group |
AE-PDT作用MG63细胞3 h后,胞质内可见大量囊泡状结构包裹细胞器或蛋白质,与溶酶体融合形成典型的自噬溶酶体,此超微结构明显区别于凋亡及坏死细胞。
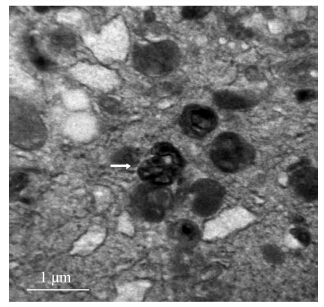 | 图 4 透射电镜下MG63细胞自噬体结构 Fig 4 Ultrastructure of MG63 cell autophagosomes under transmission electron microscope |
AE-PDT对照组(Control组、AE组、LED组和3-MA组)之间差异无统计学意义(P>0.05),AE-PDT处理细胞3 h后凋亡率高于对照组(P<0.05);在AE-PDT处理细胞前1 h用3-MA预处理细胞(AE-PDT+3-MA组)细胞凋亡率与对照组比上升(P<0.05)。 2.6 自噬蛋白LC3和Beclin-1的表达变化
AE-PDT作用MG63细胞1 h后,LC3-Ⅱ蛋白表达逐渐增加,处理24 h时LC3-Ⅱ/LC3-Ⅰ比值最高;AE-PDT作用MG63细胞后Beclin-1蛋白表达逐渐增加,处理6 h时Beclin-1的表达达到峰值,此后随时间延长而降低。
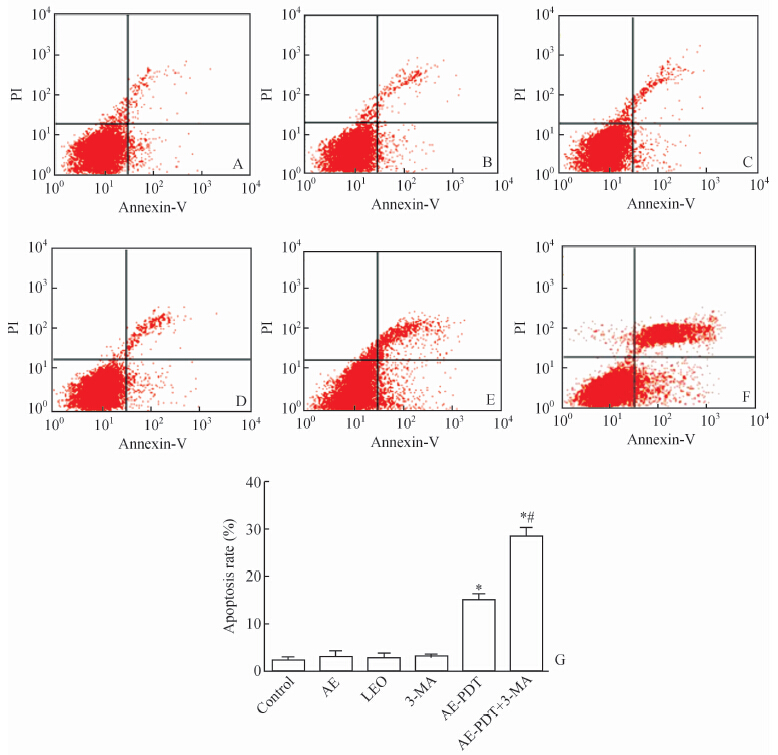 | 图 5 不同处理组作用下MG63细胞的凋亡情况及定量比较(n=3,x±s) Fig 5 Analysis and quantification of apoptosis in MG63 cells in different groups by flow cytometry A: Control group; B:Aloe emodin group; C: Light emitting diode group; D: 3-Methyladenine group; E: Aloe emodin-photodynamic therapy group; F: Aloe emodin-photodynamic therapy+3-Methyladenine group; G: Statistical analysis of apoptotic cells in each group,AE: aloe emodin,LEO: light emitting diode,3-MA: 3-Methyladenine,AE-PED: aloe emodin-photodynamic therapy |
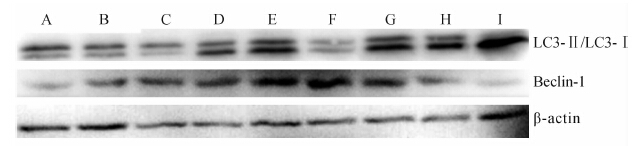 | 图 6 LC3和Beclin-1的蛋白表达 Fig 6 Western blotting analysis of LC3 and Beclin-1 protein levels in different groups at different time points A: Control group; B:Aloe emodin group; C: Light emitting diode group; D:Aloe emodin-photodynamic therapy group,1 h; E: Aloe emodin-photodynamic therapy group,3 h; F: Aloe emodin-photodynamic therapy group,6 h; G: Aloe emodin-photodynamic therapy group,9 h; H: Aloe emodin-photodynamic therapy group,12 h; I: Aloe emodin-photodynamic therapy group,24 h |
光动力疗法是近年来广泛兴起的一种非侵袭性治疗肿瘤的方式,它是利用一定波长的可见光激发聚集于肿瘤组织中的光敏剂,诱导光敏剂发生一系列的光化学、光生物学反应,产生活性氧物质,进而损伤细胞内的亚细胞器,引发一系列信号通路的激活,导致细胞死亡,达到抗肿瘤的治疗效果。AE是一种具有荧光性和广泛抗肿瘤效应的合成物。Pecere等[15]在小鼠动物模型中发现AE的细胞毒性作用呈剂量依赖性,神经外胚层肿瘤细胞系ED50为1~13 μmol/L,上皮性肿瘤细胞系ED50为40-100 μmol/L。Lee等[13, 14]的研究表明,AE浓度为50 μmol/L时不需要联合光动力就能诱导肺癌细胞凋亡,而AE-PDT(AE浓度为20 μmol/L,PDT能量强度为1.6 J/cm2)治疗对肺癌H460细胞同样具有较好的抗肿瘤作用。 因此,AE介导的光动力疗法能减少药物的副作用,小剂量即可达到抗肿瘤作用。本研究发现LED光照激活AE可以明显抑制骨肉瘤MG63细胞活性,同时我们检测到了自噬现象的发生。
MDC染色常被用来检测自噬体的存在,我们的研究结果显示AE-PDT处理细胞3 h后MDC阳性细胞和自噬体数量增多,表明AE-PDT能诱导人骨肉瘤MG63细胞产生自噬。电镜是证明自噬现象的金标准,我们通过透射电镜证实光动力处理细胞后可见胞质内大量囊泡状结构,包裹细胞器的双层膜结构自噬体与溶酶体融合形成自噬溶酶体。
光动力治疗肿瘤过程中自噬可能起着双重作用,自噬能通过清除ROS和抑制凋亡过程来保护部分肿瘤细胞,而部分肿瘤细胞则发生自噬性死亡[16, 17]。本实验发现AE-PDT作用于骨肉瘤MG63细胞3 h时能诱导细胞发生自噬和凋亡,用自噬抑制剂3-MA预处理细胞后,细胞凋亡率增加。推测在AE-PDT作用早期,自噬可能通过清除ROS和部分损害的细胞器延缓凋亡的发生,从而发挥保护性机制。
为进一步探讨细胞自噬保护性的机制,我们检测自噬重要调控因子Beclin-1和LC3的表达。LC3以LC3-Ⅰ和LC3-Ⅱ两种形式存在,细胞发生自噬时LC3-Ⅰ向LC3-Ⅱ转化,其中LC3Ⅱ被认为是自噬体的标志分子,LC3-Ⅱ/LC3-Ⅰ的比值反映自噬强度[18]。我们的结果显示LC3-Ⅱ表达水平随AE-PDT处理细胞时间的延长而增加,AE-PDT作用24 h后LC3-Ⅱ/LC3-Ⅰ比值最高,提示在AE-PDT处理MG63细胞诱导自噬形成过程中自噬小体不断聚集。Beclin-1是参与自噬的特异性基因,与多种蛋白相互作用共同调控自噬的起始 [19]。研究表明自噬因子Beclin-1能通过磷酸化的Bcl-2和Bax结合来降低细胞的凋亡水平,从而起到细胞保护性作用[20]。本实验结果显示AE-PDT处理MG63细胞后诱导Beclin-1的表达逐步增高,在处理6 h达到峰值,之后表达逐渐降低。结果提示Beclin-1在AE-PDT处理早期可能通过与其他蛋白相互作用共同调控自噬和凋亡来维持细胞稳态。
本实验表明AE-PDT能诱导骨肉瘤MG63细胞发生自噬,并且自噬在AE-PDT作用早期发挥抗凋亡的保护性作用。自噬和凋亡共同参与了AE-PDT抗肿瘤治疗,如何调控自噬和凋亡水平来提高光动力治疗骨肉瘤的抗肿瘤效应仍需进一步研究。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Whelan J,McTiernan A,Cooper N,Wong Y K,Francis M,Vernon S,et al.Incidence and survival of malignant bone sarcomas in England 1979-2007[J].Int J Cancer,2012,131:E508-E517. |
| [2] | Ottaviani G,Jaffe N.The epidemiology of osteosarcoma[J].Cancer Treat Res,2009,152:3-13. |
| [3] | He H,Ni J,Huang J.Molecular mechanisms of chemoresistance in osteosarcoma [J].Oncol Lett,2014,7:1352-1362. |
| [4] | Mittal N,Kent P M,Ording J.Metastatic and recurrent bone primary bone cancers[J].Curr Probl Cancer,2013,37:215-224. |
| [5] | Shirasu N,Nam S O,Kuroki M.Tumor-targeted photodynamic therapy[J].Anticancer Res,2013,33:2823-2831. |
| [6] | Calabrò G,Patalano A,Lo Conte V,Chianese C.Photodynamic chemotherapy in the treatment of superficial mycoses:an evidence-based evaluation[J].G Ital Dermatol Venereol,2013,148:639-648. |
| [7] | Master A,Livingston M,Sen Gupta A.Photodynamic nanomedicine in the treatment of solid tumors:perspectives and challenges[J].J Contr Rel,2013,168:88-102. |
| [8] | Chen R,Zhang J,Hu Y,Wang S,Chen M,Wang Y.Potential antineoplastic effects of Aloe-emodin:a comprehensive review[J].Am J Chin Med,2014,42:275-288. |
| [9] | Tabolacci C,Lentini A,Mattioli P,Provenzano B,Oliverio S,Carlomosti F,et al.Antitumor properties of aloe-emodin and induction of transglutaminase 2 activity in B16-F10 melanoma cells[J].Life Sci,2010,87:316-324. |
| [10] | Jeon W,Jeon Y K,Nam M J.Apoptosis by aloe-emodin is mediated through down-regulation of calpain-2 and ubiquitin-protein ligase E3A in human hepatoma Huh-7 cells[J].Cell Biol Int,2012,36:163-167. |
| [11] | Zaffaroni M,Mucignat C,Pecere T,Zagotto G,Frapolli R,D'Incalci M,et al.High-performance liquid chromatographic assay for the determination of Aloe Emodin in mouse plasma[J].J Chromatogr B Analyt Technol Biomed Life Sci,2003,796:113-119. |
| [12] | Vargas F,Rivas C,Medrano M.Interaction of emodin,aloe-emodin,and rhein with human serum albumin:a fluorescence spectroscopic study[J].Toxicol Mech Methods,2004,14:227-231. |
| [13] | Lee H Z.Effects and mechanisms of emodin on cell death in human lung squamous cell carcinoma[J].Br J Pharmacol,2001,134:11-20. |
| [14] | Lee H Z,Yang W H,Hour M J,Wu C Y,Peng W H,Bao B Y,et al.Photodynamic activity of aloe-emodin induces resensitization of lung cancer cells to anoikis[J].Eur J Pharmacol,2010,648:50-58. |
| [15] | Pecere T,Gazzola M V,Mucignat C,Parolin C,Vecchia F D,Cavaggioni A,et al.Aloe-emodin is a new type of anticancer agent with selective activity against neuroectodermal tumors[J].Cancer Res,2000,60:2800-2804. |
| [16] | Gewirtz D A.The four faces of autophagy:implications for cancer therapy[J].Cancer Res,2014,74:647-651. |
| [17] | Lambert L A,Qiao N,Hunt K K,Lambert D H,Mills G B,Meijer L,et al.Autophagy:a novel mechanism of synergistic cytotoxicity between doxorubicin and roscovitine in a sarcoma model[J].CancerRes,2008,68:7966-7974. |
| [18] | Klionsky D J,Abdalla F C,Abeliovich H,Abraham R T,Acevedo-Arozena A,Adeli K,et al.Guidelines for the use and interpretation of assays for monitoring autophagy in higher eukaryotes[J].Autophagy,2008,4:151-175. |
| [19] | Salminen A,Kaarniranta K,Kauppinen A.Beclin 1 interactome controls the crosstalk between apoptosis,autophagy and inflammasome activation:impact on the aging process[J].Ageing Res Rev,2013,12:520-534. |
| [20] | Zhou F,Yang Y,Xing D.Bcl-2 and Bcl-xL play important roles in the crosstalk between autophagy and apoptosis[J].FEBS J,2011,278:403-413. |
 2014, Vol. 35
2014, Vol. 35


