2. 第二军医大学长征医院眼科, 上海 200003
2. Department of Ophthalmology, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China
近年来,癌症的发病率和死亡率逐年增加,危害人类生命健康。非甾体类抗炎药(non-steroidal antiinflammatory drugs,NSAIDs)用于抗肿瘤的研究已经被大家所关注。研究发现,肿瘤组织中的环氧合酶-2(COX-2)的表达往往高于正常组织[1]。但在COX-2低表达的肿瘤中非甾体类抗炎药仍然能够起到抗肿瘤作用,表明非甾体类抗炎药还可以通过非依赖C0X-2途径抑制肿瘤的发生和发展。临床研究证明,长期服用布洛芬的患者患前列腺癌、结直肠癌和其他癌症的风险大大降低[2]。体外研究显示,布洛芬能够显著抑制人类结直肠腺癌细胞核β-catenin的定位,并且诱导GSK-3β的磷酸化[3]。布洛芬还能够抑制结肠炎诱导的肿瘤相关Rac-1b的过表达,从而对肿瘤的产生起到一定的抑制作用[4]。此外,结直肠癌动物模型证实,低剂量布洛芬能够抑制肿瘤的生长、血管生成、肿瘤转移和存活[5]。虽然布洛芬用于抗肿瘤方面的研究取得了一定进展,但是布洛芬用于非小细胞肺癌(NSCLC)和乳腺癌方面的研究甚少。本文旨在研究布洛芬在人非小细胞肺癌细胞株和乳腺癌细胞株中的抗肿瘤作用,及其与survivin和E-cadherin有关的机制。 1 材料和方法 1.1 材料及仪器
人非小细胞肺癌细胞株NCI-H460由上海长征医院呼吸科惠赠,人乳腺癌细胞株SKBR3购自上海中国科学院细胞库。无菌PBS、DMEM高糖培养液和胎牛血清购自美国Hyclon公司,胰酶和双抗购自上海吉诺生物医药技术有限公司。99%纯度的布洛芬购自美国Sigma-Aldrich公司,实验中用DMSO溶解。结晶紫染色液、RIPA缓冲液、100 mmol/L苯甲基磺酰氟(phenyl-methanes-ulfonyl flouride,PMSF)、蛋白酶抑制剂和磷酸化蛋白酶抑制剂购自上海碧云天生物技术有限公司。BCA蛋白定量试剂盒和ECL显影液购自美国Therom公司,10%SDS、过硫酸铵AP、TEMED和丙烯酰胺胶浓缩液29∶1购自上海博光生物科技有限公司,5×蛋白loading、蛋白Marker、10×电泳缓冲液、10×转印液、1 mol/L Tris-HCl(pH 7.5)、10×TBS缓冲液、TBST缓冲液购自上海生工生物工程有限公司,兔抗GAPDH单克隆抗体一抗、兔抗人survivin单克隆抗体一抗、兔抗人E-cadherin单克隆抗体一抗和羊抗兔二抗购自美国Epitomics公司,封闭液(5%脱脂奶粉)购自内蒙古伊利实业集团有限公司。DEPC水购自上海生工生物工程有限公司,TRIzol试剂购自美国Invitrogen公司,反转录试剂盒和RT-PCR试剂盒购自日本TaKaRa公司。Survivin上游引物:5′-AAG AAC TGG CCC TTC TTG GA-3′,下游引物:5′-CAA CCG GAC GAA TGC TTT T-3′;E-cadherin上游引物:5′-GCT CAT CAA TAG GCG GTA-3′,下游引物:5′-GTT TAT GGC CGA TCT TAT-3′;内参基因GAPDH上游引物:5′-GTG AAG GTC GGA GTC AAC G-3′,下游引物:5′-GAG ATG ATG ACC CTT TTG GC-3′。 1.2 细胞培养
人非小细胞肺癌细胞株NCI-H460和乳腺癌细胞株SKBR3在37℃、5%CO2条件下培养于DMEM培养液中( 10%胎牛血清,2 mmol/L的L-谷氨酰胺,100 U/mL青霉素,100 mg/L链霉素)。 1.3 MTT法检测布洛芬作用后细胞增殖率
细胞传3~4代后,以1×104/mL接种于96孔板,置37℃、5%CO2培养箱中培养。24 h后待细胞贴壁加入不同浓度(0、0.5、1和2 mmol/L)的布洛芬,分别处理24 h、48 h和72 h后测细胞增殖率。将5× MTT用培养基稀释成1× MTT,每孔加入20 μL,在37℃孵育3 h;吸出上清液,每孔加入150 μL DMSO,用平板摇床摇匀;570 nm波长处检测每孔的光密度(D值);结果分析:细胞存活率=(加药细胞D/对照细胞D)×100;实验重复3次。 1.4 Transwell法检测布洛芬作用后细胞的迁移抑制
用无血清培养基调整细胞密度为0.5×105,每个Transwell小室中加入200 μL。在24孔板的相应孔中加入用完全培养基稀释的不同浓度(0和2 mmol/L)的布洛芬750 μL。将Transwell小室移至下室,置37℃、5%CO2培养箱中孵育12~16 h。将小室中的液体去掉,用PBS洗2遍,然后固定、染色。用棉签将上室面的细胞轻轻擦掉,置于载玻片上,放到显微镜下观察,计数20倍目镜下、5个视野中下室面的细胞数量;实验重复3次。 1.5 Real-time PCR
检测survivin和E-cadherin mRNA表达 按照实验设计确定每个PCR板96个孔的分配情况。计算所需Premix和 dH2O的量,需多配两个孔的量;将Premix和 dH2O混匀后分配到24个200 μL的Ep管中,每管54 μL;每管中分别加入对应目的基因的上下游引物各1.5 μL和3 μL模板,混合均匀后分配到PCR板的3个复孔中,每孔18 μL;加样完毕后贴膜,上机检测;实验重复3次。 采用相对定量法,以GAPDH为内参,计算各样本Δct 值(目的基因ct值-内参ct值),目的基因的相对定量则以2t-Δc表示。 1.6 蛋白质印迹法检测survivin和E-cadherin蛋白表达
按照蛋白质印迹步骤进行配胶、电泳、转膜和ECL检测,检测条带颜色的深浅与蛋白表达量成正比,实验重复3次。 1.7 统计学处理
应用SPSS19.0软件进行统计学分析,两组数据资料之间的差异分析应用t检验,多组之间的差异分析采用方差分析。检验水准(α)为0.05。 2 结 果 2.1 布洛芬作用下肿瘤细胞株细胞增殖抑制情况
0.5、1和2 mmol/L布洛芬作用于人非小细胞肺癌细胞株NCI-H460和乳腺癌细胞株SKBR3 24、48和72 h后,与0 mmol/L浓度布洛芬比较两种肿瘤细胞株的细胞增殖率显著降低,并且2 mmol/L浓度下作用48、72 h较24 h时差异有统计学意义(P<0.05)。此外,布洛芬抑制两种肿瘤细胞株增殖呈浓度和时间依赖性。结果见图 1。
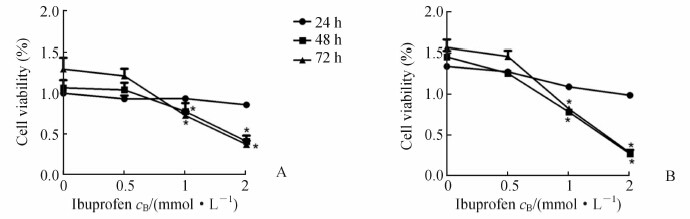 | 图 1 布洛芬对人非小细胞肺癌细胞株NCI-H460(A)和乳腺癌细胞株SKBR3(B)增殖抑制作用 Fig 1 Anti-proliferation effect of ibuprofen on human non-small cell lung cancer cell line NCI-H460 (A) and breast cancer cell line SKBR3(B) After treatment with ibuprofen for 48 and 72 h,the viability of two cancer cell lines was significantly inhibited at 1 mmol/L compared with at 2 mmol/L. *P<0.05 vs 24 h of the same concentration; n=3,x±s |
2 mmol/L布洛芬作用于人非小细胞肺癌细胞株NCI-H460和乳腺癌细胞SKBR3,12 h后,细胞迁移能力明显下降,与0 mmol/L浓度布洛芬相比差异具有统计学意义(P<0.05)。结果见图 2。
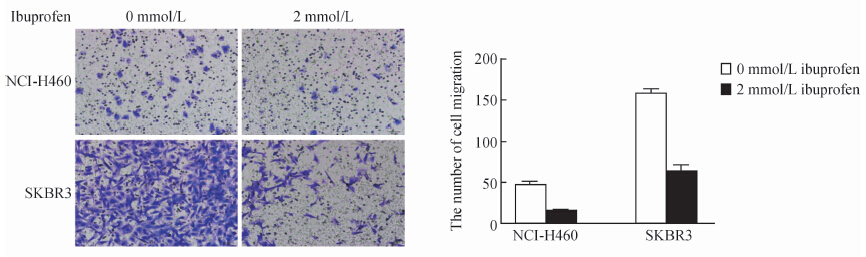 | 图 2 2 mmol/L布洛芬作用12 h人非小细胞肺癌细胞株NCI-H460和乳腺癌细胞株SKBR3迁移抑制情况 Fig 2 Anti-migration effect of 2 mmol/L ibuprofen on human NSCLC cell line NCI-H460 and breast cancer cell line SKBR3 after treatment for 12 h After treatment with 2 mmol/L ibuprofen for 12 h,the migration rates of two cancer cell lines were significantly inhibited. *P<0.05 vs 0 mmol/L ibuprofen group; n=3,x±s |
不同浓度(0、0.5、1和2 mmol/L)布洛芬作用于人非小细胞肺癌细胞株NCI-H460和乳腺癌细胞株SKBR3 48 h,survivin和E-cadherin mRNA表达变化如图 3A、图 3B所示;2 mmol/L布洛芬作用于两种肿瘤细胞株24、48和72 h,survivin和E-cadherin mRNA表达变化如图 3C、图 3D所示。随着布洛芬药物浓度升高和作用时间延长,survivin mRNA表达量降低,E-cadherin mRNA表达量增加;2 mmol/L布洛芬作用48和72 h较0 h时差异具有统计学意义(P<0.05)。
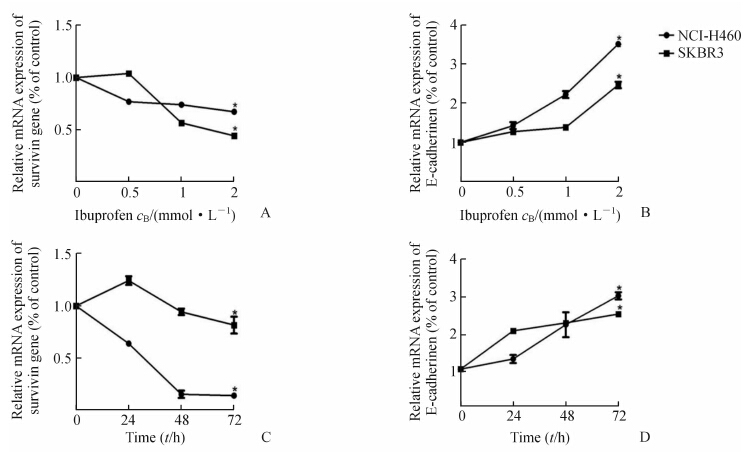 | 图 3 不同浓度布洛芬(A、B)和同浓度布洛芬24、48、72 h(C、D)作用于细胞株后survivin和E-cadherin mRNA表达的变化 Fig 3 Expression of survivin and E-cadherin mRNA after treatment with ibuprofen of different regimens A,B: Expression of survivin and E-cadherin mRNA after treatment with various concentrations of ibuprofen for 48 h. *P<0.05 vs 0 mmol/L ibuprofen; C,D: Expression of survivin and E-cadherin mRNA after 2 mmol/L ibuprofen treatment for 24,48,and 72 h. *P<0.05 vs 0 h after 2 mmol/L ibuprofen treatment. n=3,x±s |
不同浓度(0、0.5、1和2 mmol/L)布洛芬作用于人非小细胞肺癌细胞株NCI-H460和乳腺癌细胞株SKBR3 48 h ,survivin和E-cadherin蛋白水平变化如图 4A、图 4B所示;2 mmol/L布洛芬作用于两种肿瘤细胞株24、48和72 h,survivin和E-cadherin蛋白水平变化如图 4C、图 4D所示。随着布洛芬药物浓度和作用时间的延长,人非小细胞肺癌细胞株NCI-H460和乳腺癌细胞株SKBR3 survivin表达降低,E-cadherin表达增高。
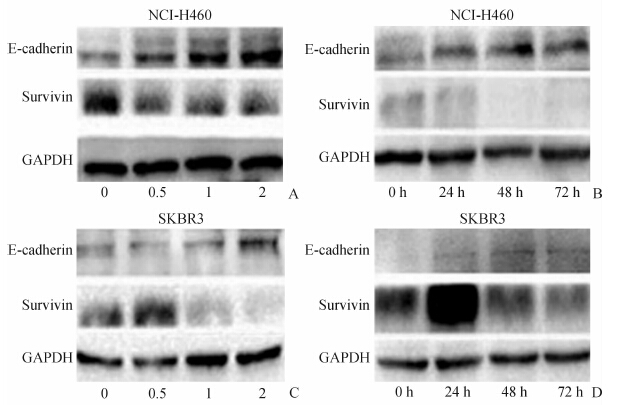 | 图 4 不同浓度布洛芬(A,C)和同浓度布洛芬24、48、72 h作用于细胞株后survivin和E-cadherin蛋白的水平变化 Fig 4 Expression of survivin and E-cadherin protein after treatment with ibuprofen of different regimens A,B: Expression of survivin and E-cadherin after treatment with ibuprofen at various concentrations for 48 h. C,D: Expression of survivin and E-cadherin after 2 mmol/L ibuprofen treatments for 24,48,and 72 h. |
肿瘤的发生是内因和外因联合作用的结果,近年来炎症学说在肿瘤的发生发展中的作用倍受关注。许多研究表明,COX-2在正常组织中表达不高,但在肿瘤组织中往往高表达[5]。针对COX-2的非甾体类抗炎药在对抗肿瘤方面也取得了一定成果,但是炎症诱发肿瘤并非这一条通路,因此能够发现COX-2以外的其他抗肿瘤靶标将给肿瘤治疗带来新的曙光。
表皮黏附分子E-cadherin是一种细胞与细胞间的黏附蛋白,广泛表达于表皮细胞和肿瘤细胞的表面,E-cadherin的丢失能够促进肿瘤细胞的转移扩散,而肿瘤转移扩散的第一步就是肿瘤细胞间黏附能力下降或丢失。许多体内和体外的模型充分证实了E-cadherin在肿瘤转移中的重要性[4, 6, 7, 8]。本研究发现,2 mmol/L布洛芬能够有效抑制人非小细胞肺癌细胞株NCIH-460和乳腺癌细胞株SKBR3的迁移(P<0.05)。同时我们还发现,布洛芬能够显著增加E-cadherin的表达,这表明布洛芬体外可通过增加E-cadherin的表达抑制人非小细胞肺癌细胞株NCIH-460和乳腺癌细胞株SKBR3的迁移。
Survivin是一个重要的凋亡抑制因子,是许多抗肿瘤药物的作用靶点,也是肿瘤预测的一个指标。Survivin在正常组织和初发的肿瘤组织中表达很低[9, 10, 11, 12, 13],在大多数肿瘤组织中表达却很高[14, 15, 16, 17, 18]。许多非甾体类抗炎药的抗肿瘤作用机制都与survivin的表达抑制有关。一些临床研究显示,抑制survivin的表达或功能可以抑制肿瘤的生长,增加肿瘤细胞的凋亡,使肿瘤细胞对抗癌药物敏感[19]。本研究亦发现,布洛芬能够有效抑制人非小细胞肺癌细胞株NCI-H460和乳腺癌细胞株SKBR3的增殖,以2 mmol/L布洛芬分别作用于2种肿瘤细胞株48 h和72 h,肿瘤细胞的增殖率下降明显,与作用24 h时相比差异有统计学意义(P<0.05),探讨其机制发现与布洛芬作用下survivin的表达下降有关。
此外,有研究显示虽然布洛芬可以诱导IκBα的降解和NF-κB的细胞核定位,但是NF-κB靶基因survivin的激活仍然被抑制,原因可能是由于布洛芬作用下GSK-3β的磷酸化增加[3]。有研究证实,只有GSK-3β被激活才能正向调节NF-κB的基因表达[20]。而Akt可以磷酸化GSK-3β的丝氨酸-9残基,这能够导致GSK-3β信号通路活性受到抑制[21]。因此,在人非小细胞肺癌细胞株NCI-H460和乳腺癌细胞株SKBR3中布洛芬抑制survivin的表达是否与GSK-3β以及Akt有关有待于进一步研究。
综上所述,我们初步阐述了布洛芬可以通过影响E-cadherin的表达抑制肿瘤细胞的迁移。此外,我们在人非小细胞肺癌细胞株NCI-H460和乳腺癌细胞株SKBR3中证实了布洛芬能够通过抑制survivin的表达来抑制肿瘤细胞的增殖。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Cha Y I,DuBois R N. NSAIDs and cancer prevention:targets downstream of COX-2 [J].Annu Rev Med,2007,58:239-252. |
| [2] | Dauletbaev N,Lam J,Eklove D,Iskandar M,Lands L C.Ibuprofen modulates NF-kB activity but not IL-8 production in cystic fibrosis respiratory epithelial cells [J].Respiration,2010,79:234-242. |
| [3] | Emily J.Greenspan,Madigan J P,Lisa A,Boardman,Daniel W.Ibuprofen inhibits activation of nuclear β-catenin in human colon adenomas and induces the phosphorylation of GSK-3β[J].Cancer Prev Res (Phila),2011,4:161-171. |
| [4] | Matos P,Kotelevets L,Goncalves V,Henriques A,Zerbib P,Moyer M P,et al.Ibuprofen inhibits colitis-induced overexpression of tumor-related Rac1b[J].Neoplasia,2013,15:102-111. |
| [5] | Yao M,Zhou W,Sangha S,Albert A,Chang A J,Liu T C,et al.Effects of nonselective cyclooxygenase inhibition with low-dose ibuprofen on tumor growth,angiogenesis,metastasis,and survival in a mouse model of colorectal cancer[J].Clin Cancer Res,2005,11:1618-1628. |
| [6] | Derksen P W,Liu X,Saridin F,van der Gulden H, Zevenhoven J,Evers B,et al.Somatic inactivation of E-cadherin and p53 in mice leads to metastatic lobular mammary carcinoma through induction of anoikis resistance and angiogenesis[J].Cancer Cell,2006,10:437-449. |
| [7] | Frixen U H,Behrens J,Sachs M,Eberle G,Voss B, Warda A,et al.E-cadherin-mediated cell-cell adhesion prevents invasiveness of human carcinoma cells[J].J Cell Biol,1991,113:173-185. |
| [8] | Vleminckx K,Vakaet L Jr,Mareel M,Fiers W,van Roy F.Genetic manipulation of E-cadherin expression by epithelial tumor cells reveals an invasion suppressor role[J].Cell,1991,66:107-119. |
| [9] | Fukuda S,Pelus L M.Elevation of Survivin levels by hematopoietic growth factors occurs in quiescent CD34+ hematopoietic stem and progenitor cells before cell cycle entry [J].Cell Cycle,2002,1:322-326. |
| [10] | Yang D,Welm A,Bishop J M.Cell division and cell survival in the absence of survivin [J].Proc Natl Acad Sci USA,2004,101:15100-15105. |
| [11] | Okada H,Bakal C,Shahinian A,Elia A,Wakeham A,Suh W K,et al.Survivin loss in thymocytes triggers p53-mediated growth arrest and p53-independent cell death[J].J Exp Med,2004,199:399-410. |
| [12] | Song J,So T,Cheng M,Tang X,Croft M.Sustained survivin expression from OX40 costimulatory signals drives T cell clonal expansion[J].Immunity,2005,22:621-631. |
| [13] | Uchide T,Takatsu N,Fujimori Y,Fukushima U,Itoh H.Expression of survivin mRNA in dog tumors [J].DNA Seq,2005,16:329-334. |
| [14] | Ambrosini G,Adida C,Altieri D C.A novel anti-apoptosis gene,survivin,expressed in cancer and lymphoma [J].Nat Med,1997,3:917-921. |
| [15] | Wang L,Zhang G M,Feng Z H.Down-regulation of survivin expression reversed multidrug resistance in adriamycin-resistant HL-60/ADR cell line[J].Acta Pharmacol Sin,2003,24:1235-1240. |
| [16] | Endoh T,Tsuji N,Asanuma K,Yagihashi A,Watanabe N.Survivin enhances telomerase activity via up-regulation of specificity protein 1- and c-Myc-mediated human telomerase reverse transcriptase gene transcription[J].Exp Cell Res,2005,305:300-311. |
| [17] | Waligórska-Stachura J,Jankowska A,Wako R, Liebert W,Biczysko M,Czarnywojtek A,Et al.Survivin--prognostic tumor biomarker in human neoplasms--review[J].Ginekol Pol,2012,83:537-540. |
| [18] | Shoeneman J K,Ehrhart E J,Eickhoff J C,Charles J B,Powers B E,Thamm D H.Expression and function of survivin in canine osteosarcoma [J].Cancer Res,2012,72:249-259. |
| [19] | Yu D D,Wang C T,Shi H S,Li Z Y,Pan L,Yuan Q Z,et al.Enhancement of cisplatin sensitivity in Lewis Lung carcinoma by liposome-mediated delivery of a survivin mutant[J].J Exp Clin Cancer Res,2010,29:46. |
| [20] | Ougolkov A V,Bone N D,Fernandez-Zapico M E,Kay N E,Billadeau D D.Inhibition of glycogen synthase kinase-3 activity leads to epigenetic silencing of nuclear factor kappaB target genes and induction of apoptosis in chronic lymphocytic leukemia B cells[J].Blood,2007,110:735-742. |
| [21] | Cross D A,Alessi D R,Cohen P,Andjelkovich M,Hemmings B A.Inhibition of glycogen synthase kinase-3 by insulin mediated by protein kinase B[J].Nature,1995,378:785-789. |
 2014, Vol. 35
2014, Vol. 35


