2. 第二军医大学长征医院肾内科, 上海 200003
2. Department of Nephrology, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China
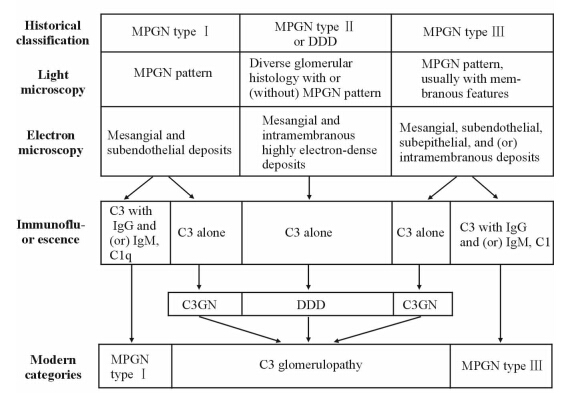
C3肾小球病是指由补体激活、沉积及降解异常导致的,以突出的肾小球C3片段沉积和电镜下致密物沉积为特征的肾小球疾病。其定义经过长时间的演变,近几年才被统一(图 1)。最初被纳入该疾病的患者,其肾脏病理特点表现为不同程度的系膜增生性肾小球肾炎。随后发现其发病与补体旁路途径调节的异常有关,因此先后纳入了符合该机制和病理特点的单纯补体C3沉积的Ⅰ型膜增生性肾小球肾炎(MPGN)、补体H因子相关蛋白5肾病(CFRH5肾病)、家族性Ⅲ型MPGN和Ⅱ型MPGN(即致密物沉积病,DDD)。2013年国际上制定了C3肾小球病的专家共识,新分类将C3肾小球病分为DDD和C3肾小球肾炎(C3GN)[1]。
|
图 1 C3肾小球病分类的演变 Fig 1 Evolution of classification for C3 glomerulopathy MPGN: Membranoproliferative glomerulonephritis; DDD: Dense deposit disease; C3GN:C3 glomerulonephritis |
现今C3肾小球病已成为肾脏病领域的一个研究热点,近年来研究者关注的焦点已由其光镜、电镜下的组织形态学特征转为沉积物的免疫特征及潜在的肾脏病相关补体变异的筛查。C3肾小球病目前尚无持续有效的治疗方法,但临床正在研究针对特定补体成分的治疗,治疗时机和持续时间仍有待探索。随着对C3肾小球病研究的日益深入,C3肾小球病的诊治也获得了相应的进展。现就C3肾小球病的诊治进展作一综述。
1 组织学表现 1.1 病理形态C3肾小球病光镜下主要表现为系膜增生、膜增生和毛细血管内皮细胞增殖,新月体也可见,极少数时光镜下肾小球可能正常。电镜下,典型的DDD具有特征性的、在肾小球基底膜致密层呈均质飘带状或腊肠状的嗜锇电子致密物的沉积,有时系膜、肾小囊和肾小管基底膜也可见。病变有时会累及内皮下区域,产生与急性感染后肾小球肾炎(PIGN)相似的驼峰状沉积物。C3GN的电子致密物沉积于内皮下和(或)系膜区、上皮下,甚至肾小球基底膜内(但与DDD电子致密物的性质不同)。
1.2 免疫组化、免疫荧光表现C3肾小球病在肾小球有显著的C3沉积(免疫荧光强度较其他免疫组分≥),而免疫球蛋白阴性或很少量沉积。目前实验室主要通过检测活化的C3(即C3b)的分解产物C3c来检测C3。未来也可通过检测其他C3分解产物,如iC3b、C3dg等在肾小球存在及其相对位置来反映相应的病理生理机制。C5b-9作为补体终末激活的产物也可被检测到,它的存在提示可行C5抑制治疗。但需注意的是,C5b-9在正常肾小球上也存在[4],且其在经过1年补体抑制剂治疗后血清C5b-9恢复正常的C3GN和DDD患者的反复活检中仍持续阳性[4]。此外,与其他肾小球疾病相似,C3肾小球病亦可伴有少量的免疫球蛋白沉积。少量的免疫球蛋白主要局限于硬化部位或以小滴状聚集在足突。但在有典型电镜特征的DDD中,仍有约41% 有C3而无免疫球蛋白沉积,59%有显著的C3沉积伴IgM阳性[3]。IgM可能有不同于IgG和IgA的意义,还有待进一步的研究[3]。C3肾小球病诊断需排除PIGN,PIGN常发生于急性链球菌感染后,病理检查显示仅有C3而无免疫球蛋白沉积并不罕见[5],因而诊断疾病时需关注患者的临床病程和血清学检查结果。若不遵循典型PIGN的进程(低血清C3水平在8~12周内恢复),应重新考虑C3肾小球病[3]。
2 临床特征C3肾小球病临床常表现为肾病综合征伴血尿、高血压、肾功能损害及持续低补体血症,预后较差。DDD患者通常年龄较小,易出现低血清C3和新月体,预后不一。而C3GN患者通常年龄较大,有严重的小动脉、肾小球硬化以及肾间质纤维化[6]。C3肾小球病总体进展快速,年龄≥16岁、DDD、新月体和肾功能损害是终末期肾脏病(ESRD)的高危因素,且DDD和C3GN在肾移植术后均会复发[6]。
3 C3肾小球病的补体检查手段若疑为C3肾小球病,无论是自体肾还是移植肾,都需行补体检查。
3.1 补体的基因检查C3肾小球病的基因检查主要包括补体调节蛋白基因突变检查、H因子相关基因位点检查和补体相关基因筛查。与C3肾小球病有关的基因包括补体调节蛋白H因子、I因子和CD46等[1],但研究发现,大部分C3肾小球病患者体内并不存在这些基因突变。补体激活蛋白B因子[7]和C3[8]功能获得性突变虽然罕见,但却能提供重要信息,如DDD相关的C3功能获得性突变能抵抗H因子对C3的抑制作用[8]。所以理论上基于H因子的治疗对这类DDD无效。H因子相关基因包括CFHR1、CFHR2、CFHR3、CFHR4和CFHR5。H因子相关基因的重排(并不影响H因子)可见于家族性C3肾小球病。研究发现在CFHR5肾病是家族性C3肾小球病的一个亚型中有CFHR5基因的内在重复序列[9]。MPGN Ⅲ型的家族性C3肾小球病可见另一种CFHR位点,即CFHR3-1杂合基因的重排[10]。这些突变均可用基因组DNA通过PCR检测。其他已报道的重排包括家族性DDD的CFHR2-CFHR5杂合基因[11]、DDD相关CFHR1基因的内在重复序列[12]以及非Cyprus家族的CFHR5肾病。相对于特定基因的突变检测,补体相关基因筛查也是重要的基因检测手段。但基因筛查出的突变是否与疾病相关需要严格分析:(1)新的突变与家族性病例共分离;(2)疾病相关的突变在大型人口数据库和特定人种数据库中稀有;(3)突变影响蛋白质的功能,或鉴定出的突变和其他患病家族/先证者分布在相同蛋白结构域。
3.2 补体的血清学检查C3肾小球病患者都应进行C3、C4、H因子含量测定、副蛋白筛查、C3肾炎因子(C3NeF、C3bBb)筛查等具有诊断意义的补体血清学检测。C3肾小球病的血清补体的变化包括:(1)旁路途径的特异性激活,如C3表达水平下降、C4表达正常、B因子水平降低提示补体旁路途径异常激活;(2)C3转换,C3水平降低并伴C3分解产物如C3d的升高;(3)C5转换,C5水平降低并伴可溶性C5b-9和C5a的升高。这些标记物的异常会随着疾病的进程改变。目前已知的C3肾小球病的获得性原因包括:(1)C3NeF阳性,(2)抗B因子抗体阳性,(3)抗H因子抗体阳性。上述三者使机体对补体旁路途径活化的抑制能力下降,导致补体旁路途径异常激活而引起C3肾小球病。C3NeF的检测可以通过多种方式进行:(1)在患者的纯化免疫球蛋白中筛检能稳定补体旁路途径C3转化酶的自身抗体[13];(2)通过检测C3分解产物来推断能稳定C3转化酶的自身抗体的存在[13]。由于单克隆蛋白可介导补体调节异常[14],C3肾小球病患者也建议查副蛋白血症[15],若检测结果为阳性,需送往特定实验室以确定副蛋白是否与补体调节异常有关。
3.3 C3肾小球病补体检查的专家建议建议所有患者做的检查:(1)血清C3、C4检测;(2)C3NeF检测;(3)血清H因子检测;(4)血清副蛋白检查,检查时需确定副蛋白是否是C3异常激活的原因;(5)CFHR5突变筛查,CFHR5肾病是C3肾小球病特征性的原因[5],因此该突变筛查具有临床意义。
需个体化考虑的检查:(1)血清B因子检测;(2)血清C5检测,C5可在终末途径的激活中减少,也可表明最有可能从C5抑制治疗中获益的分组;(3)C3激活标记的检测,如C3d、C3c、C3adesArg,与C3抗原水平相比,活化的C3成分是C3激活更敏感的指标;(4)C5激活标记的检测,如C5adeArg,可溶的C5b-9,与C5抗原水平相比,活化的C5成分是C5激活更敏感的指标;(5)抗H因子自身抗体检测,对低C3且C3NeF阴性患者的检测尤其重要;(6)抗B因子自身抗体检测;(7)补体调节基因(如CFH、CFI、CD46)、蛋白激活基因(C3、CFB)的突变筛查和对CFH-CFHR位点变异拷贝数评估,低C3和C3NeF阴性患者CFH突变的筛查尤其重要。
4 治疗方法C3肾小球病为少见病,且近几年才逐渐被统一定义,目前对C3肾小球病治疗方式的研究主要局限于病例研究和队列研究等,缺少随机对照试验研究。相关治疗方法多结合发病机制并基于既往经验,包括一般治疗和特异治疗。一般治疗的原则类似于其他肾小球疾病,包括控制血压、使用肾素-血管紧张素系统阻断剂和控制脂代谢紊乱等,此处不再赘述。特异治疗主要从补体旁路调节异常的发病机制出发,包括免疫抑制治疗、血浆疗法、抗补体治疗等。
4.1 免疫抑制治疗KDIGO临床指南建议:特发性MPGN伴肾病综合征、肾功能逐步下降的成人和儿童患者可口服环磷酰胺或霉酚酸酯(MMF)联合小剂量每日或隔日皮质类固醇治疗,初始治疗小于6个月。但这一建议是基于低质量的循证医学证据提出的[16]。最新研究发现糖皮质激素治疗DDD无效[17],对于治疗MPGN效果也不确定[18]。关于 MMF或利妥昔单抗的疗效目前仍有争议,已有研究发现MMF或利妥昔单抗可降低C3NeF,但没有改善肾小球病变及功能[1]。总体而言,免疫抑制治疗效果并不乐观。
4.2 血浆疗法尚无证据支持C3GN可采用血浆治疗。但有病例研究报道,1对患有DDD和H因子不足的兄弟输注血浆治疗有效[19],且DDD导致的急性肾损伤患者采用血浆置换肾功能得以恢复[20]。亦有一些报道表明血浆置换尽管能去除C3NeF,但也不能有效治疗DDD。基于长期以来治疗手段缺乏的现状和血浆疗法一定的临床效果,该治疗手段仍在C3肾小球病中广泛应用。
4.3 抗补体治疗随着对C3肾小球病与补体旁路途径调节异常之间关系认识日益深入,抗C5治疗成为了C3肾小球病又一重要治疗手段。抗C5治疗虽然尚未获得批准应用于C3肾小球病,但临床已经开始使用。依库丽单抗是一种直接作用于补体蛋白C5的单克隆抗体,研究显示其已在3个病例报告[21, 22, 23]中被证实有效。而在另一个依库丽单抗治疗C3肾小球病的试验[24]中,3名DDD患者(其中1例为肾移植)和3名C3GN患者(其中2例为肾移植)每隔1周使用依库丽单抗。开始试验时所有患者都有蛋白尿>1 g/d和(或)急性肾损伤,其中1例有CFH和CD46突变,3例有C3NeF阳性。治疗1年后,两组有显著的血清肌酐下降,1例DDD患者蛋白尿明显减少,1例C3GN患者组织学改善。依库丽单抗并非对所有的患者有效,sC5b-9是否升高是判断治疗反应的一个重要标准。
4.4 肾脏移植对肾移植后C3肾小球病复发风险的研究来自小样本临床数据库。在一项研究中,DDD的复发率为11/18(约61% ),且与MPGN Ⅰ型或Ⅲ型的肾移植相比,DDD更易复发[25]。在最近的研究中,C3GN的复发率( 6/10,即60%)和DDD(6/11,约54.5%)相近[1]。部分患者肾移植后会出现血栓性微血管病[1]。
5 展 望C3肾小球病作为一类新的疾病还有很多问题需要被逐步认识。首先,组织形态学改变与临床表现、病程和预后间的具体关系,以及非DDD的C3肾小球病的特征性电镜表现还有待研究。其次,检测疾病相关的补体亚型和C3NeF在C3肾小球病的作用也需要更深入的研究。最后,治疗上,哪类患者需要补体或免疫抑制治疗,疗程多长,病理结果对治疗反应预测价值,均有待在临床研究中加以揭示。
6 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Servais A,Noël L H,Roumenina L T,Le Quintrec M,Ngo S,Dragon-Durey M A,et al.Acquired and genetic complement abnormalities play a critical role in dense deposit disease and other C3 glomerulopathies[J].Kidney Int,2012,82:454-464. |
| [2] | Hou J,Markowitz G S,Bomback A S,Appel G B,Herlitz L C,Barry Stokes M,et al.Toward a working definition of C3 glomerulopathy by immunofluorescence[J].Kidney Int,2014,85:450-456. |
| [3] | Pickering M C,D'Agati V D,Nester C M,Smith R J,Haas M,Appel G B,et al.C3 glomerulopathy:consensus report[J].Kidney Int,2013,84:1079-1089. |
| [4] | Herlitz L C,Bomback A S,Markowitz G S,Stokes M B,Smith R N,Colvin R B,et al.Pathology after eculizumab in dense deposit disease and C3 GN[J].J Am Soc Nephrol,2012,23:1229-1237. |
| [5] | Sethi S,Fervenza F C,Zhang Y,Zand L,Meyer N C,Borsa N,et al.Atypical postinfectious glomerulonephritis is associated with abnormalities in the alternative pathway of complement[J].Kidney Int,2012,83:293-299. |
| [6] | Medjeral-Thomas N R,O'Shaughnessy M M,O'Regan J A,Traynor C,Flanagan M,Wong L,et al.C3 glomerulopathy:clinicopathologic features and predictors of outcome[J].Clin J Am Soc Nephrol,2014,9:46-53. |
| [7] | Strobel S,Zimmering M,Papp K,Prechl J,Jozsi M.Anti-factor B autoantibody in dense deposit disease[J].Mol Immunol,2010,47:1476-1483. |
| [8] | Martinez-Barricarte R,Heurich M,Valdes-Canedo F,Valdes-Canedo F,Vazquez-Martul E,Torreira E,et al.Human C3 mutation reveals a mechanism of dense deposit disease pathogenesis and provides insights into complement activation and regulation[J].J Clin Invest,2010,120:3702-3712. |
| [9] | Gale D P,de Jorge E G,Cook H T,Martinez-Barricarte R,Hadjisavvas A,McLean A G,et al.Identification of a mutation in complement factor H-related protein 5 in patients of Cypriot origin with glomerulonephritis[J].Lancet,2010,376:794-801. |
| [10] | Malik T H,Lavin P J,Goicoechea de Jorge E,Vernon K A,Rose K L,Patel M P,et al.A hybrid CFHR3-1 gene causes familial C3 glomerulopathy[J].J Am Soc Nephrol,2012,23:1155-1160. |
| [11] | Chen Q,Wiesner M,Eberhardt H,Hartmann A,Hugo C,Skerka C,et al.A novel hybrid CFHR2/CFHR5 gene develops MPGN Ⅱ and provides insights into disease mechanism and therapeutic implications[J].Immunobiology,2012,217:1131. |
| [12] | Tortajada A,Yebenes H,Abarrategui-Garrido C,Anter J,García-Fernández J M,Martínez-Barricarte R,et al.C3 glomerulopathy associated CFHR1 mutation alters FHR oligomerization and complement regulation[J].J Clin Invest,2013,123:2434-2446. |
| [13] | Zhang Y,Meyer N C,Wang K,Nishimura C,Frees K,Jones M,et al.Causes of alternative pathway dysregulation in dense deposit disease[J].Clin J Am Soc Nephrol,2012,7:265-274. |
| [14] | Jokiranta T S,Solomon A,Pangburn M K,Zipfel P F,Meri S.Nephritogenic lambda light chain dimer:a unique human miniautoantibody against complement factor H[J].J Immunol,1999,163:4590-4596. |
| [15] | Sethi S,Sukov W R,Zhang Y,Fervenza F C,Lager D J,Miller D V,et al.Dense deposit disease associated with monoclonal gammopathy of undetermined significance[J].Am J Kidney Dis,2010,56:977-982. |
| [16] | Group KDIGOKGW.KDIGO Clinical Practice Guideline for Glomerulonphritis[J].Kidney Int (Suppl),2012,2:198-199. |
| [17] | Appel G B,Cook H T,Hageman G,Jennette J C,Kashgarian M,Kirschfink M,et al.Membranoproliferative glomerulonephritis type Ⅱ (dense deposit disease):an update[J].J Am Soc Nephrol,2005,16:1392-1403. |
| [18] | Nester C M,Smith R J.Treatment options for C3 glomerulopathy[J].Curr Opin Nephrol Hypertens,2013,22:231-237. |
| [19] | Licht C,Weyersberg A,Heinen S,Stapenhorst L,Devenge J,Beck B,et al.Successful plasma therapy for atypical hemolytic uremic syndrome caused by factor H deficiency owing to a novel mutation in the complement cofactor protein domain 15[J].Am J Kidney Dis,2005,45:415-421. |
| [20] | Banks R A,May S,Wallington T.Acute renal failure in dense deposit disease:recovery after plasmapheresis[J].Br Med J (Clin Res Ed),1982,284:1874-1875. |
| [21] | Daina E,Noris M,Remuzzi G.Eculizumab in a patient with dense-deposit disease[J].N Engl J Med,2012,366:1161-1163. |
| [22] | McCaughan J A,O'Rourke D M,Courtney A E.Recurrent dense deposit disease after renal transplantation:an emerging role for complementary therapies[J].Am J Transplant,2012,12:1046-1051. |
| [23] | Vivarelli M,Pasini A,Emma F.Eculizumab for the treatment of dense-deposit disease[J].N Engl J Med,2012,366:1163-1165. |
| [24] | Bomback A S,Smith R J,Barile G R,Zhang Y,Heher E C,Herlitz L,et al.Eculizumab for dense deposit disease and C3 glomerulonephritis[J].Clin J Am Soc Nephrol,2012,7:748-756. |
| [25] | Little M A,Dupont P,Campbell E,Dorman A,Walshe J J.Severity of primary MPGN,rather than MPGN type,determines renal survival and post-transplantation recurrence risk[J].Kidney Int,2006,69:504-511. |
 2014, Vol. 35
2014, Vol. 35


