2. 安徽省妇幼保健院妇产科, 合肥 230000;
3. 第二军医大学长征医院病理科, 上海 200003
2. Department of Gynecology and Obstetrics, Anhui Provincial Maternity and Child-care Hospital, Hefei 230000, Anhui, China;
3. Department of Pathology, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China
上皮间质转化(epithelial-mesenchymal transition,EMT)在胚胎发育、组织重建、癌症转移过程中发挥着重要作用。研究表明,从小鼠胚胎肝中提取肝干细胞进行体外细胞培养可诱导出EMT[1,2],发育早期(8周龄前)的人胚胎肝组织中的肝干细胞具有EMT表型,人肝芽来源的肝干细胞系(hLBSC)不仅具有肝干细胞特征,还表达间质标记物[3],均说明EMT的产生和干细胞密切相关。我们前期研究证实8周龄后胚胎肝内出现的胆管板内含有丰富的肝干细胞,并且具有双向分化潜能[4],由此设想胆管板干细胞及其所在的汇管区间质之间也可能存在EMT。本研究用免疫组化方法观察EMT相关蛋白在31例8~40周龄人胚胎肝组织中的表达,探讨胆管板发育过程中EMT的发生和意义。 1 材料和方法 1.1 组织来源
31例8~40周龄胚胎肝标本取自解放军105医院和安徽省妇幼保健院,其中15例为孕妇自愿流产(4例行米非司酮流产,11例行水囊引产),16例意外流产(7例因孕妇创伤、4例因孕妇心脏疾病、5例因孕妇合并子宫肌瘤),所有标本收集均征得孕妇本人知情同意,实验过程符合伦理标准,经解放军105医院医学伦理委员会批准;胚龄按Jirasek(1983)制定的人体胚胎正常发育表、B超测定胚胎双顶径与股骨径和孕妇的末次月经来确定。 1.2 免疫组化染色
采用MaxVision两步法,所有标本均用10%中性缓冲甲醛固定,常规石蜡包埋、连续切片,一张切片行H-E染色,其余脱蜡至水,柠檬酸高温高压抗原修复20 min,滴加0.3% H2O2室温孵育20 min,阻断内源性过氧化物酶,滴加一抗鼠抗人细胞角蛋白19(cytokeratin 19,CK19)、波形蛋白(vimentin)、α-平滑肌肌动蛋白(α-SMA)单克隆抗体(Abnova公司),然后放置于4℃过夜,滴加即用型MaxVisionTM/HRP试剂(福州迈新生物技术开发公司),室温孵育15 min,DAB显色,苏木精复染。分别设阳性对照、阴性对照和空白对照。判定标准:背景清晰;细胞质或细胞膜出现棕黄色颗粒为阳性。每张切片均观察5个完整的汇管区,用LOGENE-I PAS9000图像分析系统分别计算CK19、vimentin和α-SMA阳性细胞百分比。 1.3 统计学处理 所有数据均用SPSS16.0统计软件处理,CK19、vimentin和α-SMA阳性细胞百分率之间的关系采用Spearman等级资料相关分析,各组间CK19、vimentin和α-SMA阳性率比较用单因素方差分析(One-Way ANOVA),检验水准(α)为0.05。 2 结 果 2.1 8周龄后胚胎肝汇管区的特点
8周龄后胚胎肝内在较大门静脉间质周围发现胆管板(图 1A ),9周龄胚胎肝内中央静脉及汇管区开始形成,11周时肝索开始沿着中央静脉呈放射状排列,14周龄胚胎肝内胆管板旁门静脉间充质内出现单个完整的胆管,肝索也逐渐演变成肝板,参考Libbrecht等[5]胆管板发育可分为3个阶段:(1)胆管板阶段可见汇管区周围包绕单层或两层胆管板细胞;(2)胆管板重新塑形阶段除胆管板外还可见胆管形成;(3)胆管板塑形完成阶段,可见单个独立的胆管。
|
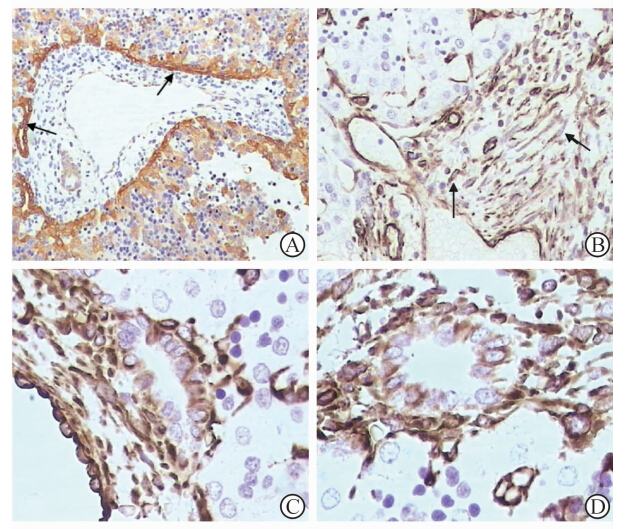
图 1 上皮、间质标记物在人胚胎肝组织中的表达(免疫组化MaxVision法) A:胆管板阶段(11周),肝索中肝母细胞、汇管区周围的双层胆管板细胞(箭头示)CK19强阳性;B:胆管板阶段(16周),汇管区肌纤维母细胞(箭头示);C,D: 胆管板重塑阶段,胆管上皮和周围的间充质细胞表达vimentin,可见vimentin+肌纤维母细胞向胆管内整合、移行. C:22+3周;D:24+1周. Original magnification: ×100(A),×200(B),×400(C,D) |
8周龄胚胎肝细胞已经表达CK19,阳性染色位于胞质和胞膜,CK19阳性程度在8~11周龄胚胎肝组织的肝索细胞中达到最高峰,胆管板CK19染色始终强于肝索细胞(图 1A ),12周龄胚胎肝组织肝索细胞和CK19的表达逐渐减少,16周龄胚胎肝索内几乎检测不到。
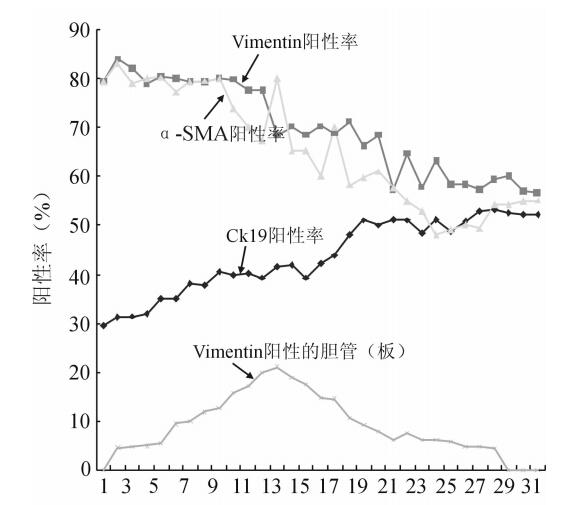
Vimentin、α-SMA在肝索中散在表达,可见于血窦内皮、星状细胞、吞噬细胞,在汇管区表达于血管内皮、平滑肌以及肌纤维母细胞(portal myofibroblasts,pMFs),后者位于汇管区间质内,长梭形、胞质稀少(图 1B)。CK19染色阳性细胞百分率分别与vimentin和α-SMA阳性细胞百分率呈负相关(CK19与vimentin:r=-0.820,P<0.001; CK19与α-SMA:r=-0.797,P<0.001)。比较3个不同阶段的各指标表达水平,胆管板阶段、胆管板重新塑形阶段、胆管形成阶段的CK19阳性细胞百分率逐渐升高,vimentin和α-SMA阳性细胞百分率逐渐降低(表 1、图 2)。9周龄胚胎肝组织胆管板细胞开始表达vimentin,13~19周阳性达到高峰,之后不断减少,28周后检测不到,而且部分发育中的胆管细胞(14~32周)也表达vimentin,胆管板、胆管细胞vimentin阳性部位均位于胞质,可观察到vimentin阳性的pMFs向胆管(板)内整合、移行(图 1C、1D)。连续切片可以观察到9~32周胚胎肝胆管板或胆管细胞共表达vimentin和CK19(图 3)。
|
|
表 1 上皮间质转化标志物在胆管板发育3个阶段中的阳性率比较 |
|
图 2 人胚胎肝胆管板发育过程中上皮间质转化相关蛋白的表达变化 |

|
图 3 连续切片观察到21周胚胎肝组织胆管(板)细胞共表达vimentin和CK19 Original magnification:×100,×200,×400(从左到右) |
研究证明,从胚胎肝中提取胚胎肝干细胞进行体外培养可诱导出EMT[1,2],Chagraoui等[6]在小鼠胚胎肝组织中用免疫荧光双标记检测CK18和α-SMA的表达,在造血期胚胎肝组织中(11.5~18.5dpc)观察到了具有EMT特征的间质细胞。苏娟等[3]证实发育早期(8周龄前)的人胚胎肝组织内肝干细胞具有EMT表型特征。本实验结果显示随着胆管板发育3个阶段的进行,汇管区内CK19阳性的胆管板和胆管细胞数目增加,vimentin和α-SMA阳性的汇管区间质细胞数目逐渐减少,二者呈负相关,并且在9~32周胚胎肝内观察到部分胆管板和胆管细胞共表达vimentin和CK19,随着胆管发育趋近成熟,vimentin表达消失,说明在特定时间段内部分胆管板和胆管细胞共表达上皮和间质表型,还观察到vimentin阳性的汇管区pMFs向胆管(板)内整合、移行,说明人胚胎肝胆管板发育过程中存在间质上皮转化(MET),与胆管形成有关。胆管形成机制的一个关键的环节是需要胆管板和周围的间充质细胞发生相互作用[5],MET可能是参与这个环节的作用机制之一,这可以促进对EMT发生机制的深入认识,进而为合理干预病理性EMT及胆管发育畸形如小儿胆道闭锁[7],提供理论依据。
Vimentin是间质细胞表型,也是重要的EMT标记物。我们观察到9~32周胚胎肝部分胆管板干细胞和胆管细胞共表达vimentin和CK19,这与其他的研究相符合:多种来源的干细胞可以具有间质表型,如乳腺干细胞[8]、小鼠胚胎肝干细胞[6]等,从侧面说明了EMT的产生与干细胞密切相关。Li等[9]分离培养小鼠胚胎肝内vimentin阳性的非造血细胞可以诱导产生AFP,通过双标记实验发现从11.5 d至出生前的小鼠胚胎肝组织中有不同比例的AFP、vimentin 和BrdU、vimentin双阳性细胞存在,这种表型特点与本实验观察到的共表达vimentin和CK19的胆管板干细胞类似,不同之处是,从小鼠胚胎肝内分离出来的vimentin阳性细胞可能位于肝索内,表达AFP提示向肝系分化,而本研究中vimentin阳性的胆管(板)细胞表达CK19,主要是向胆管系分化[10]。
表达vimentin的胆管(板)细胞可能是EMT/MET发生过程中一种处于未分化状态的肝干细胞,具有自我更新和多向分化潜能,可以在胚胎发生的特定阶段通过激活MET产生,通过分泌细胞外基质和促进胆管游走迁移参与胆管发育成熟,随着胆管形成,vimentin阳性细胞减少,最后转变成位于肝界板处的赫令管细胞,但因赫令管细胞难以观察到,所以无从知道其是否表达vimentin[11]。
研究证实,EMT还是恶性肿瘤侵袭转移的始动环节,EMT使癌细胞失去上皮特征,获得间质细胞特征,增加了肿瘤细胞的转移和侵袭潜能[12],EMT的产生与癌干细胞密切相关,高表达干细胞基因的肝癌细胞株可诱导产生EMT[13]。胚胎肝富于肝干细胞的各种中间形态,胚胎肝发育与肝癌的发生、发展有相似性,如细胞可塑性、动力学、形态学、信号转导通路等,因此越来越多的学者从胚胎发育时的胚胎植入、细胞增殖、分化和迁移等正常生理过程来寻求肿瘤发生及侵袭转移等方面的机制。本研究从细胞和分子水平对EMT参与调控人胚胎肝胆管板发育的相关机制进行研究,这对于理解和研究肝癌的发生发展机制有一定的借鉴意义。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Inada M,Follenzi A,Cheng K,Surana M,Joseph B, Benten D,et al.Phenotype reversion in fetal human liver epithelial cells identifies the role of an intermediate meso-endodermal stage before hepatic maturation[J].J Cell Sci, 2008, 121:1002-1013. |
| [2] | Choi S S,Diehl A M.Epithelial-to-mesenchymal transitions in the liver[J].Hepatology,2009,50:2007-2013. |
| [3] | Su J,You P,Li W L,Tao X R,Zhu H Y,Yao Y C,et al.The existence of multipotent stem cells with epithelial-mesenchymal transition features in the human liver bud[J].Int J Biochem Cell Biol,2010,42:2047-2055. |
| [4] | 徐 军,胡 勇,王 健,周 继,章太平,余宏宇.人胚胎发育过程中胚胎组织肝干细胞免疫表型的变化[J].第二军医大学学报,2007,28:117-121. Xu J,Hu Y,Wang J,Zhou J,Zhang T P,Yu H Y.Immunohistochemical characterization of hepatic stem cells in developing human liver[J].Acad J Sec Mil Med Univ,2007,28:117-121. |
| [5] | Libbrecht L,Cassiman D,Desmet V,Roskams T.The correlation between portal myofibroblasts and development of intrahepatic bile ducts and arterial branches in human liver[J].Liver, 2002, 22:252-258. |
| [6] | Chagraoui J,Lepage-Noll A,Anjo A,Uzan G,Charbord P.Fetal liver stroma consists of cells in epithelial-mesenchymal transition[J].Blood,2003,101:2973-2982. |
| [7] | 张志波, 胡婷嫣, 何 峰, 高 红.胆道闭锁肝脏组织中SHH信号与上皮间充质转化关系的研究[J].中国医科大学学报, 2010, 39:305-307. |
| [8] | Mani S A,Guo W,Liao M J,Eaton E N,Ayyanan A,Zhou A Y,et al.The epithelial-mesenchymal transition generates cells with properties of stem cells[J].Cell, 2008, 133:704-715. |
| [9] | Li B,Zheng Y W,Sano Y,Taniguchi H.Evidence for mesenchymal-epithelial transition associated with mouse hepatic stem cell differentiation[J].PLoS One, 2011, 6:e17092. |
| [10] | Carpentier R,Suer R E,van Hul N,Kopp J L,Beaudry J B,Cordi S,et al.Embryonic ductal plate cells give rise to cholangiocytes,periportal hepatocytes,and adult liver progenitor cells[J].Gastroenterology,2011,141:1432-1438. |
| [11] | Deng H,Wang H F,Gao Y B,Jin X L,Xiao J C.Hepatic progenitor cell represents a transitioning cell population between liver epithelium and stroma[J].Med Hypotheses, 2011, 76:809-812. |
| [12] | Ding W,You H,Dang H,LeBlanc F,Galicia V,Lu S C,et al.Epithelial-to-mesenchymal transition of murine liver tumor cells promotes invasion[J].Hepatology,2010,52:945-953. |
| [13] | Na D C,Lee J E,Yoo J E,Oh B K,Choi G H,Park Y N.Invasion and EMT-associated genes are up-regulated in B viral hepatocellular carcinoma with high expression of CD133-human and cell culture study[J].Exp Mol Pathol,2011,90:66-73. |
 2014, Vol. 35
2014, Vol. 35


