2. 第二军医大学长海医院病理科, 上海 200433;
3. 烟台警备区门诊部, 烟台 264000
2. Department of Pathology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China;
3. Hospital of Yantai Military Garrison, Yantai 264000, Shandong, China
经皮热消融治疗甲状腺结节具有定位精准、创伤轻微、灭活彻底、保护甲状腺功能、避免颈部瘢痕等优点,日渐受到关注。在普及应用过程中,人们最为担心的是消融对正常甲状腺组织以及毗邻的颈部结构的损伤,对此“液体隔离带法”等人工措施具有一定的辅助作用,而机体自身的损伤保护机制在其中是否发挥作用以及如何发挥作用值得探讨。热休克蛋白(heat shock protein,HSP)是机体受到热等刺激时自主产生的一种蛋白,研究发现它对刺激具有主动保护与修复作用。文献报道HSP70在甲状腺肿瘤内表达增强[1],但目前缺乏其在甲状腺结节热消融过程中表达变化的研究。因此,本研究通过对比热消融前后甲状腺结节HSP70表达的变化,探讨HSP70在甲状腺结节与结周组织内的表达程度,分析其变化规律及潜在的意义。 1 资料和方法 1.1 一般资料
2013年9月至2014年2月,第二军医大学长征医院行超声引导下射频消融治疗甲状腺结节的患者中选取50例单枚实性结节患者,术前穿刺活检均诊断为良性结节(其中滤泡性腺瘤32例,结节性甲状腺肿18例)。男性10例,女性40例,年龄27~57岁,中位年龄40岁。本研究通过长征医院医学伦理委员会审核,所有患者均签署知情同意书。结节纳入标准:(1)最大径1.5~2 cm的全实性结节,既满足单次消融即可覆盖整个结节,又便于穿刺活检取材能够成功。(2)结节外甲状腺组织无弥漫性疾病,以避免基础疾病因素导致的HSP70表达异常。
1.2 主要仪器及设备
超声仪为SiemensSequoia 512,探头频率7~14 MHz。射频消融仪采用VIVA-RF射频发生仪(VRS01,STARmed Co.,Ltd.,Korea)。射频消融电极针为Starmed 18-07s10F型(外径18 G,针尖工作段长10 mm)。组织学活检针使用16 G-HS切割式活检针(Presia,Italy)。 1.3 设定感兴趣区域
由于热消融治疗时温度从针道中央向边缘处呈梯度性递减趋势[2],推测受到不同热量的影响,HSP70的表达从针道中央向边缘处也可能呈现梯度性改变。另外结节外一定区域正常腺体可能受到热刺激促使HSP70表达并对周边正常组织产生影响。因此,为了研究结节内不同区域以及结节外邻近区域组织内的HSP70表达水平,本研究对每个结节设定3个感兴趣区域,即:(1)中央区为消融针道及其邻近组织;(2)边缘区为结节包膜或边界内侧3 mm区域的结节组织;(3)过渡区为结节包膜或边界外5 mm的正常甲状腺组织。 1.4 消融方法
术前超声扫查甲状腺结节,了解其位置、边界、形态、内部回声,并进行彩色多普勒检查及超声造影,了解其血供情况。取颈部过伸位,常规消毒铺巾,用2%利多卡因局麻皮肤穿刺点,并使用2%利多卡因5 mL+生理盐水15 mL为隔离液保护气管、颈总动脉及喉返神经,然后用Starmed 18-07s10F射频电极针对甲状腺结节进行多点多平面消融。消融功率35~45 W。术后超声造影提示消融区灌注均完全消失。 1.5 病理取材与染色
射频消融术前及术后即刻分别使用16 G-HS切割式活检针分别对结节中央区、边缘区及过渡区进行穿刺取材,取得组织学标本均经4%甲醛固定。通过免疫组织化学染色方法EnVision两步法标记,试剂使用兔抗人HSP70多克隆抗体(针对HSP70的所有成员)按1∶100稀释。 1.6 病理图像判读
每张免疫组化切片随机选择3个不同的视野(×200)观察,并判读阳性表达强度和阳性率。采用半定量法计算HSP70的染色结果评分,即染色强度得分与阳性细胞数百分比得分之和。染色强度评分采用大多数细胞的染色程度减去背景染色程度:无着色记0分,淡黄色或轻微黄色记1分,深黄或棕黄色记2分,棕褐色或黑褐色记3分。阳性细胞百分比即每张免疫组化切片选择5个不同的视野(×400)观察,每个视野计数100个细胞中的阳性细胞数,计算阳性细胞平均数:0~5%评为0分,6%~25%评为1分,26%~50%评为2分,51%~75%评为3分,>75%评为4分。总评分为染色强度得分与阳性细胞百分比得分之和:无表达(-)为< 2分,弱表达(±)为2~3分,中等表达(+)为4~5分,高表达()为6~7分。无表达和弱表达归为阴性组,中等表达和高表达归为阳性组。 1.7 统计学处理
采用SPSS20.0软件进行数据分析处理,两组间率的比较使用四格表资料的χ2检验,检验水准(α)为0.05。 2 结 果
2.1 HSP70的表达
免疫组织化学染色结果表明:HSP70阳性主要定位于甲状腺滤泡上皮细胞的胞质,少量在胞核,颜色呈黄色至褐色。50例甲状腺良性实性结节中,HSP70于热消融前、后均存在不同程度的表达,多数消融后标本表现为过渡区呈高表达,中央区及边缘区中等程度表达(图 1)。另外,部分标本滤泡腔内出现阳性染色,是由于滤泡腔内的胶质含有HSP70所致,不纳入阳性细胞的计分。
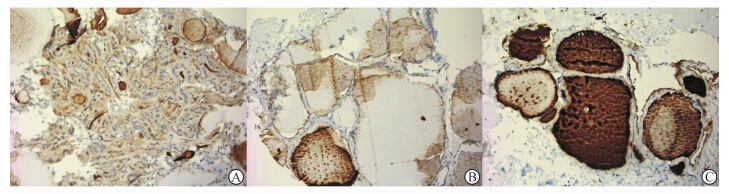 | 图 1 热消融后甲状腺滤泡性腺瘤不同区域HSP70表达 Fig 1 Expressions of HSP70 in different regions of thyroid adenoma shortly after ablation A: Moderate expression of HSP70 in the central region; B: Moderate expression of HSP70 in the marginal region; C: Intensive expression of HSP70 in the transitional region. Original magnification:×100(A),×200(B,C) |
甲状腺良性结节中央区热消融前后HSP70表达比较,差异无统计学意义;边缘区热消融前后HSP70表达比较,差异无统计学意义;过渡区热消融前后HSP70表达比较,差异有统计学意义(P<0.05),热消融后过渡区HSP70的表达强于消融前(表 1)。
|
|
表 1 热消融前、后甲状腺良性结节相同区域HSP70的表达 Tab 1 Expressions of HSP70 in the same regions of benign thyroid nodules before and after thermal ablation |
结果表明:热消融后,对中央区、边缘区、过渡区3个区域HSP70表达进行两两比较,发现过渡区HSP70表达阳性率分别高于中央区和边缘区,且差异具有统计学意义(P=0.000、0.000),但中央区与边缘区HSP70阳性率差异无统计学意义(P=0.424)。 3 讨 论 3.1 热消融治疗效果的评估
超声引导下热消融治疗目前已经应用于肝脏、胰腺、肺、甲状腺、甲状旁腺、乳腺、颌下腺、淋巴结等部位的良恶性肿瘤[3,4,5,6,7,8,9,10]。其原理是在超声引导下将消融针刺入肿瘤内部,通过射频、微波等方法产生热量,快速使肿瘤组织发生凝固、坏死,具有定位精准、易处理多发病灶、微创、皮肤无瘢痕等优点。热消融对甲状腺结节治疗效果的评估应包括对病灶组织的治疗作用以及对周边正常组织的影响两方面。以往的研究多注重于热消融对结节的灭活,而对于周边正常组织抵抗热消融损伤的研究目前仅在肝脏方面见到了一些报道,认为热消融后肝脏肿瘤周边的肝组织出现HSP表达明显增加[4]。甲状腺是人体重要内分泌器官,其周围毗邻血管、气管、神经及甲状旁腺等重要部位,如果对结节周边的正常腺体组织和周围正常结构不能很好地保护,会导致声音改变、臂丛神经损伤、肿瘤破裂和永久性甲状腺功能减退、血肿、皮肤烧伤和呕吐等并发症的发生[11]。甲状腺结节热消融治疗的主要目标,是精准、快速灭活病灶组织的同时,尽可能地保护结节周边正常组织,两者缺一不可。国内有研究率先提出“液体隔离带”法[7],很好地保护了甲状腺周围正常结构,然而对甲状腺内的正常腺体组织却尚未有报道探讨其保护方法。本研究选用HSP70作为一项指标,基于它是应用较多的用于评价热损伤保护的一种蛋白,有重要的生物学功能,同时实验室也有较成熟的手段进行检测。 3.2 HSP70的生物学特性
热休克蛋白家族(HSPs)是一组独特的应激蛋白,广泛存在于原核和真核细胞内,在遇到热、缺氧及化学等因素时产生[12]。热休克蛋白作为一种分子伴侣蛋白,作用于蛋白质的转运、组装和肽链的正确折叠,起到细胞保护作用,并且最终影响细胞的生存[13]。近年来也有报道表明热休克蛋白与细胞凋亡相关[14]。其中HSP70是热休克家族中研究最深入、也是最为重要的一员,除了具有HSPs的共同作用,还有多种生物学功能,包括参与调节免疫、减轻炎症反应等,并且与病毒感染、特异性和非特异性抗肿瘤免疫也有一定关系[15,16,17]。在正常生理状态下HSP70表达量很少,遇到各种理化刺激后能显著诱导其表达,使其细胞内含量迅速增加,对细胞起到保护作用。此外,肿瘤本身也可以作为一种刺激因素使HSP70表达增加,在良恶性肿瘤中HSP70的表达也有不同[18]。甲状腺滤泡上皮细胞内和滤泡腔内均存在HSP70,滤泡腔内的HSP70同样是在滤泡上皮细胞内合成,通过胞吐方式释放到细胞外。 3.3 热消融对甲状腺良性结节HSP70表达的影响
在热消融过程中热从针道向周边呈递减性的分布传播,因此针道周围的温度最高,而且是最先受到热刺激的区域。理论上该区域滤泡上皮细胞内的HSP70的增量表达最早,随着时间的推移边缘区和过渡区才逐渐出现相应的增量表达,而且中央区也应该表达程度最强。但是本研究结果表明,中央区和边缘区HSP70的表达与消融前相比,并无明显增强。笔者分析认为是由于射频热量生成过快、强度过于强烈,导致HSP70尚未合成,细胞便已凝固变性,丧失了产生HSP的能力。过渡区是指病灶周围一定范围内的相对正常组织,存在于消融区域之外,因受热量梯度性衰减的影响,此区域内热量级别尚不至导致甲状腺滤泡上皮发生热变性坏死,因此细胞仍保持活力;恰恰是由于受到适度的热刺激,该区域HSP70的表达明显强于消融前,表现出了正常组织对抗热损伤的自我保护作用,并进而证明了热消融治疗在消融范围内发挥了治疗作用,而在消融热场范围以外,正常组织对热损伤存在自我保护,可以认为过渡区滤泡上皮细胞内HSP70显著增量表达是甲状腺结节热消融治疗过程中正常组织自我保护的机制之一。 3.4 甲状腺良性结节经皮热消融治疗后HSP70表达的空间分布规律
我们在研究微波消融区温度分布规律时发现,消融区温度由中心向边缘处呈梯度性衰减[2],射频消融与微波消融的热场分布高度相似,随着温度由消融针道向边缘区梯度性递减,组织热变性的程度也呈递减变化。因此,我们推测甲状腺组织内HSP70的表达也存在着递减的特点。但是观察结果显示,中央区与边缘区HSP70的表达并无明显改变,而且均低于过渡区的HSP70表达强度,中央区和边缘区之间亦无明显差异。这可能是中央区受热过快、过强,边缘区温度明显高于过渡区的缘故。不同区域HSP70表达的结果,尽管没有显现出梯度性递减的趋势,但是反证了射频消融升温快速、强烈、对称的特点。
本研究初步探讨了HSP70在甲状腺结节热消融前后的表达,发现了一些有价值的现象,并初步推测HSP70的表达与甲状腺结节热消融后正常组织的自我保护有较为密切的关系。研究中我们也发现在甲状腺滤泡腔胶质中也存在HSP70阳性表达,而且存在较为明显的个体差异,为减少细胞外HSP对判读结果的影响,暂未将其列入计分范围,但是其与甲状腺热消融之间的关联应得到进一步的探讨。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | 李延辉,夏明汗,康举龄,谢敏如,马少康. HSP70和P53蛋白在甲状腺乳头状癌中的表达及其与临床病理特征的关系[J].现代生物医学进展,2011,11:2504-2507. |
| [2] | 章建全,刁宗平,卢 峰,盛建国.离体猪肝微波消融区的弹性梯度与温度梯度研究[J].中华超声影像学杂志,2012,21:799-802. |
| [3] | 王 能,钱国军,沈 强,盛月红.肝癌行经皮肝穿刺射频治疗的疗效及其影响因素分析[J].当代医学,2010,16:48-51. |
| [4] | 韩治宇.热休克蛋白与肝肿瘤热消融的抗肿瘤免疫研究进展[J].国际肿瘤学杂志,2006,33:851-854. |
| [5] | 张智勇,李 珂,倪泉兴. 射频热消融治疗中晚期胰腺癌[J].中国癌症杂志,2007,17:170-171. |
| [6] | 李永杰,冯庆亮,孙凤芝,李 东,赵莹莹.超声引导微波热消融术在老年乳腺癌治疗中的应用[J] .中华医学超声杂志(电子版),2010,7:66-72. |
| [7] | 章建全,马 娜,徐 斌,刘 灿,宋佳琳,刁宗平. 超声引导监测下经皮射频消融甲状腺腺瘤的方法学研究[J].中华超声影像学杂志,2010,19:861-865. |
| [8] | 刘 灿,章建全,肖 蕾. 超声引导下经皮射频消融治疗甲状旁腺腺瘤的初步临床应用[J].第二军医大学学报,2013,34:371- 374. Liu C, Zhang J Q, Xiao L. Clinical application of ultrasound-guided percutaneous radiofrequency ablation for parathyroid adenoma[J]. Acad J Sec Mil Med Univ, 2013,34:371-374. |
| [9] | 郭建琴,章建全.超声引导下经皮射频消融治愈颌下腺肿瘤1例[J].中华超声影像学杂志,2012,21:620. |
| [10] | 章建全,秦志丰,蒋京京,孟 进. 超声造影监测下射频联合微波消融治疗淋巴结黑素瘤的尝试[J].第二军医大学学报,2006,27:1364-1367. Zhang J Q, Qin Z F, Jiang J J, Meng J. Percutaneous radiofrequency ablation combined with microwave coagulation therapy under contrast-enhanced ultrasound guidance for treatment of melanoma metastasis to lymph nodes:a case report[J].Acad J Sec Mil Med Univ, 2006,27:1364-1367. |
| [11] | Baek J H, Lee J H, Sung J Y, Bae J I, Kim K T, Sim J, et al. Complications encountered in the treatment of benign thyroid nodules with US-guided radiofrequency ablation: a multicenter study[J].Radiology,2012,262:335-342. |
| [12] | Lindquist S, Craig E A. The heat-shock proteins[J].Annu Rev Genet,1988,22:631-677. |
| [13] | Yang W L, Nair D G, Makizumi R, Gallos G, Ye X, Sharma R R. Heat shock protein 70 is induced in mouse human colon tumor xenografts after sublethal radiofrequency ablation[J].Ann Surg Oncol,2004,11:399-406. |
| [14] | Rai R, Richardson C, Flecknell P, Robertson H, Burt A, Manas D M. Study of apoptosis and heat shock protein (HSP) expression in hepatocytes following radiofrequency ablation (RFA)[J].J Surg Res,2005,129:147-151. |
| [15] | 王宇萍,蒋建东. 热休克蛋白的结构和功能[J].中国细胞生物学报,2010,32:305-313. |
| [16] | 程维杰,李秋玲,孙延鸣,王洪梅,李建斌,仲跻峰. 热休克蛋白70(HSP70)研究进展[J].畜牧兽医杂志,2008,27:55-57. |
| [17] | 黄 丽,张文敏. 热休克蛋白70抗肿瘤免疫的研究进展[J].肿瘤医学,2011,17:205-207. |
| [18] | 刘春梅,丁依玲. 热休克蛋白家族与肿瘤的相关性及其临床应用的研究进展[J].中国现代手术学杂志,2011,15:316-320. |
 2014, Vol. 35
2014, Vol. 35


