2. 南方医科大学南方医院药学部, 广州 510515;
3. 解放军第85医院药剂科, 上海 200052
2. Department of Pharmacology, Nanfang Hospital, Southern Medical University, Guangzhou 510515, Guangdong, China;
3. Department of Pharmacology, No.85 Hospital of PLA, Shanghai 200052, China
△Co-first authors.
*Corresponding authors
1 材料和方法 1.1 主要试剂及仪器
细胞培养基DMEM、 MEM(美国Cellgro’s公司)、0.25%胰蛋白酶;胎牛血清(美国Gmini公司)、H-RasV12和其病毒载体WH(美国圣地亚哥Scripps研究所的惠赠)、相关抗体pRb、p53、Phospho-p53 (Ser15)、p16INK4A、p21、自噬关键基因5(ATG5)、β-actin(美国Cell Signal公司)、p53、H-Ras (C-20,美国Santa Cruz公司)、Alph的化学荧光成像系 FluorChem-8900。感受态大肠杆菌DH5α(TaKaRa公司)。 1.2 细胞系
病毒传代细胞系LinX-A来自美国圣地亚哥Scripps研究所的惠赠,高糖DMEM培养基中含10%胎牛血清、100 U/mL青霉素和链霉素和2 mmol/L L-谷氨酰胺培养。在5% CO2、37℃孵箱中培养。BJ人成纤维细胞来自美国ATCC公司(CRL-2522),在含有10%胎牛血清和100 U/mL青霉素和链霉素、1%非必需氨基酸、2 mmol/L L-谷氨酰胺的MEM培养基中,在5% CO2、37℃孵箱中培养。 1.3 反转录病毒磷酸钙法转染及稳定筛选
LinX-A 细胞生长在10 cm2细胞培养盘中,当其约70%~80%融合时,更换新鲜培养基10 mL。15 μg反转录病毒质粒、15 μg的sss DNA、2.5 mol/L的CaCl2、水以及2× BBS,混匀,加入到2 h前替换的新细胞培养基中。48 h后收集已经含有反转录病毒的上清液,用0.45 μm的微孔过滤器过滤,将含有反转录病毒的上清液与20%的新鲜MEM细胞培养基、polybrene(终浓度是8 μg/mL)混合后,加到BJ细胞上,以高速离心45 min后细胞移至 5% CO2、32℃培养箱中过夜。24 h后更换新鲜的培养基,37℃再培养1 d。细胞用质粒相应的药物筛选1 μg/mL的Puromycin或50 μg/mL的Hygromycin B。收集经过反转录病毒转染后,经药物筛选存活的细胞,备用。 1.4 Western 印迹检测
将BJ细胞或转染了的细胞裂解于免疫沉淀裂解缓冲液中(缓冲液中含有pH值7.5的Tris-HCl 50 mmol/L,150 mmol/L氯化钠,0.1% SDS,1% Triton X-100,0.5% 胆酸钠酸,2 mmol/L EDTA、10%甘油含有蛋白酶和磷酸酶抑制剂)。在冰上超声30 s后4℃离心12 000×g,15 min,收集细胞沉淀,蛋白浓度用 Bradford 法分析测定。统一蛋白浓度20~80 μg ,上样于12%或15% SDS-PAGE 膜上,再转到尼龙纤维膜上,5%脱脂奶粉封闭过夜,加入一抗[p62,LC3,p16INK4A,p21,p53,Phospho-p53 (Ser15),Ha-Ras (C-20),p-Rb,ATG5,β-actin]于4℃孵育 2 h。在室温加入相应的辣根过氧化物酶偶联的二抗孵育 1 h。洗膜后加显色液,采用Kodak膜曝光。相同实验重复3次。 1.5 细胞生长曲线
细胞转染适当的反转录病毒并用适当的药物筛选4 d,筛选掉没有被感染的细胞之后分析早期衰老的行为。将转染后的第6天定义为细胞生长曲线的第0天。把104/孔细胞种在12孔细胞培养板上,平行种2~3孔。每3~4 d计数1次后,仍以104/孔细胞种回到新的细胞培养板中。细胞倍增数(PD)的计算公式:PD=log(N2/N1)/log2。N1是种植的细胞数,N2是长到第3~4天的细胞数。相同实验重复3次。 1.6 β-半乳糖苷(β-Gal)染色
对6孔板中培养的细胞,去除细胞培养液,用PBS洗涤1次,加入1 mL β-Gal 染色固定液(0.5% 戊二醛在PBS中),室温固定15 min。然后去除固定液,用含2 mmol/L MgCl2 的PBS洗涤3次,除去PBS,每孔加入1 mL β-Gal 染色工作液。37℃孵育2~4 h,最多12~16 h。在普通光学显微镜下观察,计数,并计算被染上蓝色的细胞数目的百分比。 1.7 细胞凋亡检测
消化离心收集细胞,经PBS洗过2遍。细胞沉淀加入Banding buffer重悬细胞后,加入FITC-AnnexinⅤ和5 μL PI,室温避光15 min,流式细胞仪检测BD FACS Canto Ⅱ细胞凋亡,分析软件Flowjo7.6.2。相同实验重复3次。 1.8 ATG5 siRNA设计与载体构建
根据Genbank数据库中人ATG5基因(NM_001286106.1)的mRNA序列,使用I Score Designer在线设计工具,本着siRNA设计原则选取GC含量在40%~60%的siRNA靶位点,针对ATG5基因编码区设计特异性序列两对,由Qiagen公司合成。ATG5 siRNA-1目标基因序列:5′-TCC AAC TTG TTT CAC GCT ATA-3′,正义链5′-CAA CUU GUU UCA CGC UAU ATT-3′,反义链5′-UAU AGC GUG AAA CAA GUU GGA-3′。ATG5 siRNA-2目标基因序列:5′-AAC CTT TGG CCT AAG AAG AAA-3′,正义链5′-CCU UUG GCC UAA GAA GAA ATT-3′,反义链5′-UUU CUU CUU AGG CCA AAG GTT-3′。阴性对照序列购自Qiagen公司,经Blast比对与人类其他基因编码序列无同源性。 1.9 统计学处理
采用SPSS 13.0统计学软件,所有数据均以 ±s 表示,各组间差异比较采用单因素方差(ANOVA)检验,检验水准(α)为0.05。 2 结 果 2.1 H-RasV12诱发早期衰老
在H-RasV12转染后第7天裂解细胞提取蛋白行Western印迹分析可见,BJ细胞表达高水平的H-RasV12(图 1)。形态学观察和生长曲线显示,细胞处于生长停滞状态,细胞变大而扁平,而两组对照细胞生长情况和形态正常,β-Gal 阳性率在H-RasV12过度表达细胞显著高于两组对照细胞(图 2、图 3)。Western印迹结果进一步证实H-RasV12过度表达诱发细胞衰老,表现为与两组对照细胞相比,H-RasV12过度表达细胞的衰老相关蛋白p16INK4A、Phospho-p53 (Ser15)升高和p-Rb降低(图 1)。两组对照细胞之间细胞衰老相关蛋白的表达水平基本相同。
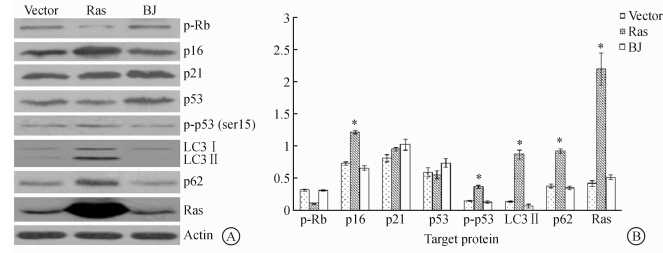 | 图 1 细胞衰老和自噬相关蛋白的表达水平 Fig 1 Expression of senescence- and autophagy-associated proteins A: Western blotting analysis; B: Relative expression of target proteins. Ras: H-RasV12,LC : Light chain,*P<0.05 vs two control groups; n=3,x±s |
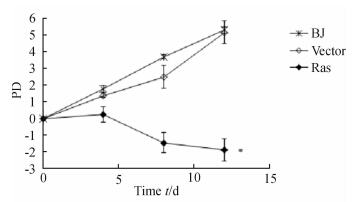 | 图 2 BJ细胞、转染空载体或H-RasV12的BJ细胞生长曲线 Fig 2 Growth curve of BJ cells and BJ cells transfected with vector or H-RasV12 |
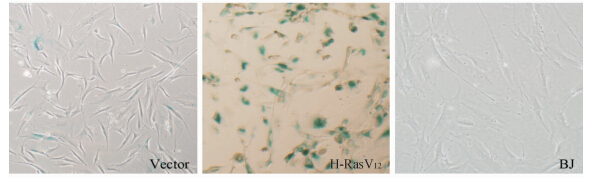 | 图 3 细胞衰老的β-半乳糖苷酶染色比较 Fig 3 Comparison of senescence-associated β-Gal actoside staining in different groups |
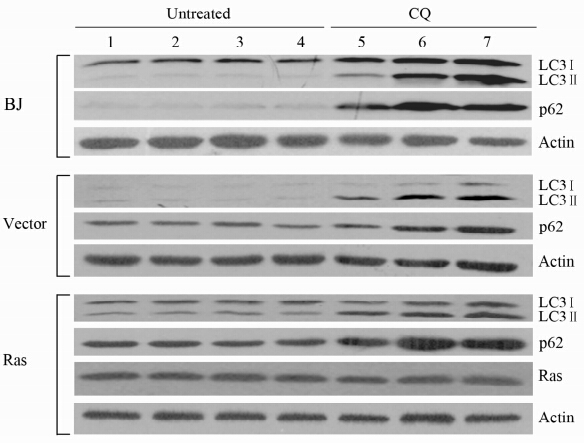 | 图 4 自噬相关蛋白动态表达水平的Western印迹结果 Fig 4 Western blotting analysis of autophagy-associated proteins 1: D7 post-infection; 2: D8; 3: D9; 4: D10; 5: D7+CQ 24 h; 6: D7+CQ 48 h; 7: D7+CQ 72 h.Ras: H-RasV12; LC: Light chain |
|
|
表 1 Western印迹检测自噬相关蛋白动态表达水平的相对表达量(目的蛋白/内参) Tab 1 ChangesChanges of relative expression of autophagy-associated proteins by Western blotting analysis |
在生长曲线研究中,H-RasV12过度表达细胞不仅出现生长停滞,还表现为曲线逐渐降低至0以下,说明存在细胞死亡,因此我们通过流式细胞分析研究了Ras过度表达对于细胞凋亡的影响。结果表明,与两组对照细胞相比,H-RasV12过度表达能够轻度增加细胞的凋亡率(P<0.01,图 5),因此细胞生长曲线中细胞数量的减少与凋亡率增加有关。
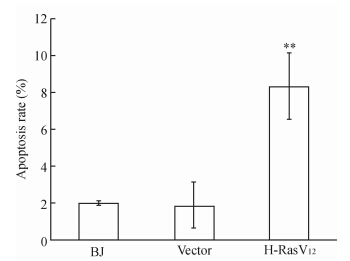 | 图 5 H-RasV12过度表达时细胞凋亡率的流式细胞分析 Fig 5 Apoptosis rates in each group as analyzed by flow cytometry **P<0.01 vs the two control groups; n=3,x±s |
在用两种针对自噬关键基因ATG5的siRNA处理48 h后,在 H-RasV12和转染 空载体的BJ细胞均达到了较好的ATG5敲低效果。Western印迹分析可见(图 6、表 2),在转染空载体或Ras的BJ细胞,siRNA处理后的细胞自噬标记物p62出现蓄积或蓄积进一步加重。细胞衰老相关蛋白p16INK4A和Phospho-p53 (Ser15)蛋白水平在BJ细胞siRNA处理者较未处理者明显升高(P<0.05),而在转染空载体细胞变化不明显。这些结果说明,利用siRNA敲低ATG5抑制自噬可促使转染Ras的BJ细胞发生更加严重的细胞衰老。
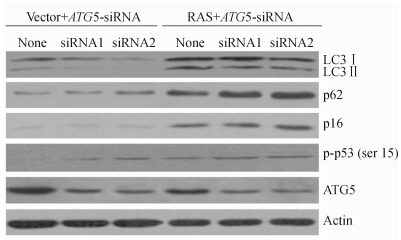 | 图 6 转染H-RasV12或空载体的BJ细胞以siRNA敲低自噬基因ATG5后的细胞衰老和自噬相关蛋白的Western印迹分析 Fig 6 Western blotting analysis of senescence- and autophagy- associated proteins in BJ cells transfected by H-RasV12 or empty vector after knockdown of ATG5 by siRNA Ras: H-RasV12; LC: Light chain; siRNA: Small interfering RNA; ATG5: Autophagy-related protein 5 |
|
|
表 2 转染H-RasV12和空载体的BJ细胞在敲低自噬基因ATG5前后的细胞衰老和自噬相关蛋白的相对表达量 Tab 2 Relative expression of senescence- and autophagy-associated proteins in H-RasV12 and vector transfected BJ cells before and after knockdown of ATG5 by siRNA |
研究表明自噬在肿瘤整个发生、发展过程中的作用是不同的[7,8]。在癌症的后期,由于需要适应肿瘤快速生长和血供相对不足造成的缺血、缺氧,癌细胞的自噬活性明显上调来满足代谢需求[9]。然而在早期,自噬在癌症发生过程的作用更为复杂[2,5]。多数学者认为在正常细胞,癌基因H-RasV12转染会诱导自噬活性的增高,并且这是细胞存活和发生细胞癌变所必需的[2,10]。Young等[2]利用H-RasV12诱导性表达的细胞模型,研究了OIS情况下自噬活性的动态变化情况。结果表明,在转染并表达H-RasV12的IMR90人成纤维细胞,转染后早期可进一步分为3个时期:分裂期、过渡期和衰老期。自噬的活性在分裂期即开始升高,在过渡期达到峰值。在本研究中,我们主要观察的是细胞转染Ras后经过药物筛选后的时期,也就是稳定表达H-RasV12的衰老期。理论上,此时间段的细胞已经度过了转基因后早期应激反应导致的自噬活性上调。但我们发现在H-RasV12转染后的6~12 d,BJ人成纤维细胞自噬活性是受到抑制的,表现为p62蛋白水平的显著升高。由于p62是 “载货蛋白”并在自噬过程中被降解,所以是评估自噬活性调控良好的标记物[11]。此抑制结果在人类非癌细胞的研究中目前尚未见报道[12,13,14]。
既往对信号通路的研究标明,H-RasV12是可以通过PI3K/AKT/mTOR通路来负性调控自噬的[14]。然而,本研究中自噬活性的抑制表现为LC3Ⅱ和p62蛋白均蓄积。LC3Ⅱ水平的变化情况取决于自噬过程被抑制是在早期还是在后期。自噬早期抑制或阻断可抑制LC3Ⅱ的形成,而自噬后期抑制或阻断可导致LC3Ⅱ的蓄积。这就提示,H-RasV12过度表达对自噬活性的抑制作用,发生于自噬过程的后期,也就是自噬体形成以后。因此,H-RasV12过度表达抑制自噬可能还可通过PI3K通路之外的其他机制进行调控。
我们认为H-RasV12过度表达对自噬的抑制在H-RasV12相关的肿瘤的发生方面可能具有重要的意义。目前的研究表明,自噬后期的抑制和阻断可将本是保护机制的自噬变为破坏性强的负面机制。因为自噬环路后段的干扰会严重破坏细胞的质量控制,从而导致功能障碍的内质网释放具有细胞毒性的氧自由基,这些可导致基因完整性的改变[15]。虽然H-RasV12过度表达的细胞绝大多数会进入OIS状态,甚至发生细胞死亡,但是少部分细胞可能通过瓶颈效应,即通过发生有利于癌变的基因突变,来克服各种保护机制发生癌变[7]。然而,本研究尚并不能回答H-RasV12过度表达抑制自噬与Ras诱导的癌变之间是否有直接的关系。并且,这种抑制作用是否具有广泛的代表性也需要进一步研究。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | 蔡世忠,王亚平.细胞衰老与细胞自噬的生物学关联及其意义[J].生命科学,2011,23:335-341. |
| [2] | Young A R,Narita M,Ferreira M,Kirschner K,Sadaie M,Darot J F,et al.Autophagy mediates the mitotic senescence transition[J].Genes Dev,2009,23: 798-803. |
| [3] | 郑志超,李西川,杜 玮,刘 喆.在人类非小细胞肺癌细胞A549中沉默K-Ras降低自噬水平[J].天津医科大学学报,2013,19:264-266. |
| [4] | 董郁红,刘立鑫,赵小玲,韩晓静,董久玲,刘宏侠.自噬基因Beclin 1在甲状腺乳头状癌中的表达及意义[J].中国肿瘤临床与康复,2013,20:217-219. |
| [5] | 唐中园,张 宁,狄 文,李卫平.自噬在癌症中的双重作用[J].上海交通大学学报:医学版,2013,33:1405-1410. |
| [6] | 梁蓓蓓,郭亚军,赵 健.营养缺乏状况下干扰ASPP2通过调节自噬促进肝癌细胞增殖[J].第二军医大学学报,2013,34:266-270. Liang B B,Guo Y J,Zhao J.ASPP2 gene silence promotes hepatocellular carcinoma cell proliferation via regulating autophagy under starvation[J].Acad J Sec Mil Med Univ,2013,34:266-270. |
| [7] | Marino G,Martins I,Kroemer G.Autophagy in Ras-induced malignant transformation: fatal or vital [J].Mol Cell,2011,42:1-3. |
| [8] | 郑海燕,王兴芬,孙保存,张晓阳,许丽萍.大肠癌发生发展中自噬基因Beclin1的表达及其与增殖和凋亡相关基因的关系探讨[J].中国肿瘤临床,2011,38:617-625. |
| [9] | 赵建祥,贺 华,马建芳,孙青芳,沈建康,卞留贯.饥饿诱导胶质瘤细胞自噬发生及Beclin-1表达的变化[J].第二军医大学学报,2010,31:933-936. Zhao J X,He H,Ma J F,Sun Q F,Shen J K,Bian L G.Starvation-induced autophagy in glioma and changes in Beclin-1 expression[J].Acad J Sec Mil Med Univ,2010,31:933-936 |
| [10] | Lock R,Roy S,Kenific C M,Su J S,Salas E,Ronen S M,et al.Autophagy facilitates glycolysis during ras-mediated oncogenic transformation [J].Nat Rev Mol Biol Cell,2011,22:165-178. |
| [11] | Bjørkøy G,Lamark T,Brech A,Outzen H,Perander M,Øvervatn A,et al.p62/SQSTM1 forms protein aggregates degraded by autophagy and has a protective effect on huntingtin-induced cell death [J].J Cell Biol,2005,171: 603-614. |
| [12] | Wang Y,Wang X D,Lapi E,Sullivan A,Jia W,He Y,et al.Autophagic activity dictates the cellular response to oncogenic RAS [J].Proc Natl Acad Sci USA,2011,109:13325-13330. |
| [13] | Schmukler E,Grinboim E,Schokoroy S,Amir A, Wolfson E,Kloog Y,et al.Ras inhibition enhances autophagy,which partially protects cell from death [J].Oncotarget,2013,4:142-152. |
| [14] | Furuta S,Hidaka E,Ogata A,Yokota S,Kamata T.Ras is involved in the negative control of autophagy through the class Ⅰ PI3-kinase [J].Oncogene,2004,23:3898-3904. |
| [15] | White E.Deconvoluting the context-denpendent role for autophagy in cancer [J].Nat Rev Cancer,2012,12:401-410. |
 2014, Vol. 35
2014, Vol. 35


