2. 唐山市开平区医院急诊科, 唐山 063021;
3. 唐山市丰南区医院神经内科, 唐山 063300
2. Department of Emergency, Hospital of Kaiping District, Tangshan 063021, Hebei, China;
3. Department of Neurology, Hospital of Fengnan District, Tangshan 063300, Hebei, China
帕金森病(Parkinson disease,PD)是一种常见于中老年的神经变性疾病,临床上以静止性震颤、肌强直、运动迟缓和姿势步态障碍为主要特征,常伴胃排空延迟、便秘等胃功能障碍[1]。PD胃功能障碍的发生机制尚不清楚,可能与胃肠神经系统(enteric nervous system,ENS)内神经递质的变化密切相关[2-4]。酪氨酸羟化酶(tyrosine hydroxylase,TH)是儿茶酚胺类活性物质生物合成的限速酶,这种酶染色阳性的神经元可能产生多巴胺,TH的变化可能与PD的发生发展密切相关[5]。一氧化氮(nitric oxide,NO)是ENS 主要抑制性神经递质之一,在体内由神经元型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)催化所产生,介导平滑肌的松弛效应,在胃肠道蠕动反射中介导下行性抑制作用[6]。司来吉兰(咪多吡,selegiline)是一种常用的单胺氧化酶B抑制剂,能保护黑质细胞免于各种神经毒素的侵害而阻止PD进展,具有神经保护作用[7],但其对PD模型大鼠胃功能障碍有何影响尚不明确。本研究通过观察司来吉兰对PD 模型大鼠胃窦TH和nNOS表达的影响,探讨司来吉兰对PD患者胃功能障碍的治疗机制。
1 材料和方法
1.1 主要试剂与仪器
司来吉兰(批号H20040400;产地Orion Corporation Espoo,Finland),片剂,规格5 mg/片;鱼藤酮(批号201212)购自北京博奥森生物工程有限公司;市售葵花油;SP-0023免疫组化试剂盒(批号201302)、兔抗大鼠TH抗体和兔抗大鼠nNOS抗体均购自北京博奥森生物工程有限公司;DAB显色液购自北京中杉金桥生物技术有限公司;SDS-聚丙烯酰胺凝胶电泳低分子量标准蛋白购自华美生物工程有限公司;奥林巴斯BX63全自动显微镜扫描系统由日本奥林巴斯公司提供。高速台式离心机购自上海安亭科学仪器厂。 1.2 实验动物与分组
健康雄性SD大鼠72只,体质量250~300g,由北京华阜康生物科技股份有限公司供给,合格证号:SCXK(京)2013-0013。在河北联合大学屏障环境动物实验室饲养,室温控制在(23±2)℃,自然光照,自由进食。适应饲养2周后,将大鼠随机分为正常对照组、PD模型组和司来吉兰治疗组,并根据预实验结果将各组随机分为模型制备成功后4 d、8 d 两亚组。每组各12只大鼠。 1.3 PD模型制备
采用颈背部皮下注射鱼藤酮制备PD模型[8]。鱼藤酮以葵花油溶解配制成2 mg/mL鱼藤酮葵花油乳液,充分震荡混匀后避光保存。模型组和司来吉兰组大鼠每日经颈背部皮下注射鱼藤酮葵花油乳液(鱼藤酮剂量为2 mg/kg),对照组每日颈背部皮下注射等量葵花油,待模型制备成功后停止注射。以出现行为学改变作为判定模型成功的指标[9],选择得分2~6分者作为实验大鼠。 1.4 治疗方法
模型制备成功后,对照组和模型组每日灌胃给生理盐水,治疗组每日灌胃给司来吉兰0.5 mg/kg,根据亚组分组情况分别连续给药4 d 或8 d。 1.5 胃固体食物残留率测定
参照朱红灿等[6]报道的方法,各组分别取6只大鼠,禁食不禁水12 h后自由进食1 h移去食物,进食前后分别称量食物以计算食物的消耗量。2h后腹腔注射10%水合氯醛麻醉处死大鼠,取胃用滤纸拭干后称量,沿胃大弯剪开胃体,洗去胃内容物后拭干称量净质量,测定胃固体食物残留率:胃固体食物残留率(% )=(胃全质量-胃净质量) /食物消耗量×100%。 1.6 免疫组化法检测TH和nNOS表达
按试剂盒说明书操作要求检测各组TH和nNOS蛋白表达。各组分别取6只大鼠,用10%水合氯醛(3 mL/kg)腹腔麻醉动物,麻醉后经4%多聚甲醛灌流固定,剖腹后取大鼠胃窦1.5~2.0 cm,清洗干净胃内容物,剪去胃窦周围的脂肪和结缔组织,用4%多聚甲醛固定24 h。常规包埋、切片、脱蜡、水化、抗原修复;0.3%过氧化氢封闭内源性过氧化物酶20 min;1%山羊血清封闭 20 min,分别加入一抗(兔抗鼠 nNOS多抗;兔抗鼠 TH 单抗),4℃孵育过夜;加生物素化二抗,37℃孵育 30 min;再加辣根酶标记的链酶卵白素,37℃孵育 30 min。以上各步骤均用PBS 缓冲液浸洗 5 min×3 次。后加 DAB 显色,光镜下观察。以胞质呈棕黄色,胞核呈浅蓝色或紫蓝色为阳性细胞。高倍镜下随机观察各组大鼠胃窦不重叠的6个视野,进行TH和nNOS阳性细胞计数。 1.7 蛋白质印迹法检测TH和nNOS 蛋白表达
取胃固体食物残留率测定后胃窦1.5~2.0 cm,清洗干净胃内容物,剪去胃窦周围的脂肪和结缔组织,即刻投入液氮,后放入EP管中-80℃保存。冷冻胃窦按40 mg/kg加入蛋白裂解液,电动匀浆器匀浆,冰浴中静置30 min,12 000 r/min(r=3 cm),4℃,离心10 min。取上清液-20℃保存。经蛋白定量后分装,用4℃预冷PBS调蛋白浓度到一致(5.3 μg/μL),加入5×的上样缓冲液,使终浓度为1×,在沸水中至少煮5 min,冷却至室温,置于4℃备用。取各组制备好的胃窦组织15 μL (蛋白质量80 μg),10%、15% SDS-PAGE电泳分离后,以湿转法电转移至聚偏二氟乙烯 (PVDF) 膜上。将PVDF膜放入封闭液中封闭1 h,加入稀释好的一抗(兔抗鼠 nNOS多抗;兔抗鼠TH 单抗),浓度为1∶1 000,4℃孵育过夜,PBS洗膜,加入相应稀释好的二抗(羊抗兔1∶2 000),37℃反应1 h,洗膜,以ECL显色,胶片曝光显影,结果用Image J分析。
1.8 统计学处理 所得数据以Excel建库,用SPSS19.0软件包进行统计分析。计量资料以 ±s 表示。数据做正态性W检验和方差齐性Levene检验,采用随机区组设计的方差分析比较组间差异。检验水准(α)为0.05。
2 结 果
动物模型大鼠经颈背部皮下注射鱼藤酮7周左右,出现PD行为学改变,其中4只由于病情过重给予淘汰,另有2只死亡,均给予相应补充。模型组大鼠各时间点胃内固体食物残留率均高于对照组(均P<0.01),治疗组大鼠各时间点胃内固体食物残留率均低于模型组(P<0.05或P<0.01),且治疗后8 d亚组大鼠胃内固体食物残留率低于治疗4d亚组(P<0.05)。具体数据见表 1。
|
|
表 1各组大鼠胃固体食物残留率 Tab 1 Residual rate of solid food in the gastric antrum of rats in each group |
免疫组化结果显示,对照组大鼠各时间点胃窦可见多量TH阳性细胞表达和少量nNOS阳性细胞表达。与对照组比较,模型组各时间点胃窦TH阳性细胞表达均减少,nNOS阳性细胞表达均增加,差异有统计学意义(均P<0.01)。与模型组比较,治疗组各时间点胃窦TH阳性细胞表达均增加,nNOS阳性细胞表达均减少,差异均有统计学意义(P<0.05或P<0.01)。与治疗组术后4 d亚组比较,术后8 d 亚组大鼠各时间点胃窦TH阳性细胞数升高(P<0.05),nNOS阳性细胞数降低(P<0.05)。 具体见表 2和图 1。
|
|
表 2 各组大鼠胃窦TH、nNOS阳性细胞数的比较 Tab 2 Numbers of TH and nNOS positive cells in the gastric antrum of rats in each group |
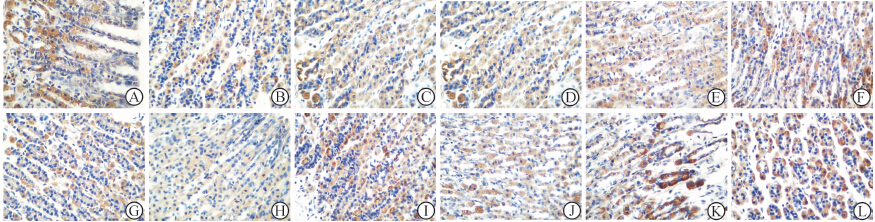 | 图1 各组大鼠胃窦TH和nNOS免疫组化结果 Fig.1 Effects of hypothermia infusion on liver histology A-F:TH;G-L:nNOS. A,G: Control group 4 d; B,H: Model group 4 d; C,I: Treatment group 4 d; D,J: Control group 8 d; E,K:Model group 8 d; F,L: Treatment group 8 d. Original magnification:×400 |
蛋白质印迹检测结果显示,对照组大鼠各时间点胃窦TH表达量较多,nNOS表达量较少。与对照组比较,模型组各时间点胃窦TH表达量减少,nNOS表达量增加,差异有统计学意义(均P<0.01)。与模型组比较,治疗组各时间点胃窦TH表达量增加,nNOS表达量减少,差异均有统计学意义(P<0.05或P<0.01)。与治疗组术后4 d时比较,治疗后8 d 时大鼠各时间点胃窦TH表达量增加,nNOS表达量降低(均P<0.05)。具体见表 3和图 2。
|
|
表 3 各组大鼠胃窦TH和nNOS 蛋白质印迹检测结果 Tab 3 Numbers of TH and nNOS positive cells in the gastric antrum of rats in each group |
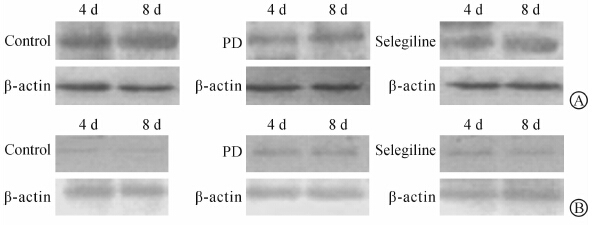 | 图2 各组大鼠胃窦TH(A)和nNOS(B)蛋白质印迹检查结果 Fig.2 Western blotting results of TH (A) and nNOS (B) protein expression in the gastric antrum of rats in each group TH: Tyrosine hydroxylase; nNOS: Neuronal nitric oxide synthase; PD: Parkinson disease |
PD患者常伴胃功能障碍等非运动症状,胃排空延迟是PD患者常见的上消化道功能紊乱症状[10]。本研究结果表明PD模型组大鼠进餐2 h后胃内固体食物残留率大于对照组,说明PD模型组大鼠胃排空速度明显减慢,PD可引起胃功能障碍,这与Greene等[11]报道的结果一致。
PD的主要病理改变是黑质多巴胺能神经元的变性丢失,PD 除了中枢神经变性外,胃肠神经亦发生变性,但其具体作用机制目前尚不清楚,有学者发现PD患者胃窦肌层内多巴胺能神经元的数量较对照组明显减少[12],提示PD胃功能障碍可能与胃窦神经系统内神经递质的变化密切相关[2-4]。TH是儿茶酚胺类活性物质生物合成的限速酶,在多巴胺生物合成的调节中发挥重要作用[13]。NO是一种具有很强氧化还原特性的自由基性质的气体,在中枢神经系统中发挥着重要作用。NO的半衰期非常短并难以控制,而一氧化氮合酶(nitric oxide synthase,NOS)则相对稳定,且NOS广泛分布于神经元中,其在神经系统损伤中的表达变化已成为研究热点。 目前NOS包括3种不同的亚型,分别为神经元型(nNOS) 、内皮型(eNOS) 及诱导型(iNOS) 。有报道[14]PD大鼠出现的胃肠功能障碍可能与胃肠神经系统nNOS水平降低有关。本研究中免疫组化法和蛋白质印迹检测结果均显示,模型组大鼠胃窦TH表达比对照组明显降低,胃窦nNOS表达比对照组明显升高,表明PD大鼠胃窦TH减少及nNOS增多在PD的胃功能障碍发病过程中起着重要作用。
司来吉兰是一种常用的单胺氧化酶B抑制剂,它能够选择性不可逆地抑制多巴胺降解为高香草酸,从而增加多巴胺的蓄积,同时也能减少突触前膜对多巴胺的再摄取,促进多巴胺的释放。这些都延长了外源性及内源性多巴胺的作用时间而使PD患者的临床症状得到改善,在临床应用中表现为较好的治疗效果和耐受性[15-16]。另外,研究证实司来吉兰还能够抵抗氧自由基的氧化作用,上调超氧化物歧化酶和过氧化氢酶水平,减少细胞凋亡[17];产生神经营养因子,保护黑质细胞免于各种神经毒素的侵害[18-19],阻止PD进展。本研究显示,经司来吉兰治疗后,PD模型大鼠胃固体食物残留减少,同时,大鼠胃窦TH表达明显增加,胃窦nNOS表达明显减少,表明司来吉兰能改善PD患者的胃肠功能障碍,其作用机制可能与其减轻PD模型大鼠胃窦多巴胺能神经元的损伤和抑制nNOS表达有关,且随着时间的延长,作用更明显。这为PD患者胃功能障碍的防治提供了一定的理论依据。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Pfeiffer R F.Gastrointestinal dysfunction in Parkinson's disease [J].Parkinsonism Relat Disord,2011,17:10-15. |
| [2] | Chaumette T,Lebouvier T,Aubert P,Lardeux B,Qin C,Li Q,et al.Neurochemical plasticity in the enteric nervous system of a primate animal model of experimental Parkinsonism[J].Neurogastroenterol Motil,2009,21:215-222. |
| [3] | Anderson G,Noorian A R,Taylor G,Anitha M,Bernhard D,Srinivasan S,et al.Loss of enteric dopaminergic neurons and associated changes in colon motility in an MPTP mouse model of Parkinson's disease[J].Exp Neurol,2010,207:4-12. |
| [4] | Tian Y M,Chen X,Luo D Z,Zhang X H,Xue H,Zheng L F,et al.Alteration of dopaminergic markers in gastrointestinal tract of different rodent models of Parkinson's disease[J].Neuroscience,2008,153:634-644. |
| [5] | 张晓录,张逢春,李尧华.酪氨酸羟化酶与帕金森病的关系研究[J].北华大学学报:自然科学版,2005,6:224-227. |
| [6] | 朱红灿,赵 静,张 华,罗常月,李倩倩,任秀花,等.帕金森病大鼠胃肠功能障碍的机制[J].临床神经病学杂志,2011,24:202-205. |
| [7] | Zhao Q,Cai D,Bai Y.Selegiline rescues gait deficits and the loss of dopaminergic neurons in a subacute MPTP mouse model of Parkinson's disease[J].Int J Mol Med,2013,32:883-891. |
| [8] | 常宇涛,罗小光,任 艳.鱼藤酮损伤大鼠黑质致行为学及黑质多巴胺能神经元损伤[J].解剖科学进展,2011,17:60-62. |
| [9] | 陈 忻,张 楠,赵 晖,穆 阳.鱼藤酮致帕金森病大鼠行为学与黑质病理损伤的关系[J].中国神经精神疾病杂志,2008,34:232-234. |
| [10] | 李 林,张博爱.帕金森病的消化系统功能紊乱[J].国际神经病学神经外科学杂志,2010,37:517-520. |
| [11] | Greene J G,Noorian A R,Srinivasan S.Delayed gastric emptying and enteric nervous system dysfunction in the rotenone model of Parkinson's disease.[J].Exp Neurol,2009,218:154-161. |
| [12] | Taylor T N,Caudle W M,Shepherd K R,Noorian A,Jackson C R,Iuvone P M,et al.Nonmotor symptoms of Parkinson's disease revealed in an animal model with reduced monoamine storage capacity[J].J Neurosci,2009,29:8103-8113. |
| [13] | 张 阳,张志坚,俞晓岚,黄志新,吴秀丽.慢病毒介导的新型Tet-On系统大鼠GDNF和TH双基因脑内转移对帕金森病大鼠模型的保护作用[J].中国药理学通报,2011,27:234-239. |
| [14] | 赵 静,郭刚花,藏卫东,张 华,罗常月,李倩倩.帕金森病大鼠胃肠功能障碍和肌间神经丛一氧化氮变化的研究[J].中风与神经疾病杂志,2011,28:597-600. |
| [15] | Robottom B J.Efficacy,safety,and patient preference of monoamine oxidase B inhibitors in the treatment of Parkinson's disease [J].Patient Prefer Adherence,2011,5:57-64. |
| [16] | 沈鸿雁,徐赫男,胡 春.用于帕金森病治疗的单胺氧化酶B抑制剂的临床评述[J].中国药物化学杂志,2011,21:483-488. |
| [17] | Ebadi M,Sharma S,Shavali S,El Refaey H.Neuroprotective actions of selegiline [J].J Neurosci Res,2002,67:285-289. |
| [18] | Nagatsu T,Sawada M.Molecular mechanism of the relation of monoamine oxidase B and its inhibitors to Parkinson's disease:possible implications of glial cells[J].J Neural Transm Suppl,2006,71:53-65. |
| [19] | Weinreb O,Amit T,Sagi Y,Drigues N,Youdim M B.Genomic and proteomic study to survey the mechanism of action of the anti-Parkinson's disease drug,rasagiline compared with selegiline,in the rat midbrain[J].J Neural Transm,2009,116:1457-1472. |
 2014, Vol. 35
2014, Vol. 35


