2. 安徽中医学院第一附院神经内科, 合肥 230031
2. Department of Neurology, the First Affiliated Hospital of Anhui Traditional Chinese Medicine, Hefei 230031, Anhui, China
肝豆状核变性(Wilson’s disease,WD)是常染色体隐性遗传的铜代谢障碍疾病,患病率为1/50 000~1/30 000[1,2,3],好发于儿童、青少年。WD患者由于ATP7B基因发生功能丧失性突变,使铜沉积于肝、脑等处,导致多脏器损害,临床表现多样,以肝、神经系统的损害为主,有不同程度的锥体外系病变、精神障碍、角膜 K-F 环等。1993 年 Bull等克隆了ATP7B 基因,该基因定位于13q14.3,基因全长为78 821 bp,mRNA 长8.5 kb,含21个外显子和20个内含子;编码的ATP7B蛋白含1 465个氨基酸残基,相对分子质量159 000,为 P 型铜离子转运ATP 酶[4,5,6,7]。ATP7B突变可导致细胞内铜离子转运、排出功能丧失,迄今已发现 651 种突变,突变形式有错义/无义突变 (占63% )、小片段缺失(占17%)、小片段插入(占8%)、剪接突变(占9%)、大片段缺失(占2%)、同义突变(占2%)[3]等;以往国内鲜有报道复合突变(指有2个或2个以上突变点)。本研究对WD患者ATP7B基因全部外显子5′ 端 → 3′ 端进行测序,发现了一些ATP7B基因错义、插入突变及复合突变,现报告如下。 1 资料和方法 1.1 研究对象
67例中国汉族WD患者均为2009年5月至2013年1月在安徽中医药大学第一附属医院接受治疗的患者,诊断标准参照中华医学会WD诊断指南[8]及美国Roberts 和 Michael 编写的AASLD的WD诊断及治疗指南[9];其中男46例,女21例,年龄6~56岁,平均(21.7±2.6)岁。其中 34例为先证者患者,其余的 33例患者来自于 12 个患者家庭。选取安徽中医药大学第一附属医院中国汉族健康输血员20例,设为正常对照组,其中男14例,女6例,年龄21~32 岁,平均(27.7±2.8岁)。本研究经医院伦理委员会批准,所采集样本对象均有临床数据调查表并签署知情同意书。 1.2 基因组 DNA 抽提
取67例WD患者和20例正常人口腔黏膜细胞,制备细胞悬液,4℃保存。在1.5 mL离心管中,加入200 μL口腔黏膜细胞悬液,再加裂解缓冲液STE 410 μL,10%SDS 90 μL,蛋白酶K液(100 μg/mL)5 μL,65℃消化15 h。加入300 μL饱和NaCl液轻摇3 min。加氯仿340 μL,混匀后高速离心,将上清液吸入另一离心管中,加异丙醇650 μL混匀后高速离心。弃上清液,加500 μL 75%乙醇,高速离心2次,弃上清得DNA 沉淀,室温干燥1.5 min,加30 μL蒸馏水溶解,4℃保存。取3 μL基因组DNA溶液经1.5%琼脂糖凝胶电泳检查质量,为一条带,达电泳纯;基因组DNA溶液经紫外分光光度计检测,D260/D280为1.8,纯度合格;基因组DNA溶液浓度为1 μg/μL。 1.3 PCR引物的设计
PCR引物设计参考美国国立生物技术信息中心(NCBI)的ATP7B基因序列信息,用 Premier 5 软件设计21对外显子+5′ 端和+3′端的PCR扩增引物,由上海生工生物工程技术服务有限公司合成,引物信息见表 1。
|
|
表 1 ATP7B 基因外显子 PCR 扩增引物及序列 Tab 1 Primers for PCR amplification of ATP7B gene exons |
PCR反应总体积 10 μL,含Taq 酶1 U,2 μmol/L 上、 下游引物各 1 μL,基因组DNA液1 μL,10 × buffer 1 μL,50 mmol/L MgCl2 0.3 μL,10 mmol/L dNTPs 0.2 μL,水补齐至10 μL。外显子短片段扩增条件: 95℃预变性5 min,PCR扩增 40个循环 (95℃ 15 s、60℃ 20 s、72℃ 30 s),72℃下延伸15 min,4℃保存。外显子(2、11、12、18、19、21)长片段扩增条件:95℃预变性5 min,PCR扩增 40个循环 (95℃ 15 s、60℃ 20 s、72℃ 2 min),72℃下延伸15 min,4℃ 保存。 1.5 PCR产物测序
PCR反应产物经Qiaquick Spin柱纯化后,由广州华大生物科技有限公司检验中心使用ABI3730型测序仪进行荧光全自动DNA正向测序及反向测序,用SeqMan、BioEdit分析软件分析ATP7B 基因全部外显子5′端 →3′端的突变,对初步发现的突变中有疑问者,均经PCR克隆测序后再确认;分析测序图时,注意使用核苷酸荧光扫描峰较高且噪声线几乎贴近底线的图分析,以免噪声干扰;且测序引物一般距离要分析的外显子若干bp。 1.6 突变分析
扩增67例WD患者和20例正常人ATP7B基因的所有外显子5′ 端 → 3′端,并将其DNA的测序结果与由GenBank中获得的正常人ATP7B基因相应序列进行比对,分析突变情况。 2 结 果
本次研究通过对 67 例WD患者的 ATP7B 基因的全部外显子5′端 → 3′端进行直接扩增测序,发现16例纯合子突变(12例Arg778Leu纯合子突变和4例Arg919Gly纯合子突变),5例复合突变,31例单纯杂合子突变,15例未检出突变,突变总检出率为77.61%(52/67)。5种国内罕见的ATP7B基因复合突变的具体信息见表 2,相应的测序图见图 1。通过PubMed数据库中文献检索,以及在肝豆状核变性突变网站 (http://www.wilsondisease.med.ualberta.Ca/database.asp)和人类突变数据库(http://www.hgmd.cf.ac.uk/ac/validate.phP)进行查询,发现这5种ATP7B基因复合突变在中国汉族人群中罕见报道。正常对照组中未发现ATP7B 基因突变。
|
|
表 2 肝豆状核变性患者ATP7B基因的新复合突变 Tab 2 New complex mutations of ATP7B gene in Wilson’disease patients |
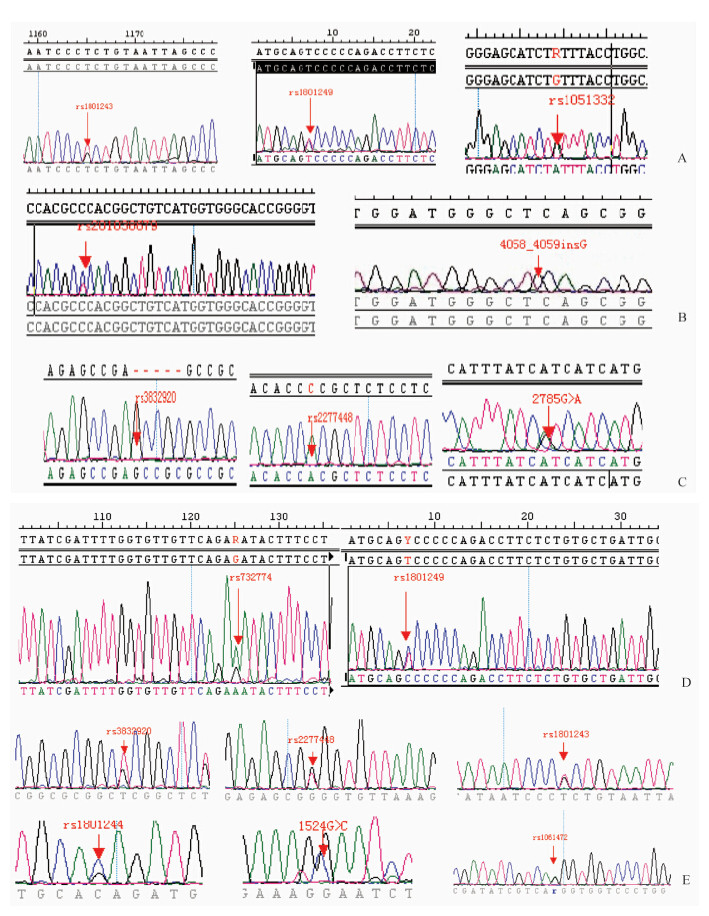 | 图 1 5种ATP7B 基因复合突变测序图 Fig 1 Sequences of 5 complex mutations of ATP7B gene A: Patient 7,exon 2,16,and 21 mutation; B: Patient 15,exon 13,20 mutation; C:Patient 26,exon 1,1,and 12 mutation; D:Patient 43,exon 12,16 mutation; E: Patient 51,exon 1,1,2,3,3,and 10 mutation |
铜是维持人正常生理活动必需的微量元素,参与机体氧化还原反应、细胞呼吸、活性氧防御、细胞代谢、生存或凋亡等,常参与形成铜蛋白、铜酶。肠道吸收的Cu2+进入肝门静脉,在血中90%与铜蓝蛋白结合,其余的与白蛋白、组氨酸等结合成三元复合体。细胞摄取 Cu2+ 时主要通过铜蓝蛋白、白蛋白及 组氨酸释放 Cu2+,经细胞表面的还原酶还原为Cu+,通过转运载体摄入细胞,再由还原型谷胱甘肽运输到不同细胞器,细胞内的Cu+ 能通过铜转运蛋白转运给铜蛋白,合成超氧化物歧化酶(SOD)、金属硫蛋白(MT)等;多余的 Cu+主要由ATP7B排出细胞。
一般肝细胞内的ATP7B主要定位于核周高尔基体外侧网络,当细胞质Cu+ 水平升高后,ATP7B移至细胞质,Cu+ 能结合、活化ATP7B,促进后者ATP 结合区结合 ATP、释放能量,使天冬氨酸激酶磷酸化区(P 区)磷酸化[10,11],再将Cu+ 转运至细胞膜,或者形成铜蓝蛋白排入血,或者把Cu+ 排入毛细胆管经肠道排出,从而避免过多Cu+ 积聚于细胞内。细胞质Cu+ 水平过高时,肝细胞也能经溶酶体小泡排出Cu+ [10]。
ATP7B分子有7个功能区,有的可发生突变:(1) N端区,有6个Cu+ 结合区(与1~6外显子相关),第1~4 Cu+ 结合区突变时,如已报道的 G85A、G591D等突变,患者可出现症状;(2) TGES 磷酸酶区(与11外显子相关),能使磷酸化的ATP7B第1 027位天冬酰胺去磷酸化,其突变后能使ATP7B过度磷酸化,丧失催化活性,停留在细胞膜,不能转运Cu+,如 G591D;(3) CPC 阳离子跨膜转运区(与7~10/12~13外显子相关)突变,会导致ATP7B一直停留在核周高尔基体、内质网,不能排出Cu+,如Arg778Leu、Gly937Ser等突变;(4) DKTGT天冬氨酸激酶磷酸化区(P区,与14~16外显子相关),ATP7B活化时,DKTGT基序中的D1027(天冬酰胺)磷酸化,使ATP7B能转移位置,如果该天冬酰胺突变,则阻断ATP7B形成ATP7B-酰基磷酸盐,使 ATP不能供应能量,ATP7B不能转移位置,也不能转运Cu+;(5) GDGV ATP结合区(N 区,与17~18 外显子相关),该区H1069等突变,ATP7B不能结合ATP,因而不能被 γ-磷酸化,不能形成ATP7B-酰基磷酸盐,不能转运Cu+,该区目前已发现至少40多种突变;(6) C端磷酸化作用区(DVP,与19~20 外显子相关);(7) C末端区(ACTGT区,与21外显子相关),参与调节ATP7B功能[10,11]。
本研究发现WD患者ATP7B基因复合突变的形式有一定异质性,7号患者有exon 2、16、21复合突变,第2外显子突变出现在第2 Cu+ 结合区,使ATP7B不能结合Cu+、排出Cu+ 减少;第16外显子突变出现在天冬氨酸激酶磷酸化区,使该区不能磷酸化,不能到细胞质结合Cu+,不能排Cu+;第21外显子突变在C 末端区,使ATP7B功能不正常,不能排Cu+,导致Cu+ 转运停滞,引起疾病发生。15号患者有exon 13、20复合突变,第13外显子突变出现在CPC 阳离子膜转运区,使ATP7B一直停留在核周高尔基体外侧网络、内质网,不能到细胞膜排出Cu+,第20外显子突变出现在磷酸化作用区,使ATP7B不能完全磷酸化,不能到细胞质结合Cu+,不能排出Cu+。26号患者有 exon 1、12复合突变,第1外显子突变出现在第1 Cu+ 结合区,使ATP7B不能结合Cu+、不能活化,ATP7B由高尔基体转移到细胞质的速度减慢,排出Cu+ 减少;第12外显子突变出现在CPC 阳离子膜转运区,使ATP7B一直停留在核周高尔基体外周网络、内质网,不能到细胞膜排出Cu+。43号患者有exon 12、16复合突变,第12外显子突变,不能排出Cu+;第16外显子突变出现在DKTGT 天冬氨酸激酶磷酸化区,阻断ATP7B形成ATP7B-酰基磷酸盐,ATP不能供应能量,ATP7B不能移位转运Cu+。51号患者有exon 1、2、3、10复合突变,第1、2、3外显子突变出现在第1、2、3 Cu+ 结合区1~3,使ATP7B不能结合Cu+、不能活化,排出Cu+ 减少;第10外显子突变出现在CPC 铜离子跨膜转运区,使ATP7B一直停留在核周高尔基体外周网络、内质网,不能到细胞膜排出Cu+[12,13]。
本研究检测的67例WD患者中,ATP7B基因突变率为77.61%,还发现了5种国内罕见的复合突变,显示ATP7B基因突变有较大的异质性。对WD患者ATP7B基因的复合突变,目前还有待进一步深入研究。Maier-Dobersberger等[14] 对ATP7B基因突变位点研究后认为,复合突变比单一突变者发病常更早。WD为一种常染色体隐性遗传性疾病,因此只有2个突变为直接导致疾病发生的,其余的一般均可视为单核苷酸多态性(SNPs)。SNPs可能在WD发生发展中起着一定的作用。从1995年到目前对WD中ATP7B基因突变的研究中,欧美患者的单突变类型主要是HIS1069Gln(28%)、Gly1266Lys(10%),其他突变各见于3%以下患者。许多国外资料显示,肝豆状核变性基因14号外显子第1 069位密码子突变是一个典型的热点突变,染色体突变频率高达28%~68.3%[15]。国内学者对中国WD患者基因突变研究后发现8号外显子Arg778Leu突变频率为11.4 %~60%[16],此突变公认为中国WD患者ATP7B基因第一突变热点,陆续报道的突变分布在外显子5、7、8、11、12,13、14、18,而对第二突变热点目前存在一定的争议性[17]。2013年复旦大学附属儿科医院报道,53例WD患者ATP7B基因突变频率91.5%,纯合子突变8例,复合杂合突变36例,杂合突变9例;复合杂合突变即有2个或2个以上突变点,因此在ATP7B全基因检测时,要仔细找出全部突变点[18]。复合突变一般分别来自父亲、母亲,2013年Coffey等[19] 也有同样报道,发现复合突变,提示可引发ATP7B多处功能损伤并与患者症状较重可能相关,值得重视,我们也将进一步研究。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Nicastro E,Loudianos G,Zancan L,D'Antiga L, Maggiore G,Marcellini M,et al.Genotype-phenotype correlationin Italian children with Wilson's disease[J].J Hepatol,2009,50:555-561. |
| [2] | Burkhead J L,Gray L W,Lutsenko S.Systems biology approach to Wilson's disease[J].Biometals,2011,24:455-466. |
| [3] | Seo J K.Diagnosis of Wilson disease in young children:molecular genetic testing and a paradigm shift from the laboratory diagnosis[J].Pediatr Gastroenterol Hepatol Nutr,2012,15:197-209. |
| [4] | Gojová L,Jansová E,Külm M,Pouchlá S,Kozák L. Genotyping microarray as a novel approach for the detection of ATP7B gene mutations in patients with Wilson disease[J].Clin Genet,2008,73:441-452. |
| [5] | Forbes N,Goodwin S,Woodward K,Morgan D G, Brady L,Coulthart M B,et al.Evidence for synergisthc effects of PRNP and ATP7B mutations in severe neuropsychiatric deterioration[J].BMC Med Genet,2014,15:22-34. |
| [6] | Gaier E D,Eipper B A,Mains R E.Copper signaling in the mammalian nervous system:synaptic effects[J].J Neurosci Res,2013,91:2-19. |
| [7] | Telianidis J,Hung Y H,Materia S,Fontaine S L.Role of the P-type ATPases,ATP7A and ATP7B in brain copper homeostasis[J].Front Aging Neurosci,2013,5:1-17. |
| [8] | 中华医学会神经病学分会帕金森病及运动障碍学组,中华医学会神经病学分会神经遗传病学组.肝豆状核变性的诊断与治疗指南[J].中华神经科杂志,2008,41:566-569. |
| [9] | Roberts E A,Schilsky M L. American Association for Study of Liver Diseases (AASLD).Diagnosis and treatment of Wilson disease:an update[J].Hepatology,2008,47:2089-2111. |
| [10] | 杨静芳,陈 彪.中国人肝豆状核变性基因突变的分布特征[J].中国临床康复,2004,8:690-692. |
| [11] | Fieten H,Leegwater P A,Watson A L,Rothuizen J.Canine models of copper toxicosis for undersanding mammalian copper metabolism[J].Mamm Genome,2012,23(1-2):62-75. |
| [12] | La Fontaine S,Ackland M L,Mercer J F.Mammalian copper-transporting P-type ATPases,ATP7A and ATP7B:emerging roles[J].Int J Biochem Cell Biol,2010,42:206-209. |
| [13] | Braiterman L T,Murthy A,Jayakanthan S,Nyasae L,Tzeng E,Gromadzka G,et al.Distinct phenotype of a Wilson disease mutation reveals a novel trafficking determinant in the copper transporter ATP7B[J].Proc Natl Acad Sci U S A,2014,111:E1364-E1373. |
| [14] | Maier-Dobersberger T,Ferenci P,Polli C,Balać P, Dienes H P,Kaserer K,et al.Detection of the His1069Gln mutation in Wilson disease by rapid polymerase chain reaction[J].Ann Intern Med,1997,127:21-26. |
| [15] | Lepori M B,Zappu A,Incollu S,Dessì V,Mameli E,Demelia L,et al.Mutation analysis of the ATP7B gene in a new group of Wilson's disease patients:contribution to diagnosis[J] Mol Cell Probes,2012,26:147-150. |
| [16] | Ye S,Gong L,Shui Q X,Zhou L F.Wilson disease:identification of two novel mutations and clinical correlation in Eastern Chinese patients[J].World J Gastroenterol,2007,13:5147-5150. |
| [17] | Lin C W,Er T K,Tsai F J,Liu T C,Shin P Y,Chang J G.Development of a high-resolution melting method for the screening of Wilson disease-related ATP7B gene mutations[J].Clin Chim Acta,2010,411(17-18):1223-1231. |
| [18] | 陆 怡,王建设,俞 蕙,王小红.儿童肝豆状核变性临床表型及ATP7B基因突变关联性分析[J].中国循证儿科杂志,2013,8:346-351. |
| [19] | Coffey A J,Durkie M,Hague S, Mclay K,Emmerson J,Lo C,et al.A genetic study of Wilson's disease in the United Kingdom [J].Brain,2013,136(Pt5):1476-1487. |
 2014, Vol. 35
2014, Vol. 35


