2. 第二军医大学东方肝胆外科医院生物治疗科, 上海 200438;
3. 第二军医大学东方肝胆外科医院基因-病毒治疗实验室, 上海 200438
2. Tumor Immunology and Gene Therapy Center, Eastern Hepatobiliary Surgery Hospital, Second Military Medical University, Shanghai 200438, China;
3. Laboratory of Viral and Gene Therapy, Eastern Hepatobiliary Surgery Hospital, Second Military Medical University, Shanghai 200438, China
近年来,利用肿瘤浸润淋巴细胞(tumor-infiltrating lymphocyte,TIL)开展的过继细胞治疗在黑素瘤的治疗中取得令人振奋的临床效果[1]。然而对大部分肿瘤而言,难以获得肿瘤特异性的TIL细胞[2]。理想的替代方法就是对T细胞进行体外遗传操作,使其具备肿瘤特异性的增殖和杀伤功能。
嵌合抗原受体(chimeric antigen receptor,CAR)由一个scFv单链抗体(由抗体VH区氨基酸序列和VL区氨基酸序列经Linker连接而成),通过铰链结构与源于TCR复合体或者IgE 高亲和受体的跨膜和胞内信号结构域(源自CD3ζ/FcεRIγ免疫受体酪氨酸活化基序、源自CD28/4-1BB/OX40/ICOS/DAP10/LCK共刺激信号分子胞内结构域)连接构成[3]。经CAR遗传修饰的T细胞(CAR-T),能够高效识别和杀伤由于MHC分子或抗原加工相关蛋白酶体低表达、逃逸TCR介导免疫反应的肿瘤细胞[4]。至目前为止,CAR结构已发展至3代,涉及肿瘤抗原包括CD19、HER2、CEA、PSCA等,已有29项CAR-T进入临床试验[5],取得理想的临床疗效。因此,本研究尝试应用CAR修饰的T细胞株特异杀伤高表达黏蛋白1(mucin 1,MUC1)的肝癌细胞,为后续研究奠定基础。
1 材料和方法 1.1 主要材料及试剂
限制性内切酶购自NEB公司(New England Biolabs);细胞株HEK-293T、QGY-7701、L02、Jurkat及质粒pMD.G(QJ005)、pCMVdelta8.91(QJ001)、pLV180为本实验保存。MUC1单链抗体基因克隆于HMFG2,HMFG2 VH:AM747043,HMFG2 VL:AF042143[6]。载体质粒结构设计主要参考Sadelain等[7]设计的嵌合抗原受体的结构。各个基因在GenBank中的序列号如下:CD8a hinge+TM基因序列号为AY039664.1,CD28基因序列号为XM_006712862.1,CD137基因序列号为U03397.1,CD3ξ基因序列号为AF228312.1,质粒载体基因交由捷瑞(Generay)公司全基因合成。2 mol/L CaCl2,2×Hank液由实验室自配。Cell Counting Kit-8(碧云天,产品编号C0037),乳酸脱氢酶细胞毒性检测试剂盒(碧云天,产品编号C0017),人IL-2 ELISA kit(上海依科赛公司,货号EH002-96)。Human MUC-1 Allophycocyanin MAb (Clone 604804);Mouse IgG2B、Mouse IgG2B Allophycocyanin Isotype Control (同型对照)均购自R&D公司。Recombinant human MUC1-Fc(Sinobiological公司,12123-H02H);Purified Mouse Anti-Human CD3ξ(BD公司,货号551033)。
1.2 质粒的构建与鉴定
将全基因合成的Anti-MUC1(VH-VL)-CD3ζ-F2A-hrGFP和CD28-CD137-CD3ζ-F2A-hrGFP基因通过基础分子克隆技术装入慢病毒载体,分别构建pLV180-MUC1-CAR-F2A-hrGFP与pLV180-G3MUC1-CAR-F2A-hrGFP,以及不含CAR基因的对照载体pLV180-hrGFP。 1.3 慢病毒包装
将HEK-293T细胞4×106/孔的密度铺于100 mm培养皿中,用含10%胎牛血清的DMEM培养液于37℃、5% CO2孵箱培养至60%~80%融合度时,换8 mL无血清DMEM培养液于37℃、5% CO2孵箱培养。2 h后,用三质粒磷酸钙法包装慢病毒,具体步骤如下:在1个10 mL离心管中加慢病毒载体质粒30 μg,pCMVdelta8.91(QJ001) 20 μg,pMD.G(QJ005) 10 μg,2 mol/L CaCl2 124 μL,加双蒸水补全至1 mL,再加1 mL 2×Hank,充分混匀,室温静置20 min,然后逐滴加入到上述100 mm 培养皿中,37℃、3% CO2孵箱培养,6~8 h后,换新鲜含10%胎牛血清的DMEM于37℃、5% CO2孵箱培养培养。48 h 和72 h 后分别收集100 mm 培养皿中含病毒的上清液,离心去除细胞碎片,0.45 μm 滤膜(Millipore)过滤后,将病毒上清液移入Millipore 浓缩柱,离心 30 min,浓缩至100~200 μL,将浓缩的病毒液移入EP管,-80℃冰箱中保存。 1.4 慢病毒感染Jurkat细胞
将生长状态良好的Jurkat细胞以5×105/孔的密度接种于6孔板中,加无血清RPMI 1640培养基至2 mL,加入2 μL 8 μg/mL Polybrene,加入100 μL纯化病毒液,混匀,于37℃、5% CO2孵箱培养,8 h后换成10%FBS的RPMI 1640培养,48 h 后观察绿色荧光。 1.5 Western 印迹检测CAR表达
离心收集生长状态良好的经慢病毒感染的5×105个Jurkat 细胞株,用预冷的生理盐水清洗2遍,加入含蛋白酶抑制剂的细胞裂解液160 μL,放在冰盒中于摇床上轻微摇晃,30 min 后加40 μL 5×上样buffer,然后在100℃水浴锅里煮沸10 min,蛋白样品保存于-80℃冰箱或直接使用。配制好SDS-PAGE蛋白胶,点样,跑电泳,将蛋白转移到PVDF膜上,5%脱脂奶粉封闭2 h,加入稀释过的一抗,4℃冰箱过夜,取出膜后,用TBST洗3次,每次10 min,加入稀释过的二抗,孵育2 h,取出膜后,用TBST洗3次,每次10 min,加显色剂,最后在凝胶成像仪上拍照。 1.6 细胞增殖实验
用5 μg/mL MUC1抗原蛋白包被96孔板过夜,第2天,用PBS洗1遍,每孔加入2 000 个Jurkat细胞,补齐培液至100 μL,37℃、5% CO2孵箱孵育48 h。每孔加10 μL CCK-8溶液,37℃、5%CO2培养90 min,在450 nm测定光密度值(D)。详细步骤参见CCK-8 kit使用说明书。 1.7 肝癌细胞MUC1表达水平及IL-2的测定
将生长状态良好的QGY-7701和L02细胞消化下来,离心收集,用PBS清洗2遍,加入抗体,室温孵育30 min后,用PBS洗2次,重悬浮,上样,经流式细胞仪检测肝癌细胞MUC1表达水平。将5 000个Jurkat-CAR和 5 000个QGY-7701或L02细胞在24孔板中共培养,48 h后离心2 min,收取200 μL上清,使用人IL-2 ELISA kit 检测 IL-2含量,具体步骤参见人IL-2 ELISA kit使用说明书。 1.8 杀伤实验
接种100 μL 1×104/孔的靶细胞(QGY-7701或L02)到96孔细胞培养板中,按不同效靶比(E/T值0.5∶1、1∶1、2∶1、4∶1、8∶1、16∶1)加入Jurkat-CAR细胞,补培养液至200 μL,37 ℃、5%CO2共培养24 h。共培养24 h后,从细胞培养箱里取出细胞培养板,在只接种QGY-7701或L02细胞的培养孔中加入试剂盒提供的乳酸脱氢酶(LDH)释放试剂,加入量为原有培养液体积的10%(20 μL)。加入LDH释放试剂后,反复吹打数次混匀,然后继续在细胞培养箱中孵育。1 h后,将细胞培养板用多孔板离心机400×g离心5 min。分别取各孔的上清液120 μL,加入到一新的96孔板相应孔中,随即进行样品测定。各孔分别加入60 μL LDH检测工作液。混匀,室温(约25℃)避光孵育30 min(可用铝箔包裹后置于水平摇床或侧摆摇床上缓慢摇动)。然后在490 nm处测定光密度值。详细步骤参见乳酸脱氢酶细胞毒性检测试剂盒使用说明书。 1.9 统计学处理
采用SPSS 13.0统计软件进行数据分析,检验水准(α)为0.05。 2 结 果 2.1 质粒的构建与鉴定
构建了第1代CAR(pLV180-MUC1-CAR-F2A-hrGFP)和第3代CAR(pLV180-G3MUC1-CAR-F2A-hrGFP)慢病毒载体,CAR结构简图见图 1。pLV180-G3MUC1-CAR-F2A-hrGFP、pLV180-MUC1-CAR-F2A-hrGFP、pLV180-hrGFP质粒经3组酶切后经电泳鉴定正确(图 2)。
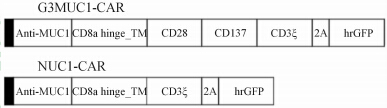 | 图 1 CAR结构简图 Fig 1 Schematic structure of CAR |
 | 图 2 质粒电泳鉴定图 Fig 2 Electrophoresis identification of digested plasmid A:pLV180-G3MUC1-CAR-F2A-hrGFP.1:NheⅠ+SaⅡ(2 500 bp+6 300 bp),2:ClaⅠ+NheⅠ(560 bp+8 300 bp),3:EcoRⅠ+XbaⅠ(1 600 bp+7 200 bp). B:pLV180-MUC1-CAR-F2A-hrGFP. 4:ClaⅠ+NheⅠ(560 bp+8 100 bp),5: NheⅠ+XhoⅠ(2 200 bp+6 300 bp),6:EcoRⅠ+XhoⅠ(1 400 bp+7 200 bp); C:pLV180-hrGFP. 7:ClaⅠ+EcoRⅠ(560 bp+6 600 bp),8:EcoRⅠ +BamHⅠ(720 bp+6 400 bp),9:NcoⅠ(1 800 bp+5 300 bp). M: Marker |
应用三质粒磷酸钙法感染HEK-293T细胞,获取携带嵌合抗原受体基因的重组慢病毒。感染24 h后,在荧光显微镜下表达绿色荧光的HEK-293T细胞达到80%以上,表明含绿色荧光基因的慢病毒载体质粒在HEK-293T细胞能高效地包装携带嵌合抗原受体基因的慢病毒。将得到的含慢病毒载体的上清经离心纯化后,感染Jurkat T 细胞,传代培养3代后,在荧光显微镜下观察表达绿色荧光的Jurkat T细胞达到95%以上(图 3),由此可以确定包装的慢病毒滴度很高,可以有效感染Jurkat T 细胞株,构建携带CAR的Jurkat T 细胞株。
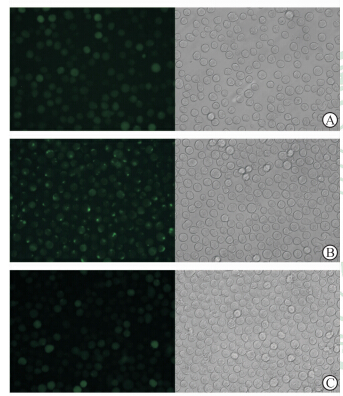 | 图 3 慢病毒感染Jurkat T细胞荧光图 Fig 3 Jurkat T cells infected by lentivirus under fluorescence microscope A: Jurkat T cells infected by lenti-G3MUC1-CAR-F2A-hrGFP; B: Jurkat T cells infected by lenti-MUC1-CAR-F2A-hrGFP; C: Jurkat T cells infected by lenti-hrGFP. Original magnification: ×400 |
Western 印迹检测结果(图 4)表明:Jurkat T细胞高表达CAR蛋白。 2.4 增殖实验结果
Jurkat-CAR 细胞在受到5 μg/mL浓度包被MUC1蛋白抗原刺激48 h后比Jurkat-CAR细胞单独培养增殖速度快(图 5),其中Jurkat-G3MUC1-CAR细胞快67%,Jurkat-MUC1-CAR细胞速度快23%。对照组为Jurkat-hrGFP细胞,其是否接受MUC1蛋白抗原刺激增殖速度没有明显差别。
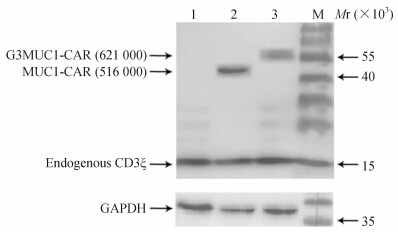 | 图 4 Jurkat-CAR T细胞裂解物的免疫印迹图 Fig 4 M: Marker; 1: Control; 2: MUC1-CAR; 3: G3MUC1-CAR |
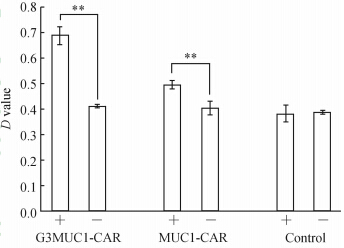 | 图 5 Jurkat-CAR细胞株在5 μg/mL浓度包被MUC1蛋白抗原刺激48 h后细胞增殖柱状图 Fig 5 Proliferation of Jurkat-CAR T cells 48 h after stimulation of 5 μg/mL recombinant protein MUC1 +: Jurkat T cells co-cultured with MUC1-Fc,-: Jurkat T cells alone; **P<0.01,n=3, ±s |
流式检测表明:肝癌细胞株QGY-7701高量表达MUC1,而正常肝细胞L02 MUC1表达量低。ELISA检测Jurkat T细胞与QGY-7701共培养上清中的IL-2量。结果(图 6)表明:第3代和第1代 MUC1-CAR Jurkat T细胞与7701共培养分泌IL-2的量明显高于MUC1-CAR T细胞单独培养,第3代MUC1-CAR T细胞分泌IL-2的量明显高于第1代MUC1-CAR Jurkat T细胞;第3代和第1代 MUC1-CAR T细胞与L02共培养分泌,只有第3代MUC1-CAR T细胞分泌IL-2的量区别于第3代MUC1-CAR T细胞单独培养,其余都无明显区别,Jurkat分泌IL-2的量都停留在本体水平。
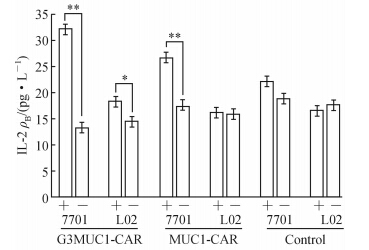 | 图 6 IL-2在不同Jurkat-CAR细胞株中的表达量 Fig 6 ELISA results for IL-2 secretion of different Jurkat-CAR cells +: Jurkat T cells co-cultured with QGY-7701/L02,-: Jurkat T cells alone; **P<0.01,*P<0.05,n=3, ±s |
结果(图 7)表明:随着E/T值的升高,Jurkat T 细胞杀伤QGY-7701细胞能力逐渐增强。其中,在E/T=16时,Jurkat-G3MUC1-CAR杀伤QGY-7701细胞达到88%,Jurkat-MUC1-CAR杀伤QGY-7701细胞达到65%,对照组杀伤QGY-7701细胞达到51%,可见经嵌合抗原受体修饰的Jurkat T细胞能有效杀伤MUC1高表达的QGY-7701肝癌细胞。Jurkat T细胞对L02细胞的杀伤作用无显著差异,表明MUC1-CAR 的修饰未增强Jurkat 细胞对L02的本底杀伤活性。
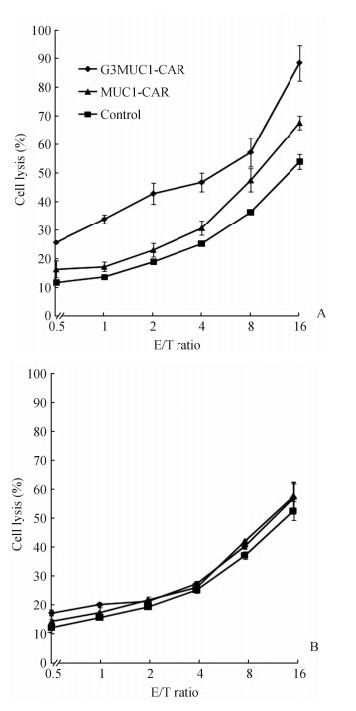 | 图 7 Jurkat-CAR细胞株在不同效靶比时的杀伤效果折线图 Fig 7 QGY-7701 and L02 lysis at indicated effector/target ratios of Jurkat-CAR cells A: QGY-7701; B: L02. n=3, ±s |
原发性肝癌是我国最常见恶性肿瘤之一,预后差、死亡率高。大多数患者发现时已处于中晚期,丧失手术机会,且其对化疗敏感性差,因而亟需研发其他治疗手段应用于肝癌,尤其是中晚期肝癌的临床治疗。MUC1是一种大分子跨膜糖蛋白,广泛高表达于乳腺癌、卵巢癌、肺癌、前列腺癌、结肠癌、肝癌和胰腺癌等恶性肿瘤,其胞外区主要由20个氨基酸(PDTRPAPGSTAPPAHGVTSA)的核心重复序列组成,是MUC1蛋白糖基化修饰位点,且相对于正常细胞,肿瘤细胞表面MUC1具有不同的糖基化结构[8]。过表达和糖基化异常都使MUC1成为各种免疫治疗的理想靶点。其中,根据MUC1核心重复序列设计的脂质体癌症疫苗(L-BLP25)能高效激活患者免疫反应,已进入Ⅲ期临床试验[9];抗MUC1的抗体Yttrium-90-labeled muHMFG联合化疗治疗卵巢癌,已经进入Ⅲ期临床试验[10]。
本研究应用肿瘤过继细胞治疗策略,将MUC1作为靶点用于肝癌治疗。本研究克隆了抗原决定簇位于MUC1蛋白异常糖基化位点的MUC1单链抗体(HMFG2)基因,分别构建了针对MUC1分子的第1代与第3代MUC1 嵌合抗原受体(MUC1-CAR/G3MUC1-CAR),并将其装载到慢病毒载体,利用包装获得的重组慢病毒感染Jurkat T 细胞,分别构建了表达第1代和第3代MUC1特异性CAR的Jurkat T细胞株,验证了该CAR-T细胞对肝癌细胞的杀伤功能与杀伤特异性。结果表明,相对于对照,两种经MUC1嵌合抗原受体修饰的Jurkat T细胞均能特异识别MUC1分子,杀伤MUC1高表达的肝癌细胞QGY-7701,而对MUC1低表达的正常肝细胞基本不杀伤。此外,第3代CAR(G3MUC1-CAR)修饰的Jurkat T细胞接触MUC1分子后,其增殖速度、IL-2分泌量和杀伤效率均优于第1代MUC1修饰细胞(MUC1-CAR)。本研究结果为应用MUC1-CAR修饰的患者原代T细胞用于肝癌过继性免疫细胞治疗的研究提供了实验依据。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Mellman I,Coukos G,Dranoff G.Cancer immunotherapy comes of age[J].Nature,2011,480:480-489. |
| [2] | Rosenberg S A.Cell transfer immunotherapy for metastatic solid cancer-what clinicians need to know[J].Nat Rev Clin Oncol,2011,8:577-585. |
| [3] | Ramos C A,Dotti G.Chimeric antigen receptor (CAR)-engineered lymphocytes for cancer therapy[J].Expert Opin Biol Ther,2011,11:855-873. |
| [4] | Sadelain M,Brentjens R,Riviere I.The basic principles of chimeric antigen receptor design[J].Cancer Discov,2013,3: 388-398. |
| [5] | Ertl H C,Zaia J,Rosenberg S A,June C H,Dotti G,Kahn J,et al.Considerations for the clinical application of chimeric antigen receptor T cells: observations from a recombinant DNA Advisory Committee Symposium held June 15,2010[J].Cancer Res,2011,71:3175-3181. |
| [6] | Wilkie S,Picco G,Foster J,Davies D M,Julien S,Cooper L,et al.Retargeting of human T cells to tumor-associated MUC1: the evolution of a chimeric antigen receptor[J].J Immunol,2008,180:4901-4909. |
| [7] | Kloss C C,Condomines M,Cartellieri M,Bachmann M,Sadelain M.Combinatorial antigen recognition with balanced signaling promotes selective tumor eradication by engineered T cells[J].Nat Biotechnol,2013,31:71-75. |
| [8] | Bakhtiari S H,Rahbarizadeh F,Hasannia S,Ahmadvand D,Iri-Sofla F J,Rasaee M J.Anti-MUC1 nanobody can redirect T-body cytotoxic effector function[J].Hybridoma (Larchmt),2009,28:85-92. |
| [9] | Butts C,Socinski M A,Mitchell P L,Thatcher N,Havel L,Krzakowski M,et al.Tecemotide (L-BLP25) versus placebo after chemoradiotherapy for stage Ⅲ non-small-cell lung cancer (START): a randomised,double-blind,phase 3 trial[J].Lancet Oncol,2014,15:59-68. |
| [10] | Oei A L,Moreno M,Verheijen R H,Sweep F C,Thomas C M,Massuger L F,et al.Induction of IgG antibodies to MUC1 and survival in patients with epithelial ovarian cancer[J].Int J Cancer,2008,123:1848-1853. |
 2014, Vol. 35
2014, Vol. 35


