2. 同济大学附属上海市肺科医院中心实验室, 上海 200433
2. Central Lab, Shanghai Pulmonary Hospital, Tongji University, Shanghai 200433, China
支气管肺癌是我国最常见的恶性肿瘤之一,其中80%为非小细胞肺癌(non-small cell lung cancer,NSCLC)。因临床表现无特异性,大多数患者在诊断时已处于疾病晚期,从而失去了根治的机会。针对表皮生长因子受体(epidermal growth factor receptor,EGFR)的靶向药物延长了晚期NSCLC患者的生存期,EGFR酪氨酸激酶抑制剂(EGFR tyrosine kinase inhibitors,EGFR-TKIs)治疗有效患者的生存期可达到30个月以上[1],但不可避免的耐药性的发生限制了患者的更多获益。
目前EGFR-TKIs的耐药机制尚未完全明确,推测为多种因素参与的复杂过程,包括EGFR基因的正常表达[2],治疗后第二突变的激发;EGFR信号转导旁路上的其他激酶受体如胰岛素样生长因子1受体(insulin-like growth factor 1 receptor,IGF-1R)的激活[3]等。胰岛素样生长因子1(IGF-1)通过激活细胞膜外受体IGF-1R参与多种恶性肿瘤的发生和发展,两者的相互作用由IGF结合蛋白(insulin growth factor binding protein,IGFBP)调控[4]。IGF-1R可与EGFR-TKIs形成二聚体,从而启动PI3K/AKT通路,促进癌细胞增殖,形成耐药性[4,5]。目前已在多种实体瘤的耐EGFR-TKIs细胞株中发现了IGFBP表达下调和IGF-1R表达增加[6,7,8],因此增加抗IGF-1R靶体的药物比单用EGFR-TKIs可能对某些肿瘤患者更为有效。
本研究拟通过检测EGFR-TKIs吉非替尼(gefitinib)敏感细胞株(PC9)及耐药人NSCLC细胞株(A549、H1975)中IGF-1和IGFBP表达,明确IGF-1在NSCLC耐EGFR-TKIs中的可能作用,通过细胞增殖实验观察IGF-1R拮抗剂BMS536924和吉非替尼的联合效应;并通过检测EGFR-TKIs治疗患者的血清IGF-1水平,明确IGF-1与患者临床病理学的关系,探索IGF-1R拮抗剂临床应用的指征。
1 材料和方法 1.1 细胞实验 1.1.1 细胞株及试剂
人NSCLC细胞株PC9(EGFR-TKIs敏感细胞株),A549、H1975(EGFR-TKIs耐药细胞株)来自于我院肺癌免疫室,培养于含5% FCS的RPMI 1640培养液中,在5%CO2、37℃细胞培养箱中常规培养传代。吉非替尼(ZD1839)及BMS536924(IGF-1R拮抗剂)购自Selleck公司。 1.1.2 细胞增殖测定
将A549、PC9和H1975细胞以6×103个/孔密度接种到96孔板中,培养24 h待细胞贴壁后,加入不同浓度BMS536924(0、1、10、100、1 000、5 000 nmol/L)和(或)吉非替尼(5 μmol/L),72 h后以四甲基偶氮唑蓝(MTT)法测定药物对肿瘤细胞的增殖抑制作用,每个药物浓度重复8孔,使用ELISA计数仪确定细胞在490 nm处的光密度值(D),以每孔所测得的D值占对照孔的D值的百分数来表示细胞增殖水平。 1.1.3 ELISA法测定细胞中IGF-1表达
ELISA试剂盒购自上海西唐生物科技有限公司,细胞提取参照说明书进行;按说明书进行检测。 1.1.4 蛋白质印迹法检测IGFBP表达
采用RITA裂解液提取培养细胞的蛋白并使用BCA蛋白浓度测定试剂盒测定浓度。30 μg总蛋白经变性后上样到SDS-PAGE胶,半干法转至PVDF膜。加入抗人IGFBP一抗(1∶50)4℃过夜振荡孵育后洗膜,然后加二抗室温振荡孵育2 h后洗膜,使用电化学发光试剂盒检测,摄片,洗片。以β-actin为对照。 1.1.5 免疫细胞化学染色检测IGFBP表达
培养、固定细胞于6孔板,漂洗后,室温下血清封闭20 min,加入抗人IGFBP(1∶200)4℃孵育过夜,漂洗后二抗室温孵育20 min,漂洗,DAB显色,苏木精复染,自来水冲洗后显微镜下观察。免疫细胞化学结果综合阳性率和阳性细胞的染色强度评分共同决定。阳性率评分:0分,阳性细胞数<5%;1分,阳性细胞数占5%~25%;2分,阳性细胞占25%~75%;3分,阳性细胞占75%~100%;阳性细胞染色强度评分:0分,无染色;1分,弱染色(淡黄色);2分,中等强度染色(黄色);3分,强染色(棕黄色)。阳性细胞数<5%者无论染色强度评分如何,均判为阴性;阳性细胞数≥5%者判为阳性,其中2种评分之和为2~4分者判为弱阳性(+);2种评分之和为5~6分者判为强阳性(++)。 1.2 临床研究 1.2.1 资料采集
2010年10月至2012年10月在我院接受EGFR-TKIs(吉非替尼或厄洛替尼)靶向治疗的NSCLC患者共84例。患者中男性38例,女性46例;中位年龄58(39~80)岁;参照国际肺癌研究协会(IASLC)2009年第7版TNM分期,ⅢB、Ⅳ期患者分别为14、70例,病理类型腺癌、鳞癌、其他(腺鳞混合癌、大细胞癌)分别为71、7、6例,不吸烟、轻度吸烟(吸烟指数<20包年)、重度吸烟(吸烟指数≥20包年)患者分别为53、2、29例。所有患者在病程中均接受过一线和(或)二线化疗。收集所有患者的病例资料并进行电话随访,末次随访时间为2013年12月,失访6例,生存期的计算从确诊时开始到患者死亡或末次随访时间为止。
1.2.2 血清IGF-1水平测定
所有患者在接受靶向治疗前取空腹外周静脉血3 mL,室温静置0.5 h,离心10 min后吸取血清分装,于-20℃冰箱保存待测。采用ELISA法测定血清中IGF-1表达,方法同前。 1.3 统计学处理
采用SPSS 13.0软件进行统计学分析。多组间均数的比较采用方差分析(ANOVA),率的比较采用χ2检验;采用Kaplan-Meier生存曲线法进行生存分析,应用log-rank检验比较生存率的差异。检验水准(α)为0.05。 2 结 果 2.1 细胞实验结果
2.1.1 吉非替尼耐药细胞株中IGF-1和IGFBP的表达
如图 1和2所示,同吉非替尼敏感细胞株PC9相比,吉非替尼耐药细胞株H1975和A549中IGF-1表达分别增加47%和107%(P=0.04,P=0.001),细胞蛋白中IGFBP表达则降低。免疫细胞化学显示PC9细胞株的胞质或细胞膜出现棕黄色强染色,阳性细胞数>75%,评分6分,为强阳性(++);而A549和H1975表现为淡黄色至黄色染色,染色范围<50%,评分2~4分,为弱阳性(+),见图 3。
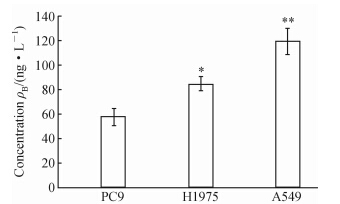 | 图 1 人肺癌细胞株中IGF-1表达 Fig 1 Insulin-like growth factor-1 (IGF-1) expression in human lung cancer cell lines *P<0.05,**P<0.01 vs PC9 cell lines,n=4,x±s |
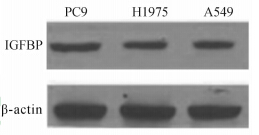 | 图 2 人肺癌细胞株中IGFBP表达(蛋白质印迹分析) Fig 2 Insulin growth factor binding protein (IGFBP) expression levels in human lung cancer cell lines (Western blotting analysis) |
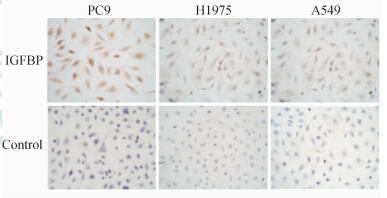 | 图 3 人肺癌细胞株中IGFBP表达的免疫细胞化学检测 Fig 3 Immunocytochemistry detection of insulin growth factor binding protein (IGFBP) in human lung cancer cell lines IGFBP staining showed cytoplasmic light yellow to brown staining. Original magnification: ×200 |
如图 4所示,0.05 μmol/L吉非替尼可明显抑制肿瘤PC9细胞生长,加入BMS536924后对细胞增殖无明显影响;而A549和H1975细胞株显示了对吉非替尼的耐药性,5 μmol/L的吉非替尼分别抑制了4%和14.5%的细胞生长,加入BMS536924后,细胞生长明显受抑,且随着BMS536924浓度的增加而加强。
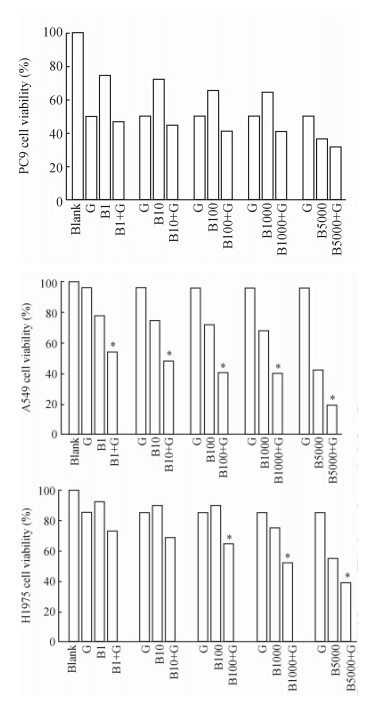 | 图 4 吉非替尼和IGF-1受体拮抗剂BMS536924对各组细胞株增殖的影响 Fig 4 Effect of gefitinib and BMS536924 (antagonist of IGF-1 receptor) on cell growth in each group IGF-1: Insulin-like growth factor 1; B: BMS536924; G: Gefitinib (5 μmol/L); B1,B10,B100,B1000,and B5000 corresponds the concentrations of 1,10,100,1 000,and 5 000 nmol/L. *P<0.05 vs blank or gefitinib alone or the corresponding BMS536924 groups of different concentrations. n=4,x±s |
至随访结束,共有65例患者死亡,生存13例,失访6例。IGF-1表达与患者的性别、病理类型、疾病分期、吸烟状况均无关(表 1)。在接受EGFR-TKIs(吉非替尼或厄洛替尼)治疗的84例患者中,2例患者仍在使用EGFR-TKIs,疾病进展者24例,疾病控制者60例,其中控制时间<6个月11例(7例疾病稳定,4例部分缓解),≥6个月49例(均为部分缓解)。同疾 病控制者[(67.16±18.05) ng/mL]相比,疾病进展者血清IGF-1表达[(98.68±26.17)ng/mL]增高,但未达到统计学意义(P=0.052);除2例仍在使用EGFR-TKIs的患者外,其余患者均出现耐药性,将EGFR-TKIs疾病控制大于6个月定义为获得性耐药[9],其余归为原发性耐药,后者的IGF-1水平[(76.69±20.68)ng/mL,n=35]明显高于前者[(65.52±15.85)ng/mL,n=49],差异有统计学意义(P=0.02)。所有患者从确诊开始计算的中位生存期为14.1(2.2~59)个月。参照Masago等[10]的方法,以ROC曲线确定IGF的临界值为92.4 ng/mL(敏感度60%,特异度89%),≥该值为阳性,<该值为阴性,则疾病控制者和疾病进展者中分别有88%(53/60)和50%(12/24)为阴性表达者,表达阴性者的生存期明显高于阳性患者(P=0.002),见图 5。
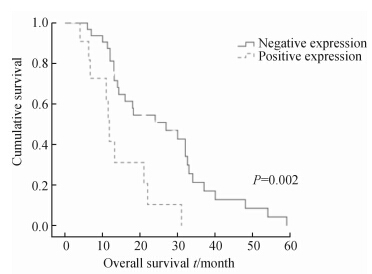 | 图 5 IGF-1表达阴性和阳性NSCLC患者的生存曲线 Fig 5 Survival curves of non-small cell lung cancer (NSCLC) patients with negative or positive expression of insulin-like growth factor 1 (IGF-1) |
|
|
表 1 NSCLC患者的临床病理特征和IGF-1 表达 Tab 1 Clinicopathological characteristics and insulin-like growth factor 1 (IGF-1) expression in non-small cell lung cancer (NSCLC) patients |
EGFR-TKIs的耐药机制包括原发性耐药和获得性耐药。既往研究表明EGFR酪氨酸激酶结构域的突变是EGFR-TKIs治疗敏感的重要原因。EGFR 19外显子的缺失突变和21 外显子的L858替换突变是最常见的基因突变[11],不存在这些突变的患者的EGFR-TKIs治疗有效率和疾病进展时间明显低于化疗[12];EGFR酪氨酸激酶区的T790M突变是获得性耐药的常见原因之一,存在于约50%的耐药患者中[3];此外,基因不稳定性的肿瘤细胞在药物诱导的选择性压力下,也可能会启动其他生存机制,从而产生耐药[3]。
Cortot等[13]的研究表明,对EGFR-TKIs敏感的人肺癌细胞株PC9在经过药物诱导处理形成耐药株后,可发现T790M突变以及激活的IGF-1R信号,使用IGF-1R拮抗剂可以恢复细胞对EGFR-TKIs的敏感性。IGF-1R同样参与表达野生型EGFR的肺癌细胞对厄洛替尼的获得性耐药[14];我们的研究发现同敏感细胞株PC9相比,耐EGFR-TKIs的A549和H1975细胞中IGF-1表达增加,IGFBP表达下降;当联合IGF-1R拮抗剂BMS536924时,A549和H1975细胞株对吉非替尼处理的敏感性增加,且随着BMS536924浓度的增加而加强。提示IGF-1/IGF-1R参与了这些细胞对吉非替尼的耐药性。IGF-1R的结构和EGFR有同源性,两者享有相同的信号通路,这一点可以在理论上解释IGF-1R在EGFR-TKIs耐药中的重要作用[15]。
对84例患者的临床资料分析显示,根据ROC曲线设定IGF-1的临界值,EGFR-TKIs治疗后疾病进展者中有更高的IGF-1阳性表达率;从定量数值看,疾病控制患者的IGF-1表达低于疾病进展患者。而根据目前对EGFR-TKIs获得性耐药的临床定义,我们将治疗后疾病控制达6个月以上者记为获得性耐药组,剩余为原发性耐药,可发现前者的IGF-1表达明显低于后者。以上结果提示IGF-1至少参与了部分NSCLC患者对EGFR-TKIs的耐药,特别是原发性耐药患者,在既往研究中未见相关报道。Peled等[16]采用免疫组化法分析了98例接受吉非替尼治疗的NSCLC患者的肿瘤组织标本中IGF-1R的表达并进行定量分析,结果发现在野生型或无19外显子缺失及21外显子突变的患者中,IGF-1R表达与患者的无病生存期无关;在有19外显子缺失或21外显子突变的患者中,IGF-1R低表达患者的无病生存期有延长趋势(P=0.085 6),因此认为IGF-1R表达在对EGFR-TKIs的原发性耐药中意义不大。两个研究结果的差异可能由多种因素造成:(1)检测方法不同。我们的研究检测了患者血清的IGF-1表达,Peled等检测了IGF-1R的表达,有研究发现治疗前血清IGF-1的表达可以作为抗IGF-1R治疗的分子标记物[17]。(2)根据ROC曲线设定的临界值不同。我们研究中临界值的敏感度为60%,特异度为89%,而Peled等研究中敏感度及特异度均为70%,因此后者可能有更高的阳性率。(3)对原发性和继发性耐药的定义不同。我们的研究结合了临床疗效评价,而Peled等的研究中仅以分子生物学标记为指标。由于两个研究样本量均偏少,而且无检测指标动态观察结果,因此最终结论尚需大样本的临床资料和更完善的试验设计来验证。
我们未发现IGF-1表达与患者的临床病理特征的相关性,但患者血清中IGF-1阴性表达者的生存期高于阳性表达者,这同Gately等[18]及Kim等[19]的研究结果相似,上述研究者采用免疫组化的方法发现IGF-1高表达与NSCLC患者的预后不良有关。
如上所述,IGF-1在EGFR-TKIs耐药的NSCLC中扮演了重要角色,联合IGF-1R激酶抑制剂或单克隆抗体有可能逆转部分患者对EGFR-TKIs的耐药性。Gong等[20]检测了多种NSCLC细胞株,发现有IGF-1R高表达的细胞株对其单克隆抗体R1507治疗敏感。但IGF-1/IGF-1R表达增高的诱导机制尚未完全明确,其在临床应用中正常值的界定以及IGF-1在疾病不同时期是否会有动态变化也需大样本的临床研究进一步确定。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Zhou C,Wu Y L,Chen G,Feng J,Liu X Q,Wang C,et al.Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL,CTONG-0802):a multicentre,open-label,randomised,phase 3 study[J].Lancet Oncol,2011,12:735-742. |
| [2] | Tamura K,Okamoto I,Kashii T,Negoro S,Hirashima T,Kudoh S,et al.Multicentre prospective phase Ⅱ trial of gefitinib for advanced non-small cell lung cancer with epidermal growth factor receptor mutations:results of the West Japan Thoracic Oncology Group trial (WJTOG0403)[J].Br J Cancer,2008,98:907-914. |
| [3] | Nguyen K S,Kobayashi S,Costa D B.Acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors in non-small-cell lung cancers dependent on the epidermal growth factor receptor pathway[J].Clin Lung Cancer,2009,10:281-289. |
| [4] | Casa A J,Dearth R K,Litzenburger B C,Lee A V,Cui X.The type Ⅰ insulin-like growth factor receptor pathway:a key player in cancer therapeutic resistance[J].Front Biosci,2008,13:3273-3287. |
| [5] | Adams T E,Epa V C,Garrett T P,Ward C W.Structure and function of the type 1 insulin-like growth factor receptor[J].Cell Mol Life Sci,2000,57:1050-1093. |
| [6] | Camirand A,Zakikhani M,Young F,Pollak M.Inhibition of insulin-like growth factor-1 receptor signaling enhances growth-inhibitory and proapoptotic effects of gefitinib (Iressa) in human breast cancer cells[J].Breast Cancer Res,2005,7:R570-R579. |
| [7] | Guix M,Faber A C,Wang S E,Olivares M G,Song Y,Qu S,et al.Acquired resistance to EGFR tyrosine kinase inhibitors in cancer cells is mediated by loss of IGF-binding proteins[J].J Clin Invest,2008,118:2609-2619. |
| [8] | Jones H E,Goddard L,Gee J M,Hiscox S,Rubini M,Barrow D,et al.Insulin-like growth factor-Ⅰ receptor signaling and acquired resistance to gefitinib (ZD1839; Iressa) in human breast and prostate cancer cells[J].Endocrine Related Cancer,2004,11:793-814. |
| [9] | Jackman D,Pao W,Riely G J,Engelman J A,Kris M G,Jänne P A,et al.Clinical definition of acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors in non-small-cell lung cancer[J].J Clin Oncol,2010,28:357-360. |
| [10] | Masago K,Fujita S,Togashi Y,Kim Y H,Hatachi Y,Fukuhara A,et al.Clinical significance of epidermal growth factor receptor mutations and insulin-like growth factor 1 and its binding protein 3 in advanced non-squamous non-small cell lung cancer[J].Oncol Rep,2011,26:795-803. |
| [11] | Tamura K,Okamoto I,Kashii T,Negoro S,Hirashima T,Kudoh S ,et al.Multicentre prospective phase Ⅱ trial of gefitinib for advanced non-small cell lung cancer with epidermal growth factor receptor mutations:results of the West Japan Thoracic Oncology Group trial (WJTOG0403) [J].Br J Cancer,2008,98:907-914. |
| [12] | Garassino M C,Martelli O,Broggini M,Farina G,Veronese S,Rulli E,et al.Erlotinib versus docetaxel as second-line treatment of patients with advanced non-small-cell lung cancer and wild-type EGFR tumours (TAILOR):a randomised controlled trial[J].Lancet Oncol,2013,14:981-988. |
| [13] | Cortot A B,Repellin C E,Shimamura T,Capelletti M,Zejnullahu K,Ercan D,et al.Resistance to irreversible EGF receptor tyrosine kinase inhibitors through a multistep mechanism involving the IGF1R pathway[J].Cancer Res,2013,73:834-843. |
| [14] | Suda K,Mizuuchi H,Sato K,Takemoto T,Iwasaki T,Mitsudomi T.The insulin-like growth factor 1 receptor causes acquired resistance to erlotinib in lung cancer cells with the wild-type epidermal growth factor receptor[J].Int J Cancer,2014,135:1002-1006. |
| [15] | Singh I,Amin H,Rah B,Goswami A.Targeting EGFR and IGF 1R:a promising combination therapy for metastatic cancer[J].Front Biosci (Schol Ed),2013,5:231-246. |
| [16] | Peled N,Wynes M W,Ikeda N,Ohira T,Yoshida K,Qian J,et al.Insulin-like growth factor-1 receptor (IGF-1R) as a biomarker for resistance to the tyrosine kinase inhibitor gefitinib in non-small cell lung cancer[J].Cell Oncol,2013,36:277-288. |
| [17] | Gualberto A,Hixon M L,Karp D D,Li D,Green S,Dolled-Filhart M,et al.Pre-treatment levels of circulating free IGF-1 identify NSCLC patients who derive clinical benefit from figitumumab[J].Br J Cancer,2011,104:68-74. |
| [18] | Gately K,Forde L,Cuffe S,Cummins R,Kay E W,Feuerhake F,et al.High coexpression of both EGFR and IGF1R correlates with poor patient prognosis in resected non-small-cell lung cancer[J].Clin Lung Cancer,2014,15:58-66. |
| [19] | Kim J S,Kim E S,Liu D,Lee J J,Solis L,Behrens C,et al.Prognostic impact of insulin receptor expression on survival of patients with nonsmall cell lung cancer[J].Cancer,2012,118:2454-2465. |
| [20] | Gong Y,Yao E,Shen R,Goel A,Arcila M,Teruya-Feldstein J,et al.High expression levels of total IGF-1R and sensitivity of NSCLC cells in vitro to an anti-IGF-1R antibody (R1507) [J].PLOS One,2009,4:e7273. |
 2014, Vol. 35
2014, Vol. 35


