2. 重庆医科大学发育生物学与模式动物平台, 重庆 400016
2. Platform of Development Biology and Model Animal, Chongqing Medical University, Chongqing 400016, China
内质网是蛋白质折叠以及修饰、钙离子储存的场所,蛋白激酶R样内质网激酶(protein kinase R-like ER kinase,PERK)是一种位于内质网膜上的Ⅰ型跨膜蛋白,属于eIF2α上游激酶家族,具有丝/苏氨酸蛋白激酶的活性[1]。当内质网中聚集大量错误折叠蛋白质时,会激活内质网应激(ER stress),这时,PERK作为内质网应激一个重要的信号分子,会进一步被激活,通过磷酸化真核细胞起始因子2α(eukaryotic initiation factor 2α,eIF2α)抑制蛋白质合成,同时通过活化转录活化因子4(ATF4)上调C/EBP同源蛋白( C/EBP homologous protein,Chop)基因的表达,进而活化细胞凋亡途径的发生,参与细胞的整合应激反应过程,参与各种代谢异常、组织损伤等病理过程的发生、发展和转变[2]。
近年来,骨骼肌的损伤和修复日益引起研究人员的关注,本实验成功构建和包装了人PERK基因重组慢病毒颗粒,并观察其对小鼠成肌细胞C2C12 在内质网应激状态时增殖及凋亡的影响,为进一步研究人PERK基因在骨骼肌细胞中的生物学功能奠定基础,也为研究骨骼肌损伤及修复的分子机制提供一定的理论依据。 1 材料和方法 1.1 材料
慢病毒表达载体pWPT-GFP、慢病毒包装原件载体pMD2G和pSPAX2由第二军医大学何志颖教授惠赠,HEK-293T细胞、C2C12细胞株由本实验室保存。Lipofectamine 2000(Invitrogen 公司);TRIzol 试剂、SYBR Real-time PCR Master Mix(TaKaRa公司),ExoⅢ外切核酸酶Ⅲ为TaKaRa公司产品;BamHⅠ、MluⅠ内切酶、胶纯化、DNA回收试剂盒及合成引物为大连宝生物(TaKaRa)公司产品;质粒小量提取试剂盒购自Omega公司;DMEM、胎牛血清购自Hyclone公司;细胞培养皿购自NEST公司;ECL发光试剂盒购自北京鼎国昌盛生物技术有限公司;PVDF膜和NC膜购自美国Milipore公司;β-actin抗体、PERK抗体、HRP标记山羊抗兔/山羊抗鼠抗体均购自Santa Cruz公司;RIPA蛋白裂解液购自北京鼎国昌盛生物技术有限公司。
1.2 PERK慢病毒载体的构建 1.2.1 引物设计与合成
根据GenBank中人PERK中CDS区的基因序列,设计并合成PERK的扩增引物,Sense Primer: tcg tgacgc GGATCCATGGAGCGCGCCATCAGC;Antisense Primer: agcgctagg acgcgt ATTGCTTGGCAAAGGGCTATGG(下划线分别为BamHⅠ、MluⅠ酶切位点),以真核表达载体pcDNA3.1(-)-PERK为模板扩增PERK基因,扩增PERK基因大小为3 348 bp。 1.2.2 目的基因的PCR扩增以及含PERK基因的重组慢病毒的构建
采用100 μL PCR体系从真核表达载体pcDNA3.1(-)-PERK中扩增PERK基因:2×Taq Master Mix 50 μL、上游、下游引物各2.5 μL、模板5 μL、灭菌双蒸水40 μL。反应条件: 94℃预变性5 min; 94℃变性30 s,64℃退火30 s,72℃延伸3 min 45 s,共35个循环;最后72℃再延伸5 min。4℃保存。1%琼脂糖凝胶电泳观察PCR结果。用限制性内切酶BamHⅠ、MluⅠ双酶切慢病毒载体pWPT-GFP,将上述纯化的PCR产物和双酶切慢病毒载体pWPT-GFP通过LIC(ligation-independent cloning)连接,构建载体pWPT-GFP-PERK。连接产物转化DH5α感受态菌,37℃摇床过夜,质粒小量提取试剂盒提取质粒DNA并酶切和PCR鉴定,测序鉴定。 1.3 慢病毒重组体的包装和靶细胞感染
转染前1 d在2个6 cm的培养皿中接种对数生长期的293T细胞,次日将慢病毒载体pWPT-GFP和重组慢病毒载体pWPT-GFP-PERK分别与辅助包装质粒pSPAX2、pMD2G混合,按照LipofectamineTM 2000脂质体说明书分别将3种质粒充分混合分别转染入293T细胞中,3种质粒各自加入12.5 μg、7 μg和3.5 μg[3,4]。5 h后换新鲜的细胞培养液,48 h、72 h分别收集培养上清,0.45 μm滤器过滤后-80℃保存。 1.4 病毒滴度的检测
感染前1 d在24孔板中接种293T细胞,按照孔稀释法倍比稀释浓缩的病毒上清,取200 μL加入细胞中,每个稀释倍数设置2个复孔。孵箱过夜,第2天更换DMEM完全培养液,48 h后荧光显微镜下观察绿色荧光数。1个发绿色荧光的细胞为 1个表达单位 ( expression forming units,efu),根据下面公式计算病毒滴度( efu/mL)[5,6]和感染复数(MOI):病毒滴度 =发绿色荧光的细胞数×病毒稀释倍数/0.25,MOI=病毒滴度×加入病毒体积/感染的细胞数。 1.5 RT-PCR检测LV-PERK感染C2C12细胞后mRNA表达
收集6 cm的培养皿中长至90%的C2C12细胞,作为空白对照A组,感染慢病毒空对照LV-GFP的C2C12细胞为B组,感染慢病毒LV-PERK的C2C12细胞为C组。用TRIzol提取其总RNA,再用TaKaRa公司的PrimeScriptTMRT Reagent Kit试剂盒反转录成cDNA,PCR扩增后1%琼脂糖凝胶电泳观察结果。PERK的引物序列:上游:5′-AGC ACT CAG ATG GAG AGA GTC AG-3′,下游:5′-GCT ATG GGA GTT GTT GGA CT GT-3′,产物大小为260 bp;β-actin的引物序列:上游:5′-GAC CCA GAT CAT GTT TGA GAC C-3′,下游:5′-ATC TCC TTC TGC ATC CTG TCG-3′,产物大小为550 bp;RT-PCR反应体系:2×Taq Master Mix 5 μL,上、下游引物各0.4 μL,模板2 μL,灭菌双蒸水2.2 μL; 反应条件: 94℃预变性3 min;94℃变性30 s,50℃退火30 s,72℃延伸30 s,共30个循环;最后72℃再延伸 10 min,4℃保存。1%琼脂糖凝胶电泳观察结果。 1.6 蛋白质印迹检测LV-PERK在C2C12细胞中的表达
取6 cm培养皿的90%C2C12细胞作为空白对照A组,感染慢病毒空对照LV-GFP的C2C12细胞为B组,感染慢病毒LV-PERK的C2C12细胞为C组。各组细胞分别经预冷的PBS冲洗3次后,加入200 μL的蛋白裂解液,用细胞刮缓缓刮下收集至1.5 mL的EP管中,放置冰上充分裂解40 min,12 000×g 4℃离心15 min。取上清至新的EP管中,加入4×SDS上样缓冲液,分装后至-80℃保存。3种蛋白各取20 μL于10%的SDS-PAGE电泳后,电转移至PVDF膜上1 h,5%的脱脂奶粉封闭1 h;分别加入β-actin鼠抗抗体(1∶1 000)和PERK兔抗抗体(1∶1 000),4℃过夜。次日吸取抗体液,分别加入辣根过氧化物酶标记的二抗(羊抗鼠1∶5 000)和二抗(羊抗兔1∶5 000),ECL显影。 1.7 FCM检测PERK重组慢病毒对C2C12细胞周期和凋亡的影响 1.7.1 细胞周期的检测
取对数期生长的C2C12细胞接种于6孔板,待细胞长至80%时分别加入慢病毒pWPT-GFP-PERK和慢病毒pWPT-GFP,并设立空白对照NC组。每个实验设置2个复孔,重复3次。一组实验样品不加衣霉素(tunicamycin,TM),另外一组感染72 h后加入4 μg/mL TM处理24 h,收集各组细胞用1.5 mL的70%乙醇固定24 h,加入等体积的染料PI,4℃放置20~30 min后尼龙膜过滤,FCM测定各组细胞周期情况。该检测由重庆医科大学生命科学院完成。 1.7.2 细胞凋亡的检测
取对数生长期C2C12细胞接种于6孔板,待细胞长至80%时分别加入慢病毒LV-PERK和对照LV-GFP,并设立空白对照NC组。每个实验设置2个复孔,重复3次。一组实验样品不加TM,另外一组感染72 h后加入4 μg/mL TM处理24 h,收集各组细胞PBS洗涤3次,加入等体积PBS,应用FCM Annixin PE法检测细胞凋亡。该检测由重庆医科大学生命科学院完成。 1.8 蛋白质印迹法检测PERK重组慢病毒对C2C12细胞凋亡相关基因蛋白表达的影响
取对数生长期的C2C12细胞接种于6孔板,待细胞长至80%时分别加入慢病毒LV-PERK和对照LV-GFP,并设立空白对照NC组。感染慢病毒72 h后,加入4 μg/mL TM处理24 h,提取各组细胞总蛋白,蛋白质印迹法检测PERK蛋白的表达及凋亡相关基因Cleaved Caspase-3和Chop蛋白的表达。 1.9 统计学处理
采用SPSS 15.0统计软件对组间差异进行方差分析。检验水准(α)为0.05。 2 结 果 2.1 慢病毒表达载体的构建
以pcDNA3.l(-)-PERK为模板扩增目的基因PERK,扩增目的基因大小为3 348 bp,与预期一致(图 1A)。目的基因PERK与慢病毒载体pWPT-GFP分别以BamHⅠ、MluⅠ双酶切后纯化、连接,转化并提质粒后进行酶切鉴定。由于PERK基因中含有BamHⅠ的酶切位点,所以只需使用BamHⅠ单酶切鉴定即可,如图 1B所示,在1 210 bp和11 608 bp处出现2条带,对照质粒只出现1条带。结果表明慢病毒表达载体pWPT-GFP-PERK构建成功。
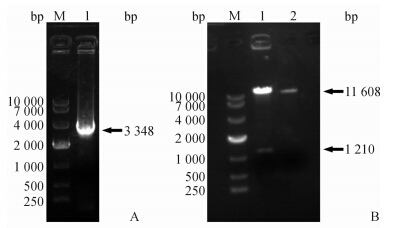 | 图 1 PERK基因PCR以及慢病毒载体pWPT-GFP-PERK酶切结果 Fig 1 PCR products of PERK gene and lentivirus pWPT-GFP-PERK vector digestion A:PCR results of PERK (M:DL10000;1:pcDNA3.l(-)-PERK);B: BamHⅠ digestion results of pWPT-GFP-PERK (M:DL10000;1:pWPT-GFP-PERK;2:pWPT-GFP) |
将慢病毒表达载体pWPT-GFP-PERK和包装载体pMD2G、pSPAX2在293T细胞中共转48 h后荧光显微镜下观察,可见明显绿色荧光,细胞停止生长,说明慢病毒包装成功(图 2A)。包装好的LV-PERK慢病毒经0.45 μm滤器过滤后感染C2C12细胞,72 h后可见明显绿色荧光,GFP表达>90%(图 2B)。
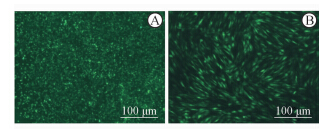 | 图 2 慢病毒的包装以及对C2C12细胞的感染 Fig 2 Lentivirus packaging and infection of C2C12 cells A: Lentivirus packaging in 293T cells;B: Lentivirus LV-PERK infected C2C12 cells |
将慢病毒表达载体pWPT-GFP-PERK和包装载体pMD2G、pSPAX2在293T细胞中包装形成慢病毒,经倍比稀释法测定得到慢病毒LV-PERK的滴度约为4.2×108 efu/mL,可用于后续实验。LV-PERK慢病毒分别按MOI=20(图 3A)、MOI=40(图 3B)、MOI=100(图 3C)的梯度感染C2C12细胞,72 h后,当感染复数MOI为40时GFP表达量达到80%以上,MOI为100时GFP表达量反而降低,说明LV-PERK慢病毒对C2C12细胞的最佳感染复数是40。
 | 图 3 C2C12细胞中病毒滴度的检测 Fig 3 Detection of virus titer in C2C12 cells A: MOI=20; B: MOI=40; C: MOI=100 |
RT-PCR结果(图 4A)显示,感染慢病毒LV-PERK组在260 bp处可见明显的特异性条带,550 bp处出现明亮的β-actin条带;NC组和LV-GFP对照组PERK表达量很少。蛋白质印迹结果(图 4B)显示: C2C12细胞感染慢病毒LV-PERK 72 h后,细胞中PERK的表达明显高于NC组及LV-GFP对照组。
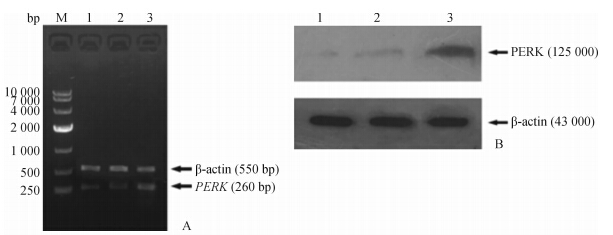 | 图 4 慢病毒LV-PERK在C2C12细胞中的表达 Fig 4 Expression of LV-PERK in C2C12 cells A:The expression of PERK mRNA in C2C12 cell was detected by RT-PCR (M:DL2000;1:NC group;2:LV-GFP group;3:LV-PERK group); B: The expression of PERK protein in C2C12 cell was detected by Western blotting analysis(1:NC group;2:LV-GFP group;3:LV-PERK group) |
从图 5中可以看出,在无TM处理下,各实验组的细胞周期均无明显变化;而在TM诱导内质网应激条件下,LV-PERK组C2C12细胞G1期(54.37 %)比例低于TM组、LV-GFP对照组(分别为77.91%、66.41%,P<0.05),LV-PERK组C2C12细胞S期( 31.36 %)比例高于TM组、LV-GFP对照组(分别为12.14%、16.96%,P<0.05)。结果表明PERK在内质网应激状态下能促进C2C12细胞增殖。
 | 图 5 FCM检测在衣霉素(TM)处理条件下慢病毒LV-PERK对C2C12细胞周期的影响 Fig 5 FCM analysis of cell cycle in C2C12 cells infected by LV-PERK with or without tunicamycin (TM) treatment *P<0.05 vs TM and TM+LV-GFP groups; n=3,x±s |
从图 6可以看出,在无TM处理下,C2C12细胞凋亡率约为3.44%;在TM处理下,感染慢病毒LV-PERK组C2C12细胞的凋亡率明显高于无TM处理组、TM组、TM+LV-GFP组(P<0.05)。结果表明PERK在内质网应激状态下能加速C2C12细胞的凋亡。
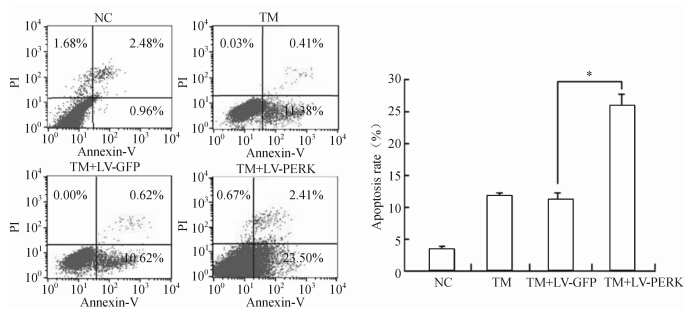 | 图 6 FCM检测各组C2C12细胞凋亡的结果 Fig 6FCM analysis of apoptosis rate in C2C12 cells of each group *P<0.05; n=3,x±s |
采用蛋白质印迹法检测内质网应激状态下PERK蛋白及凋亡相关蛋白Cleaved Caspase-3、Chop的表达。结果(图 7)显示:与正常对照组相比,TM处理C2C12细胞处于内质网应激状态时,细胞内源性PERK表达有轻微增加,而感染LV-PERK慢病毒后,与未感染组相比,C2C12中PERK表达明显增加;LV-PERK感染C2C12细胞后,在内质网应激状态下,Cleaved Caspase-3与Chop蛋白的表达与TM组和TM+LV-GFP对照组相比明显上升。结果说明LV-PERK在内质网应激状态下对C2C12细胞的凋亡有促进作用。
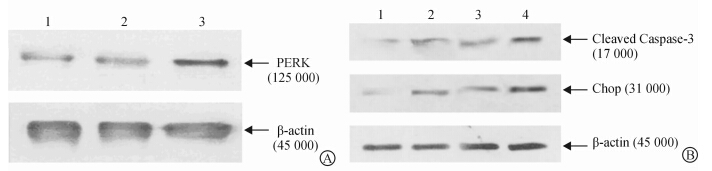 | 图 7 蛋白质印迹检测PERK及内质网应激介导凋亡相关蛋白的表达 Fig 7 Western blotting analysis of expression of PERK and ER stress-mediated apoptosis related proteins A:The expression of PERK in C2C12 cells in ER stress (1:NC group;2:TM group;3:TM+LV-PERK group);B: The expression of ER stress-mediated apoptosis related proteins in C2C12 (1:NC group;2:TM group;3:TM+LV-GFP group;4:TM+LV-PERK group). ER: Endoplasmic reticulum; TM: Tunicamycin |
内质网是细胞内重要的细胞器,是真核细胞蛋白质修饰折叠和加工的主要场所,同时也是细胞储存钙离子的场所,当上述过程受到各种因素影响时就会导致未折叠蛋白或错误折叠蛋白在内质网腔内聚积或打破细胞内钙稳态从而引起内质网应激[3]。PERK是内质网内Ⅰ型跨膜蛋白,具有丝/苏氨酸蛋白激酶活性[6],在内质网应激状态时PERK通路被激活。此时,PERK可以磷酸化真核起始因子2(eIF2α),进而抑制翻译起始复合物中GDP和GTP的交换,导致蛋白质的合成和翻译受到抑制[7]。内质网应激介导凋亡的过程中,一方面PERK促使蛋白质的合成暂时终止;另一方面随着内质网应激时间的持续和加重,PERK活化激活转录因子4(ATF4)从而上调C/EBP同源蛋白(C/EBP homologousprotein,Chop)的表达[8,9],Chop进而抑制Bcl-2的表达,最终导致Caspase-3执行细胞的凋亡。
众所周知,骨骼肌细胞大约占据了机体细胞干质量的一半,大面积烧伤或烫伤后机体为了获取能量,便开始进行蛋白质的高分解代谢[10,11,12],在骨骼肌中这表现为显著的骨骼肌消耗,骨骼肌消耗是肌纤维降解和肌细胞核数目减少综合导致的结果[13,14],其机制主要包括骨骼肌纤维蛋白降解、肌细胞核凋亡、解偶联蛋白增加等[15]。近期研究发现烧伤后骨骼肌细胞凋亡增加,凋亡执行分子Caspase-3 的表达及活性增加,使肌肉蛋白降解速率增加[16,17]。同时另一项研究显示大鼠烫伤后 4 d、14 d,烫伤大鼠的胫骨前肌Caspase-12 活性表达较对照组明显升高,大鼠烫伤后1、4、7、14 d的胫骨前肌中Chop表达均明显增高[18],这些结果表明凋亡是烧伤后骨骼肌消耗的重要机制。研究认为骨骼肌细胞的凋亡不仅是骨骼肌消耗的重要途径,也可能是重要的始动因素[19],而内质网应激介导凋亡是非常重要的细胞凋亡途径之一[20]。大面积烧伤或烫伤主要影响肌肉受损后的葡萄糖摄取、代谢和蛋白质代谢等[7,8]。严重烧伤后机体会出现显著的高分解代谢反应,蛋白质分解速率远大于合成速率,在临床上表现为显著的体质量减轻[9,10]。近年来,内质网应激作为烧伤引起的骨骼肌消耗日益受到研究人员的关注。研究显示在60%TBSAⅢ度烧伤的SD大鼠模型中,在肝脏中检测到了PERK、IREI、ATF6的表达均有不同程度的增高[21]。关于烧伤后骨骼肌细胞中内质网应激的研究则相对较少。
在本实验中,我们运用慢病毒LV-PERK感染成肌细胞C2C12,并且运用TM持续作用于C2C12细胞,建立一个经典的内质网应激模型[22]。通过流式细胞术以及蛋白质印迹检测内质网应激介导凋亡的凋亡通路中特征性分子Chop和Caspase-3,来探讨ER相关基因PERK对C2C12成肌细胞内质网应激诱导的凋亡的影响。FCM结果显示,ER应激持续状态下,TM+LV-PERK实验组C2C12细胞的增殖率高于TM对照组,TM+LV-PERK实验组C2C12细胞处于S期的比例高于TM对照组,G1期的比例低于TM对照组,表明PERK可在ER应激持续状态下促进C2C12从G1期进入S期,从而促进细胞的增殖。FCM凋亡结果显示,TM组细胞凋亡率明显高于NC组,而TM+LV-PERK实验组C2C12细胞凋亡率高于TM对照组,说明内质网应激持续时PERK能促进C2C12细胞的凋亡。蛋白质印迹结果与FCM也是一致的,TM组和TM+LV-GFP组Cleaved Caspase-3和Chop的表达明显上调,而TM+LV-PERK实验组C2C12细胞凋亡率更高于TM对照组。结果表明PERK在ER应激状态下能加速C2C12细胞的凋亡。蛋白质印迹结果与FCM也是一致的,表现为TM+LV-PERK感染后凋亡相关蛋白Cleaved Caspase-3和Chop的表达明显上调。
综上所述,本研究发现在内质网应激的状态下,PERK能够加速骨骼肌C2C12细胞的凋亡,这是由于当处于内质网应激时,PERK活化并且激活了其下游的凋亡通路。烧伤后内质网应激在骨骼肌消耗的分子机制目前才刚开始被渐渐关注,而PERK作为ERS三大相关基因之一,在骨骼肌消耗中的作用尚不明确。本实验在体外实验中发现在内质网应激的状态下PERK能够加速骨骼肌C2C12细胞的凋亡,然而在情况更为复杂的人体中,是否有相关表现尚不明确。今后的相关研究将关注在动物烧伤模型以及临床试验中PERK是否有与体外实验相同的作用,这将为揭开内质网应激在烧伤中的作用奠定基础。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Maedler K,Schulthess F T,Bielman C,Berney T,Bonny C,Prentki M,et al.Glucose and leptin induce apoptosis in human beta-cells and impair glucose-stimulated insulin secretion through activation of c-Jun N-terminal kinases[J].FASEB J,2008,22:1905-1913. |
| [2] | 范 威,潘翠萍,张懿敏,廖仕翀,魏 文,马 彪,等.内质网应激对乳腺癌MCF-7细胞CCL5表达的影响[J].肿瘤防治研究, 2012,39:385-388. |
| [3] | 龙晓兰,周 敏,石必枝,谢海龙,李宗海.Cofilin-1慢病毒载体的构建及其在Huh-7中的过表达[J].中南医学科学杂志, 2012,40:65-69. |
| [4] | 杜永亮,贾晓民,李海泉,赵 杰,王海清.IGF1R-shRNA重组慢病毒的构建及对肺癌A549细胞增殖的影响[J].山西医科大学学报,2013,44:106-110. |
| [5] | 韩腾龙, 王立峰, 张 璟, 刘新平, 药立波.pWPT-GFP慢病毒载体的改构及鉴定[J].现代生物医学进展, 2010, 10:447-449. |
| [6] | 武丽红,王金河,王 茜,贾懂懂,梁建琴.Survivin shRNA重组慢病毒的构建及对A549细胞增殖的影响[J].中国肿瘤杂志,2011,14:903-907. |
| [7] | Tzika A A,Mintzopoulos D,Mindrinos M,Zhang J, Rahme L G,Tompkins R G.Microarray analysis suggests that burn injury results in mitochondrial dysfunction in human skeletal muscle[J].Int J Mol Med,2009,24:387-392. |
| [8] | Price J,Zaidi A K,Bohensky J,Srinivas V,Shapiro I M,Ali H.Akt-1 mediates survival of chondrocytes from endoplasmic reticulum-induced stress[J].J Cell Physiol,2010,222:502-508. |
| [9] | Hotamisligil G S.Endoplasmic reticulum stress and the inflammatory basis of metabolic disease[J].Cell,2010,140:900-917. |
| [10] | Eizirik D L,Cardozo A K,Cnop M.The role for endoplasmic reticulum stress in diabetes mellitus[J].Endocr Rev,2008,29:42-61. |
| [11] | Gauglitz G G,Halder S,Boehning D F,Kulp G A, Herndon D N,Barral J M,et al.Post-burn hepatic insulin resistance is associated with endoplasmic reticulum (ER) stress[J].Shock,2010,33:299-305. |
| [12] | Rayavarapu S,Coley W,Nagaraju K.Endoplasmic reticulum stress in skeletal muscle homeostasis and disease[J].Curr Rheumatol Rep,2012,14:238-243. |
| [13] | Jeschke M G,Boehning D.Endoplasmic reticulum stress and insulin resistance post-trauma:similarities to type 2 diabetes[J].J Cell Mol Med,2012,16:437-444. |
| [14] | Lee H Y,Kaneki M,Andreas J,Tompkins R G,Martyn J A.Novel mitochondria-targeted antioxidant peptide ameliorates burn-induced apoptosis and endoplasmic reticulum stress in the skeletal muscle of mice[J].Shock,2011,36:580-585. |
| [15] | Chai J,Wu Y,Sheng Z.The relationship between skeletal muscle proteolysis and ubiquitin-proteasome proteolytic pathway in burned rats[J].Burns,2002,28:527-533. |
| [16] | Yamamoto K,Sato T,Matsui T,Sato M,Okada T,Yoshida H,et al.Transcriptional induction of mammalian ER quality control proteins is mediated by single or combined action of ATF6alpha and XBP1[J].Dev Cell,2007,13:365-376. |
| [17] | Hollien J,Lin J H,Li H,Stevens N,Walter P,Weissman J S.Regulated Ire1-dependent decay of messenger RNAs in mammalian cells[J].J Cell Biol,2009,186:323-331. |
| [18] | Wu T,Dong Z,Geng J,Sun Y,Liu G,Kang W,et al.Valsartan protects against ER stress-induced myocardial apoptosis via CHOP/Puma signaling pathway in streptozotocin-induced diabetic rats[J].Eur J Pharm Sci,2011,42:496-502. |
| [19] | Mecott G A,Al-Mousawi A M,Gauglitz G G,Herndon D N,Jeschke M G.The role of hyperglycemia in burned patients:evidence-based studies[J].Shock,2010,33:5-13. |
| [20] | Hummasti S,Hotamisligil G S.Endoplasmic reticulum stress and inflammation in obesity and diabetes[J].Circ Res,2010,107:579-591. |
| [21] | Jeschke M G,Kraft R,Song J,Gauglitz G G,Cox R A,Brooks N C,et al.Insulin protects against hepatic damage postburn[J].Mol Med,2011,17(5-6):516-522. |
| [22] | Jeschke M G,Finnerty C C,Herndon D N,Song J,Boehning D,Tompkins R G,et al.Severe injury is associated with insulin resistance,endoplasmic reticulum stress response,and unfolded protein response[J].Ann Surg,2012,255:370-378. |
| [23] | Guo F,Lin E A,Liu P,Lin J,Liu C.XBP1U inhibits the XBP1S-mediated upregulation of the iNOS gene expression in mammalian ER stress response[J].Cell Signal,2010,22:1818-1828. |
 2014, Vol. 35
2014, Vol. 35


