2. 大连市第五人民医院心内科, 大连 116000
*通信作者
2. Department of Cardiology, The Fifth People's Hospital of Dalian, Dalian 116000, Liaoning, China
*Corresponding authors
质粒 pCDH-GFP、质粒p3×FLAG-CMV-7.1、PRKAG2基因、HEK-293T细胞由本实验室保存,转染试剂LipofectaminTM 2000购自美国Invitrogen公司,人心肌细胞钠离子通道(SCN5A)基因由华大基因合成,其他试剂购自Invitrogen、TaKaRa公司、Bioteke Corporation、国药集团、碧云天生物工程有限公司、上海国药等公司。 1.2 质粒载体的构建及转染
通过PCR技术扩增目的基因,后将载体与目的基因通过酶切反应及连接反应构建质粒载体,构建SCN5A过表达载体pCDH-GFP-SCN5A及PRKAG2过表达载体p3×FLAG-CMV-7.1-PRKAG2,应用突变试剂盒在载体p3×FLAG-CMV-7.1-PRKAG2基础上构建R302Q突变体及G100S突变体载体。按每孔2×105个HEK-293T细胞,质粒(μg)∶LipofectaminTM 2000(μL)=1∶2进行转染,置于细胞培养箱37℃、5%CO2条件下培养48 h。在4~6 h的时候可以取出培养板,小心吸去培养基,每孔加1 mL新鲜的含10%血清H-DMEM培养基,37℃、5%CO2继续培养48 h。 1.3 HEK-293T细胞免疫荧光染色
载体p3×FLAG-CMV-7.1-PRKAG2载有GFP绿色荧光标记蛋白基因,载体pCDH-GFP-SCN5A载有FLAG标签蛋白基因,经过细胞免疫荧光染色后,可在荧光显微镜下看到红色荧光。HEK-293T细胞共转染48 h后在荧光显微镜下观察细胞荧光情况。 1.4 HEK-293T细胞real-time PCR验证
共转染48 h后的HEK-293T细胞,提取细胞总RNA进行real-time PCR验证。首先提取总RNA,而后合成cDNA,最后进行Real-time PCR反应。 1.5 HEK-293T细胞Western 印迹验证
共转染48h后的HEK-293T细胞,提取细胞总蛋白进行Western印迹验证。先将各组细胞进行蛋白质抽提及浓度鉴定,之后进行SDS-PAGE电泳、蛋白质转移、蛋白质显像、免疫检测、化学发光检测。 1.6 统计学处理
采用SPSS14.0统计软件对实验数据进行分析,所有计量资料均采用 ±s 表示,检验水准(α)=0.05。 2 结 果
2.1 转染后HEK 293T细胞荧光检测结果(图 1)发现:各组在曝光量相同情况下,SCN5A(S)组可见绿色荧光标记,SCN5A+PRKAG2野生型组(S+P)、SCN5A+G100S组(S+G)、SCN5A+R302Q组(S+R)细胞内均可见绿色和红色荧光标记,表明PRKAG2基因及SCN5A基因均被转染入细胞内。
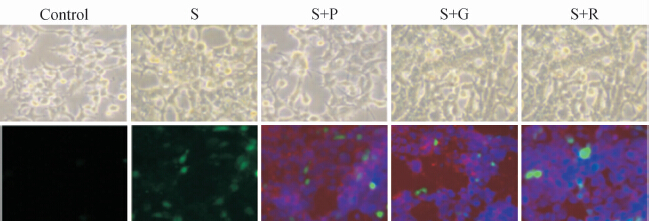 | 图 1 转染后HEK-293T细胞免疫荧光染色 Fig. 1 Immunofluorescence staining of co-transfected HEK-293T cells S: SCN5A; S+P: SCN5A+PRKAG2; S+G: SCN5A+G100S; S+R: SCN5A+R302Q. Original magnification: ×100 |
结果表明:SCN5A组、SCN5A+PRKAG2野生型组、SCN5A+R302Q组、SCN5A+G100S组SCN5A基因均表达,而空白对照组未表达(图 2A),差异有统计学意义(P<0.01);SCN5A+PRKAG2野生型组PRKAG2基因高表达,而SCN5A组、SCN5A+R302Q组、SCN5A+G100S组表达量较低(图 2B),差异有统计学意义(P<0.01)。
 | 图 2 转染后HEK-293T细胞real-time PCR验证 Fig. 2 Real-time PCR verification of co-ransfected HEK-293T cellsA: SCN5A RNA; B: PRKAG2 RNA. S: SCN5A; S+P: SCN5A+PRKAG2; S+G: SCN5A+G100S; S+R: SCN5A+R302Q group. **P<0.01 vs control group; n=9, ±s |
结果(图 3)表明:与空白对照组相比Nav 1.5蛋白在SCN5A组(S)、SCN5A+PRKAG2野生型组(S+P)、SCN5A+R302Q组(S+R)、SCN5A+G100S组(S+G)均有表达,表达量基本相同,而在空白对照组无表达,差异有统计学意义(P<0.05)。与空白对照组相比,AMPKR2(PRKAG2基因编码蛋白)在S+P组高表达,而在S组、S+R组、S+G组表达量较低,差异有统计学意义(P<0.05)。
 | 图 3 转染后HEK-293T细胞的Western印迹验证 Fig. 3 Western blotting analysis for verification of co-ransfected HEK-293T cells S: SCN5A; S+P: SCN5A+PRKAG2; S+G: SCN5A+G100S; S+R: SCN5A+R302Q. *P<0.05 vs control group; n=3, ±s |
3 讨 论
AMPK是一种丝氨酸/苏氨酸激酶,是由1个催化亚基(α)和2个调节亚基(β、γ)组成的异源三聚体复合物。其中α亚单位的Thr-172位点是调节AMPK功能的至关重要的磷酸化位点;β亚基包含2个保守的区域——中间的糖原结合区和C-末端与其他两个亚基的结合区;γ亚基包含4个cystathionine-β-synthase串联重复序列,组成2个Bateman 域,每个Bateman 域能结合1个AMP或ATP。AMPK的活化主要通过以下3种机制:(1)变构激活;(2)通过AMPK的上游激酶(AMPKKs)促使α亚基 Thr-172的磷酸化;(3)抑制PPS的去磷酸化作用。AMPK是重要的能量调节酶,通过增加产能和减少耗能来弥补能量不足[1-2]。经过研究发现,AMPK参与了多种心脏病发生和发展,包括心肌肥厚、心力衰竭、心肌缺血再灌注损伤以及调节心肌细胞离子通道功能,研究发现调节AMPK活性可使心脏获益[4-6]。因此人们越来越认识到,AMPK对心脏来说起着至关重要的作用[1, 3],极有可能成为未来心脏病治疗的新靶点。
心脏的电压-门控钠离子通道是位于心肌细胞的细胞膜跨膜蛋白。钠通道由α亚基及β亚基组成,其中α亚基——Nav1.5(由SCN5A基因编码)由4个结构域(DⅠ~DⅣ)组成,每个结构域包含6个跨膜α-螺旋片段(S1~S6),其中每个结构域的带正电荷的S4形成了电压感应器,在细胞膜去极化时促使通道激活,S5、S6组成了钠离子孔道[7-8]。通过钠离子孔道进入心肌细胞内的钠离子参与了心肌细胞0期快速去极化,在心肌细胞电活动的产生及传导过程中起着核心作用。在生理情况下,钠离子通道的激活和失活受到严格调控,从而保持心肌的兴奋性。先天性或获得性钠离子通道功能异常可导致致命性心律失常的发生,PRKAG2心脏综合征就是由于编码AMPK γ2亚基(由PRKAG2基因编码)的基因点突变的先天性心脏病。Light等[9]研究发现PRKAG2突变体可导致钠通道失活延迟,进而导致心律失常。2007年由张静等[10]首次发现汉族人PRKAG2心脏综合征家系,对该家系进行基因分析发现了一个新的PRKAG2基因突变位点——G100S,该位点区别于之前发现的所有突变位点,它位于非CBS区域。通过对PRKAG2基因非CBS区域的G100S突变进行功能研究,可以明确这一新突变在汉族人PRKAG2心脏综合征家系心律失常发病中的作用通路,并加深对AMPKγ2亚基非CBS区域的功能认识,对全面阐述AMPKγ2亚基在遗传性心脏病中的作用具有重要价值。
本实验通过将编码人心肌细胞钠离子通道的SCN5A基因质粒载体及PRKAG2基因质粒载体共转染HEK-293T细胞,建立了PRKAG2基因突变体对心肌细胞钠离子通道影响的研究模型,从而为研究PRKAG2 G100S突变体对PRKAG2心脏综合征心律失常发病机制的影响奠定了基础。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Arad M,Seidman C E,Seidman J G.AMP-activated protein kinase in the heart: role during health and disease[J].Circ Res,2007,100:474-488. |
| [2] | Xiao B,Sanders M J,Underwood E,Heath R,Mayer F V,Carmena D,et al.Structure of mammalian AMPK and its regulation by ADP[J].Nature,2011,472:230-233. |
| [3] | Zhang L N,Xu L,Zhou H Y,Wu L Y,Li Y Y,Pang T,et al.Novel small-molecule AMP-activated protein kinase allosteric activator with beneficial effects in db/db mice[J].PLoS One,2013,8:e72092. |
| [4] | Chan A Y,Dolinsky V W,Soltys C L,Viollet B,Baksh S,Light P E,et al.Resveratrol inhibits cardiac hypertrophy via AMP-activated protein kinase and Akt[J].J Biol Chem,2008,283:24194-24201. |
| [5] | Shibata R,Sato K,Pimentel D R,Takemura Y,Kihara S,Ohashi K,et al.Adiponectin protects against myocardial ischemia-reperfusion injury through AMPK- and COX-2-dependent mechanisms[J].Nat Med,2005,11:1096-1103. |
| [6] | Harada M,Nattel S N,Nattel S.AMP-activated protein kinase: potential role in cardiac electrophysiology and arrhythmias[J].Circ Arrhythm Electrophysiol,2012,5:860-867. |
| [7] | Balser J R.The cardiac sodium channel: gating function and molecular pharmacology[J].J Mol Cell Cardiol,2001,33:599-613. |
| [8] | Kass R S.Sodium channel inactivation in heart: a novel role of the carboxy-terminal domain[J].J Cardiovasc Electrophysiol,2006,17(Suppl 1):S21-S25. |
| [9] | Light P E,Wallace C H,Dyck J R.Constitutively active adenosine monophosphate-activated protein kinase regulates voltage-gated sodium channels in ventricular myocytes[J].Circulation,2003,107:1962-1965. |
| [10] | 张 静,郑 兴,秦永文,周炳炎,吴 弘,王洪如.家族性传导系统异常伴心室预激及心肌肥厚一家系调查分析[J].中华心血管病杂志,2007,35:258-259. |
 2014, Vol. 35
2014, Vol. 35


